亚麻荠FAD2-1和FAD3-1编码蛋白的生物信息学分析
2016-05-12刘宝玲孙岩高昌勇苑丽霞薛金爱李润植张莉
刘宝玲,孙岩,高昌勇,苑丽霞,3,薛金爱,李润植,张莉*
(1.山西农业大学农学院分子农业与生物能源研究所,山西 太谷 030801; 2.山西农业大学生命科学学院,山西 太谷 030801;
3.晋中学院生物科学与技术学院, 山西 晋中 030600)
亚麻荠FAD2-1和FAD3-1编码蛋白的生物信息学分析
刘宝玲1,孙岩2,高昌勇1,苑丽霞1,3,薛金爱1,李润植1,张莉1*
(1.山西农业大学农学院分子农业与生物能源研究所,山西 太谷 030801; 2.山西农业大学生命科学学院,山西 太谷 030801;
3.晋中学院生物科学与技术学院, 山西 晋中 030600)
摘要:△-12 脂肪酸脱氢酶FAD2(fatty acid desaturase 2)和△-15 脂肪酸脱氢酶FAD3(fatty acid desaturase 3)是控制亚油酸(18∶2;ω-6)和亚麻酸(18∶3;ω-3)合成的限速酶,亦在植物抵御低温等环境胁迫反应中起重要作用。本文利用生物信息学工具分析了亚麻荠(Camelina sativa)FAD2-1和FAD3-1编码蛋白的理化性质、二硫键、磷酸化位点、高级结构、保守域和功能系统进化等特征。结果表明,FAD2-1和FAD3-1编码蛋白理论pI相近(分别为8.39和8.42),然而前者不稳定系数(40.04)显著高于后者(29.46)。FAD2-1蛋白的磷酸化位点为23个,多于FAD3磷酸化位点(18个),预示FAD2-1更易受翻译后调控。这两种蛋白均含有3个保守的组氨酸富集区(Hisbox),且在C端含有内质网滞留信号,赋予其定位于内质网和催化双键形成的活性。FAD2-1的a-螺旋比例(45.31%)高于FAD3-1(33.16%),然而后者无规则卷曲比例(51.93%)大于前者(44.53%)。3D结构模拟显示,FAD2-1和FAD3-1功能域大小和构象存在差异,这可能影响到底物选择性和催化效率。这些结果为全面解析亚麻荠种子油脂合成和ω-3族脂肪酸富集的分子机理提供了科学参考。
关键词:亚麻荠;ω-3与ω-6族脂肪酸;脂肪酸脱饱和酶(FAD);生物信息学分析
植物油脂是人类饮食的主要脂肪酸营养来源,其脂肪酸组成影响着油脂的品质和功能。ω-3族(第一个双键出现在从甲基端数第三个碳原子处)和ω-6族(第一个双键出现在从甲基端数第六个碳原子处)不饱和脂肪酸是大豆和油菜等普通油料作物种子油的主要脂肪酸成分,这两类脂肪酸含量比例决定着植物油脂的营养价值和保健功能。普通油料作物种子油脂肪酸组成是ω-6族含量>ω-3族, 极不利于人类营养和健康。亚麻荠(Camelina sativa)是一种新发掘的十字花科高油作物(含油量>47%),种子油中ω-3族脂肪酸显著高于ω-6族含量,非常适合人类营养和健康需求。因此,基于亚麻荠油的诸多营养保健品研发近年来日益增多。然而,有关亚麻荠种子高水平合成积累ω-3族脂肪酸机制还未见报道[1]。
亚油酸(18∶2)和亚麻酸(18∶3)分别是植物油脂中最主要的ω-6族和ω-3族脂肪酸,也是人体自身无法合成的必需脂肪酸[2,3]。催化油酸(18∶1)转化为亚油酸(18∶2)的ω-6脂肪酸脱饱和酶是△-12 脂肪酸脱氢酶(fattyaciddesaturase-2,FAD2),催化亚油酸(18∶2)转化为亚麻酸(18∶3)的ω-3脂肪酸脱饱和酶是△-15 脂肪酸脱氢酶(fattyaciddesaturase-3,FAD3)。近年来,有关FAD2和FAD3在多不饱和脂肪酸(polyunsaturatedfattyacids,PUFA)合成途径及控制ω-6族和ω-3族脂肪酸比例中的作用备受关注[4]。此外,FAD2和FAD3也参与了植物低温等环境胁迫抗性反应。FAD2和FAD3均为膜结合型脱氢酶,定位于植物细胞的内质网表面[5]。FAD3主要在组织中催化合成约 80%的三烯脂肪酸。目前,国内外学者已在甘蓝型油菜[6,7]、大豆[8]、花生[9]、红花[10]、棉花[11,12]和烟草[13]等油料作物和药用植物中成功克隆出FAD2基因,并做了相关的超表达和沉默表达分析,为油脂合成研究奠定了一定的理论和实验基础。FAD3基因的克隆、表达、调控功能及其家族进化关系[14]也在相关文献中有所报道。
全基因组测序显示亚麻荠为异源六倍体[1],在漫长的进化过程中,其染色体基因发生了复杂的加倍现象。亚麻荠CsFAD2和CsFAD3基因位于不同染色体不同位置的同源序列各有3个拷贝,且同源性均高达99%[15]。我们先期试验结果显示,CsFAD2-1和CsFAD3-1在发育种子中高表达,预示着这两个ω-6和ω-3脱饱和酶在亚麻荠种子油脂合成和积累中行使重要功能[1]。本文进一步利用生物信息学方法分析这两种脱饱和酶的蛋白结构和理化性质等特征及功能差异性,为全面解析亚麻荠种子高水平合成积累ω-3族脂肪酸分子机理,以及后续定向遗传改变植物种子油脂肪酸组成提供科学依据。
1材料与方法
1.1亚麻荠脱饱和酶基因鉴定及其编码蛋白的理化性质分析
从NCBI中的conserved domain database(CDD)库(http://www.ncbi.nlm.nih.gov/structure/cdd/wrpsb.cgi)获得CsFAD2酶和CsFAD3酶的结构域:二铁离子结合位点-组氨酸富集区[16]。在亚麻荠数据库下载编码序列(CDS)及其蛋白序列:FAD2-HQ008320.1/ ADU18247.1和FAD3-KJ541074.1/AHZ89305.1,分别命名为FAD2-1和FAD3-1。以隐马可夫模型在CDD库中鉴定亚麻荠的FAD2-1和FAD3-1蛋白序列的保守域结构,确定这些基因是准确的ω-6和ω-3脂肪酸脱饱和酶基因。利用ExPasy网站提供的ProtParam工具(http://web.expasy.org/protparam/)分析亚麻荠FAD2-1和FAD3-1蛋白的氨基酸组成、相对分子量、等电点和原子组成等理化性质。
1.2亚麻荠FAD2-1和FAD3-1蛋白序列的一级结构分析
利用DiANNA工具(http://clavius.bc.edu/~clotelab/DiANNA/)对亚麻荠FAD2-1和FAD3-1蛋白序列中二硫键的分布进行预测分析;运用CBS(http://www.cbs.dtu.dk/services/)在线网站分析上述蛋白的葡萄糖-O-糖基化位点和磷酸化位点(http://www.cbs.dtu.dk/services/NetPhos/)。利用ExPasy网站中的TMHMM工具(http://www.cbs.dtu.dk/services/TMHMM/)、Protscale网站(http://web.expasy.org/protscale/ )及Signal P 工具(http://www.cbs.dtu.dk/services/SignalP/)来分析上述蛋白序列的跨膜区域、疏水区域和信号肽区。
1.3亚麻荠FAD2-1和FAD3-1蛋白序列的高级结构预测分析
通过PBIL LYON-GERLAND数据库(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_hnn. html)对亚麻荠FAD2蛋白序列进行二级结构分析,采用默认设置。利用Phyre2网站(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)对上述蛋白采用同源建模法进行三级结构预测分析,采用Intensive模式。
1.4CsFAD2-1和CsFAD3-1蛋白序列保守域鉴定及其系统发育关系
运用MEGA 6.0多序列比对软件[17]对亚麻荠两种脱饱和酶和其他物种的10种蛋白序列进行多序列比对,采用邻接法(Neighbor-Joining,NJ)构建系统发育树,其中自举检验值设置为1000个循环。利用软件Genedoc对上述各物种进行多序列比对,从中找出保守域,参数project/configure/shade level值设置为no shading。
2结果与分析
2.1亚麻荠CsFAD2-1和CsFAD3-1脱饱和酶的理化性质分析
利用ExPASy网站用protparam工具对CsFAD2-1和CsFAD3-1脱饱和酶进行理化性质分析。结果表明,二者都由20种氨基酸构成,其中CsFAD2-1蛋白中含量最高的氨基酸有Ala、Leu、Tyr ,CsFAD3-1中含量最高的是Val、Leu、Ser。虽然二者所含的Cys、Gln、Met数量最少,但是CsFAD3-1含量比CsFAD2-1更低。CsFAD2-1和CsFAD3-1分子量分别为44.05和44.24 kD(表1),与所对应的拟南芥脱饱和酶的分子量很接近。理论等电点pI都在8.39以上,CsFAD2-1和CsFAD3-1在280 nm时消光系数分别为104 335 和 95 020,不稳定系数分别是40.04、29.46,显然CsFAD2-1蛋白不稳定,而CsFAD3-1为稳定蛋白。CsFAD2-1和CsFAD3-1的脂肪系数是84.84和88.43,总的平均亲水性为-0.072和-0.106,说明这些蛋白亲水性很差,属于疏水性蛋白。
表1亚麻荠CsFAD2-1和CsFAD3-1蛋白理化性质分析
Table 1Physical and chemical properties of CsFAD2-1 and CsFAD3-1 protein analysis inCamelinasativa
2.2亚麻荠CsFAD2-1和CsFAD3-1脱饱和酶的一级结构分析
2.2.1CsFAD2-1和CsFAD3-1脱饱和酶的二硫键分析
对亚麻荠CsFAD2-1和CsFAD3-1进行二硫键分析,结果显示,CsFAD2-1蛋白序列可能形成5个二硫键,分值最高的是第209~363位,为0.997 27,在第7号α螺旋和10号α螺旋之间形成二硫键(α7-α10),与拟南芥AtFAD2的二硫键预测结果很接近(表2)。而CsFAD3-1的二硫键较CsFAD2-1和AtFAD3得分率低,推测其在内质网中弯曲折叠程度低于其他蛋白,能够更好地结合底物,发挥其催化作用。
2.2.2CsFAD2-1和CsFAD3-1糖基化位点和磷酸化位点分析
预测发现这两种蛋白并没有葡萄糖-O-糖基化位点,CsFAD2-1丝氨酸激酶(Ser)和酪氨酸激酶(Thr)磷酸化位点数(12个、10个)比CsFAD3-1(11个、4个)多(表3),分别在N端和C端分布比较密集,而后者分布较疏散(图1)。苏氨酸激酶磷酸化位点数(1个)则少于CsFAD3-1(3个),且该磷酸化位点得分均低于上述两种,推测其在苏氨酸处磷酸化的可能性较低。另外,CsFAD3-1的总磷酸化位点数(18个)明显高于拟南芥AtFAD3(8),有可能CsFAD3-1在催化亚油酸合成亚麻酸的过程中,更能被上述三种激酶磷酸化,从而更好地发挥催化功能。

表2 亚麻荠CsFAD2-1和CsFAD3-1的二硫键分析
表3CsFAD2-1和CsFAD3-1蛋白磷酸化位点分析
Table 3Phosphorylation sites analysis of CsFAD2-1 and CsFAD3-1 inCamelinasativa

基因名称Proteinname磷酸化位点数Phosphorylationsitenumbers最高得分及位置HighestscoreandlocationSer12第17位:0.998CsFAD2-1Thr123第33位:0.648Tyr10第365位:0.979Ser11第16位:0.998AtFAD2Thr224第21位:0.980Tyr11第364位:0.979Ser11第170位:0.996CsFAD3-1Thr318第220位:0.769Tyr4第362位:0.985Ser5第167位:0.996AtFAD3Thr18第217位:0.769Tyr2第281位:0.871
2.2.3CsFAD2-1和CsFAD3-1的跨膜区和疏水性分析
利用TMHMM工具对CsFAD2-1以及CsFAD3-1蛋白进行跨膜结构预测(图2a,图2b分别表示亚麻荠FAD2-1和FAD3-1蛋白的跨膜螺旋;图2c,图2d分别表示拟南芥FAD2和FAD3蛋白的跨膜螺旋),结果发现CsFAD2-1蛋白在内质网膜上由外到内有5个跨膜区,其对应的跨膜位置为o55-77i84-106o116-138i175-197o248-270i(如图2a,“o”代表膜外,“i”代表膜内),而由CsFAD3-1蛋白则由膜内到膜外有3个跨膜螺旋区,其对应的跨膜位置为i64-86o112-134i221-248o(如图2b)。CsFAD2-1比拟南芥AtFAD2(如图2c)的跨膜区数目少一个,形成的跨膜区位置极为相似,有可能在发挥催化作用时,可能在十字花科植物中具有类似的代谢通路。而CsFAD3-1则与拟南芥AtFAD3-1(如图2d)相比,其跨膜区数目较少,有相似的部分跨膜区位置,推测其催化亚麻酸合成过程中,不同的结构有可能参与其他的生化代谢途径。采用Protscale网站和SignalP网站分析CsFAD2-1和CsFAD3-1蛋白的疏水性和信号肽区。有跨膜的区域,疏水性较高,其本身作为一种膜结合蛋白,因而是疏水蛋白。经信号肽检测,这两种蛋白都没有信号肽和酶切位点,说明这两种蛋白光定位在内质网膜上,并不跨膜分泌到其他位置。
2.3亚麻荠CsFAD2-1和CsFAD3-1脱饱和酶的高级结构分析
通过PBIL LYON-GERLAND网站对CsFAD2-1和CsFAD3-1蛋白进行二级结构预测(如图3),这些蛋白仅含有三种结构,分别为α螺旋、β片层和无规则卷曲,占据不同的比例。CsFAD2-1蛋白α螺旋、β片层和无规则卷曲占的比例分别为:45.31%、10.16%和44.53%,与AtFAD2的结构比例相差不多。而CsFAD3-1所含的比例分别为:33.16%、14.91%和51.93%。其螺旋数较少,β片层和无规则卷曲却比CsFAD2-1蛋白多。这与上述的跨膜区和疏水区预测结果是一致的。用同源建模的方法来预测这两种蛋白的三级结构(如图4),CsFAD2-1预测的氨基酸范围达到65%,估测率为99.9%,而CsFAD3-1的估测率大于90%时,氨基酸范围为75%,很明显其不规则卷曲程度较高。
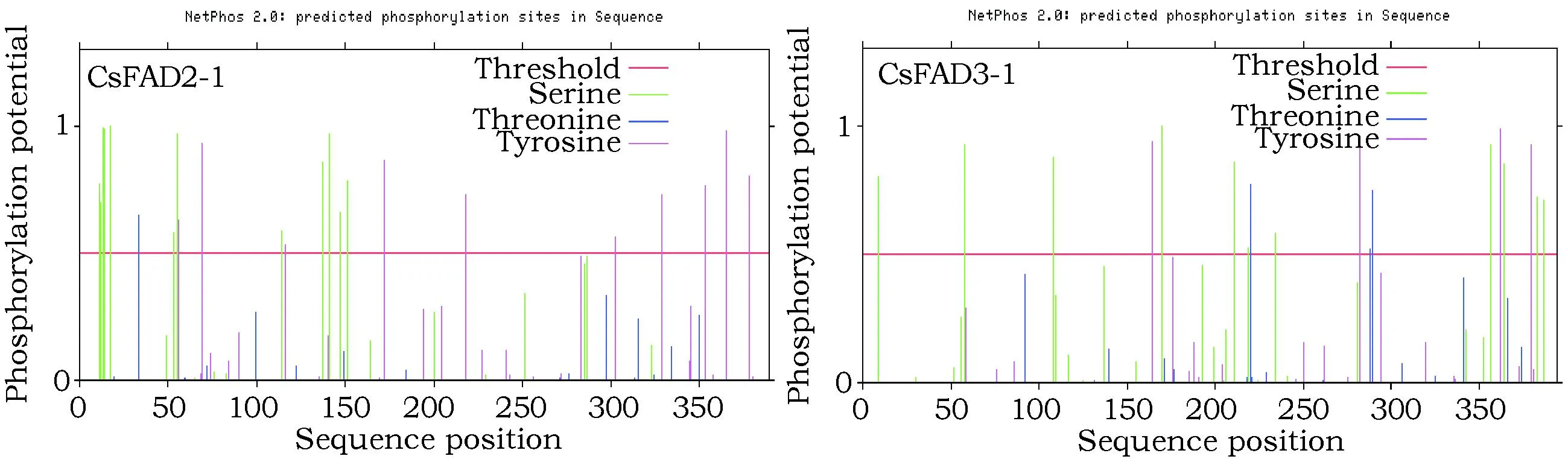
图1 亚麻荠CsFAD2-1和CsFAD3-1蛋白磷酸化位点分布图Fig.1 Phosphorylation sites analysis of CsFAD2-1 and CsFAD3-1 in Camelina sativa

图2 亚麻荠脱饱和酶CsFAD2-1和CsFAD3-1的蛋白跨膜螺旋分析 (a,b分别表示亚麻荠FAD2-1和FAD3-1蛋白的跨膜螺旋;c,d分别表示拟南芥FAD2和FAD3蛋白的跨膜螺旋)Fig.2 The transmembrane helix antenna analysis of desaturase CsFAD2-1 and CsFAD3-1 in Camelina sativa (a,b, present the transmembrane helical of FAD3-1 and FAD2-1 protein in Camelina sativa; c, d, present the transmembrane helical of FAD2 and FAD3 protein in Arabidopsis thaliana)
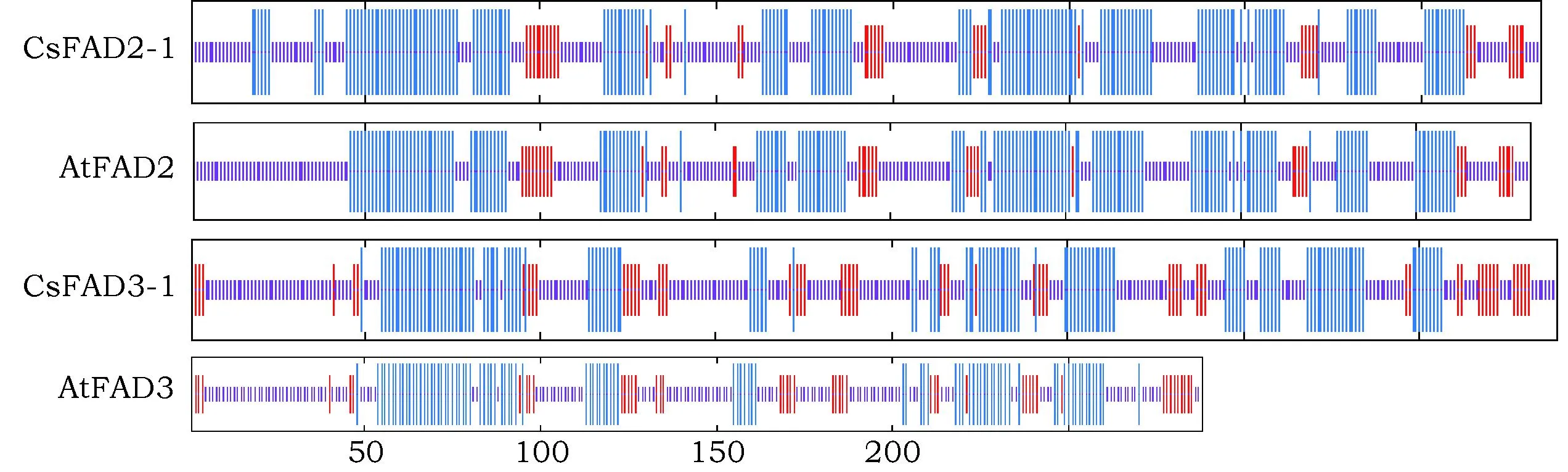
图3 亚麻荠CsFAD2-1和CsFAD3-1的二级结构预测(蓝色线:α螺旋,粉色线:无规则卷曲,红色线:β片层)Fig.3 The second structure prediction of CsFAD2-1 and CsFAD3-1 in Camelina sativa (Blue line:αhelix, pink line :random coil, red line:βsheet)

图4 亚麻荠CsFAD2-1和CsFAD3-1的三级结构预测(红色:肽链N端,蓝色:肽链C端)Fig.4 The third structure prediction of CsFAD2-1 and CsFAD3-1 in Camelina sativa (Red: N terminal of peptide, blue :C terminal of peptide)
2.4保守域及系统发育分析
利用GeneDoc软件对各物种FAD2和FAD3蛋白序列进行多序列比对,从中找到亚麻荠的组氨酸保守域及其内质网滞留信号(图5)。发现亚麻荠CsFAD2-1、CsFAD3-1及其同源序列也具有其他物种ω-6和ω-3脂肪酸脱饱和酶所具有的3个组氨酸富集区,即Hisbox I、Hisbox II和Hisbox III。ω-6脂肪酸脱饱和酶组氨酸保守区分别为:HECGHH、PYFSWKYSHRRHH和HNITDTHVAHX,而ω-3脂肪酸脱饱和酶的为:HDCGHG、HGWRSHRTHH和HHDIGTHVIHH,保守区的组成有所不同,但是都能各自形成酶活性催化中心及其铁原子结合部位。通过分析,也发现了这些蛋白都在C端不同程度存在内质网滞留信号KKXX-like motif (图5,且因FAD2和FAD3基因不同,滞留信号数量有所差别。从中也发现了亚麻荠CsFAD2-1的KKXX-like motif与其他物种没有太大差别,而CsFAD3-1及其同源序列拥有特异性的内质网滞留信号,如KKKGE、KKDH(图5阴影),其在内质网上的滞留方式可能与其他物种的相应蛋白不同,其数目少于CsFAD2-1,与跨膜数、疏水性和螺旋数都是一致的,推测其结合区较少,裸露在内质网的部分较多,可能和底物结合更加紧密,催化反应比ω-6脂肪酸脱饱和酶效率更高。可以用MEGA 6.0软件对不同物种脱饱和脂肪酸脱氢酶(表4)进行多序列比对,并构建系统发育树(如图6)。从中可以得出,进化树可以分为FAD2和FAD3两大分支,说明ω-6脱饱和酶基因和ω-3脂肪酸脱饱和酶基因编码的蛋白序列还是有较大差别的,而在各个分支中十字花科的物种FAD蛋白均聚类在一起,如亚麻荠、甘蓝型油菜、芥菜和拟南芥。
表4不同物种FAD蛋白序列信息
Table 4The information of different species FAD protein sequence

Genbank登录号Genbankaccession物种Species拉丁文名Latinname蛋白简称ProteinacronymADU18247.1亚麻荠CamelinasativaCsFAD2-1ADU18248.1亚麻荠CamelinasativaCsFAD2-2ADU18249.1亚麻荠CamelinasativaCsFAD2-3NP_187819.1拟南芥ArabidopsisthalianaATFAD2XP_008443062.1甜瓜CucumismeloCmFAD2ACF49507.1亚麻LinumusitatissimumLuFAD2AAL37484.1陆地棉GossypiumhirsutumGhFAD2XP_003625259.1蒺藜苜蓿MedicagotruncatulaMtFAD2ADJ58018.1甘蓝型芥菜BrassicanigraBniFAD2ACP39505.1甘蓝型油菜BrassicanapusBnaFAD2AHZ89305.1亚麻荠CamelinasativaCsFAD3-1AHZ89306.1亚麻荠CamelinasativaCsFAD3-2AHZ89307.1亚麻荠CamelinasativaCsFAD3-3AEC08331.1拟南芥ArabidopsisthalianaAtFAD3NP_001236943.1大豆GlycinemaxGmFAD3ADP07952.1棉豆PhaseoluslunatusPlFAD3NP_001292929.1麻疯树JatrophacurcasJcFAD3AIY68469.1陆地棉GossypiumhirsutumGhFAD3XP_002298309.1毛白杨PopulustrichocarpaPtFAD3XP_004294292.1草莓FragariavescaFvFAD3


图6 各物种FAD2和FAD3蛋白系统发育树Fig.6 The phylogenetic tree of FAD2 and FAD3 proteins of different species
3讨论
本文分别以拟南芥AtFAD2和AtFAD3为参照,对亚麻荠CsFAD2-1和CsFAD3-1蛋白序列进行了较为全面的生物信息学分析。从理化性质、跨膜区、疏水区、二级结构及三级结构分析,发现亚麻荠这两种脂肪酸脱饱和酶蛋白疏水性较高,在跨膜区有明显的疏水性质。CsFAD2-1的二级结构α螺旋比CsFAD3-1多,且分布更为密集,这一特征也体现在三级结构中。与其他ω-6和ω-3脂肪酸脱饱和酶相似[18],本研究发现亚麻荠CsFAD2-1和CsFAD3-1也属于膜结合蛋白,其蛋白序列3个组氨酸富集框基本一样。这些保守域在空间结构上形成了酶的催化活性中心,以及所必需的铁原子结合位点。 FAD2-1蛋白C端都有内质网滞留信号KKXX-like motif[14]。亚麻荠FAD3-1蛋白在内质网上的滞留信号比其他物种明显,自身还拥有特异性赖氨酸保守区,可以与膜上镶嵌的蛋白氨基酸形成共价键从而锚定到内质网上,其锚定方式与其他物种有所差别。这种锚定方式的差异可能有利于催化更多的亚油酸(ω-6)转化为亚麻酸(ω-3)。
一些研究依据功能分析认为[19],FAD3是从FAD2进化而来。我们对CsFAD2-1和CsFAD3-1结构分析亦显示这种进化路径, 即先出现FAD2催化油酸(18∶1)合成一个双键而生成亚油酸(18∶2), 接着 FAD3催化亚油酸(18∶2)再产生一个双键而合成亚麻酸(18∶3)。CsFAD2-1和CsFAD3-1蛋白组氨酸富集区的不同位置,而不同位置的组氨酸富集区对酶空间构象和功能域起着决定性的作用,则说明这两种酶虽然都催化碳碳单键合成碳碳双键,但因其底物特异性,有可能将同一种碳碳单键形成顺式或者反式双键[20],在功能分化方面有着较大差异,这与Cahoon等[21~23]的报道一致,脱饱和酶的功能分化可能与底物结合的空间构象有关。
总之,本文对亚麻荠CsFAD2-1和CsFAD3-1的生物信息学分析进一步表明CsFAD2-1和CsFAD3-1在亚麻荠种子油脂合成起重要作用。亚油酸易氧化,营养价值低。然而,油酸与之相反,是一类健康有益型脂肪酸。未来可采用RNAi等技术沉默CsFAD2-1,减少亚油酸生成,使油酸大量积累,培育富含油酸的亚麻荠专用种质。也可通过遗传修饰上调CsFAD3-1表达和酶活性,不仅促使亚麻酸(ω-3)富集,而且有利于增加其他长链ω-3族脂肪酸(如,二十碳五烯酸,EPA和二十二碳六烯酸DHA)的合成积累,培育获得具有更高保健功效的特用油脂品种。进一步研究需阐明亚麻荠这两个脱饱和酶的精细表达调控机制。
参考文献
[1]苑丽霞,毛雪,高昌勇,等.种子特异表达二酰甘油酰基转移酶基因(VgDGAT1)提高亚麻荠种子油脂积累[J].植物生理学报,2015, 51 (5): 668-678.
[2]Guan C Y. Advances on rape breeding for higher content of oleic acid[J]. Crop Research,2006,20:1-7.
[3]Xiao G, Zhang Z Q, Chang F Y, et al.Characterization of the promoter and 5′-UTR intron of oleic acid desaturase (FAD2) gene in Brassica napus[J].Gene,2014,545:45-55.
[4]Ashwini V R, Narendra Y K,Sanjay P B,et al.Differential transcriptional activity ofSAD,FAD2 andFAD3 desaturase genes in developing seeds of linseed contributes to varietal variation in a-linolenic acid content [J].Phytochemistry,2014, 98:41-53.
[5]Zhang D Y, Pirtle I, Stacy J P, et al. Identification and expression of a new delta-12 fatty acid desaturase (FAD2-4) gene in upland cotton and its functional expression in yeast and Arabidopsis thaliana plant[J].Plant Physiology and Biochemistry, 2009,47:462-471.
[6]刘芳,刘睿洋,彭烨,等.甘蓝型油菜BnFAD2-C1 基因全长序列的克隆、表达及转录调控元件分析[J].作物学报,2015,41(11):1-9.
[7]熊兴华,官春云,王学军,等.甘蓝型油菜FAD2基因 cDNA片段的克隆和序列分析[J].湖南农业大学学报,2002,28(2):97-99.
[8]Pham A T, Lee J D, Shannon J G, et al. Mutant alleles ofFAD2-1A andFAD2-1B combine to produce soybeans with the high oleic acid seed oil trait[J].BMC Plant Biology 2010, 10:195.
[9]Wang Y, Zhang X G, Zhao Y L, et al. Insights into the novel members of theFAD2 gene family involved in high-oleate fluxes in peanut[J].Genome,2015, 58:375-383.
[10]Cao S J, Zhou X R, Craig C W, et al. A large and functionally diverse family of Fad2 genes in safflower (Carthamus tinctorius L.)[J].BMC Plant Biology,2013, 13:5.
[11]Liu W, Li W, He Q L, et al. Characterization of 19 genes encoding membrane-bound fatty acid desaturases and their expression profiles in gossypium raimondii under low temperature[J].PLoS ONE,2015,10(4): e0123281.
[12]Kargiotidou A, Deli D, Galanopoulou D, et al. Low temperature and light regulate delta 12 fatty acid desaturases (FAD2) at a transcriptional level in cotton (Gossypium hirsutum)[J].Journal of Experimental Botany, 2008, 59(8):2043-2056.
[13]Naim F, Nakasugi K, Crowhurst R N, et al.Advanced engineering of lipid metabolism in using a draft genome and the V2 Viral silencing-suppressor protein[J].PLoS ONE 7(12): e52717.
[14]官玲亮,侯凯,陈郡雯,等.ω-6和ω-3脂肪酸脱氢酶家族系统进化与功能分化[J].遗传,2013,35(5):643-654.
[15]Kang J L, Snapp A R, Lu C F. Identification of three genes encoding microsomal oleate desaturases (FAD2) from the oilseed crop Camelina sativa[J].Plant Physiology and Biochemistry,2011, 49:223-229.
[16]Okada S, Zhou X R,Damcevski K,et al.Diversity of 12 Fatty Acid Desaturases in Santalaceae and Their Role in Production of Seed Oil Acetylenic Fatty Acids[J].THE JOURNAL OF BIOLOGICAL CHEMISTRY VOL,2013,288(45): 32405-32413.
[17]Kumar S, Nei M, Dudley J, Tamura K.MEGA: a biologist-centric software for evolutionary analysis of DNA and protein sequences[J].Brief Bioinform. 2008,9(4):299-306.
[18]戴晓峰,肖玲,武玉花,等.植物脂肪酸脱饱和酶及其编码基因研究进展[J]. 植物学通报, 2007,24(1): 105-113.
[19]López Alonso D, García-Maroto F, Rodríguez-Ruiz J, et al. Evolution of the membranebound fatty acid desaturases[J]. Biochem Syst Ecol, 2003,31(10): 1111-1124.
[20]Lindgvid Y, Hu W T, Schneider G, et al. Crystal structure of Δ9 stearoyl-acyl carrier protein desaturase from castor seed and its relationship to other di-iron protein[J]. EMBO J, 1996, 15(16): 4081-4092.
[21]Cahoon E B. 6 Hecadecenoif acid is synthesized by the activity of a soluble ?6 palmitoyl-acyl carrier protein desaturase in Thunberglala endosperm[J]. J Biol Chem, 1994,269: 27519-27526.
[22]Cahoon E B, Lindqvist Y, Schneider G, et al. Redesign of soluble fatty acid desaturases from plants for altered substrate specificity and double bond position[J]. Proc Natl Acad Sci USA, 1997, 94(10): 4872-4877.
[23]Cahoon E B, Ripp K G, Hall S E, et al. Formation of conjugated Δ8, Δ10-double bonds by Δ12-oleic-acid desaturase-related enzymes: biosynthetic origin of calendic acid[J].J Biol Chem, 2001, 276(4): 2637-2643.
(编辑:邢国芳)
Bioinformatics analysis of FAD2-1 and FAD3-1 coding proteins inCamelinaSativa
LiuBaoling1,SunYan2,GaoChangyong1,YuanLixia1,3,XueJinai1,LiRunzhi1,ZhangLi1*
(1.Institute of Molecular Agriculture and Bioenergy, Shanxi Agricultural University, Taigu 030801, China; 2.College of Life Science,Shanxi Agricultural University, Taigu 030801, China; 3.College of Biological Science and Technology, Jinzhong University, Jinzhong 030600, China)
Abstract:FAD2(fatty acid desaturase 2) and FAD3 (fatty acid desaturase 3) are the rate-limiting enzymes responsible for linoleic acid (18∶2; ω-6) and α-linolenic acid (18∶3; ω-3) synthesis pathway, and also function importantly in plant responses against cold and other environmental stresses. In the present study, bioinformatics tools were employed to characterize CsFAD2-1 and CsFAD3-1 proteins in Camelina sativa, including physicochemical properties, disulfide, phosphorylation sites, advanced 3D structure, and evolutionary conserved domain. It was shown that the theoretical pI values of CsFAD2-1(8.39) and CsFAD3-1 (8.42) proteins were similar, while the former had higher instability coefficient (40.04) than the later (29.46). CsFAD2-1 contained 23 phosphorylation sites more than CsFAD3-1’s (18 sites), indicating CsFAD2-1 was more possibly affected by post-translational regulation. Both proteins shared three highly conserved histidine rich motifs (Hisbox), with endoplasmic reticulum (ER) retention signal at the C-terminus, offering their locations in ER and calalytic activities for double-bond formation. There were moreɑ-helix in CsFAD2-1 (45.31%) than in CsFAD3-1(33.16%) while more random coils exited in CsFAD3-1 (51.93%) than in CsFAD2-1 (44.53%). 3D structure simulation revealed that there were differences in functional domain size and confirmation for both proteins, suggesting the two proteins have different substrate selectivity and enzymatic activity. All these results provide a scientific reference for understanding the molecular mechanism underlying lipid biosynthesis and ω-3 fatty acid high accumulation in camelina seeds.
Key words:Camelina sativa; ω-3 and ω-6 fatty acids; Fatty acid desaturase (FAD); Bioinformatics analysis
中图分类号:S565.9
文献标识码:A
文章编号:1671-8151(2016)04-0242-09
基金项目:国家自然基金(31401430和31501323),山西省自然科学基金(2013021024-1)
作者简介:刘宝玲(1988-),女(汉),山西朔州人,硕士研究生,研究方向:分子遗传与基因工程*通讯作者:张莉,副教授,硕士生导师。Tel:15835431430,E-mail:zhangli7912@163.com
收稿日期:2015-12-28修回日期:2016-02-02
