银杏叶中总黄酮醇苷成分定量分析方法研究
2016-05-12曹便利王荞薇连琦谢媛媛王义明罗国安
曹便利,王荞薇,连琦,谢媛媛*,王义明,罗国安
·炮制制剂·
银杏叶中总黄酮醇苷成分定量分析方法研究
曹便利1,2,王荞薇2,连琦2,谢媛媛2*,王义明2,罗国安2
目的:建立银杏叶药材中总黄酮醇苷类成分含量测定方法。方法:分别采用高效液相色谱法(HPLC法)和紫外-可见分光光度法(UV法)测定银杏叶中黄酮类成分的含量,所测得结果进行比较。HPLC法为改良药典方法,采用Phenomenex C18(250 mm×4.6 mm,5 μm)色谱柱,柱温35 ℃,流动相为0.4 %磷酸-甲醇(50:50),流速1.0 mL·min-1,检测波长为360nm。结果:HPLC法测定山柰酚、槲皮素和异鼠李素分别在1.20–120 mg·L-1,1.50–150 mg·L-1,0.68–68 mg·L-1浓度范围内,线性关系良好(r= 1.000);UV法芦丁在8.84–26.52 mg·L-1浓度范围内,线性关系良好(r = 0.9993),加样回收率为102.4%。采用HPLC法测定银杏叶中总黄酮含量(上述3种成分含量之和 × 2.51)显著低于UV法测定结果,说明银杏叶药材中含有其他酚酸类成分。结论:该方法简便、准确、重现性好。
银杏叶;总黄酮;山柰酚;鼠李素;槲皮素;高效液相色谱法;含量测定
近现代以来,各国学者已从银杏叶中发现多种神经保护、抗肿瘤、抗病毒、抗菌抗炎活性成分,包括黄酮类、萜类、酚类、聚异戊烯醇类等[1]。银杏叶提取物也已成为功能性保健食品中使用频次最高的15个原料之一[2]。其中银杏叶黄酮醇苷类成分是银杏叶原料及其制剂质量控制重要指标成分[3]。黄酮醇苷类成分水解后只有3种黄酮醇苷元,即槲皮素、山柰酚和少量异鼠李素,因此,2010年版《中国药典》收载的银杏叶及其制剂的质量标准中,均采用盐酸水解后HPLC测定上述3种苷元的含量[4-5]。紫外-分光光度法是常见总黄酮测定方法之一,其中以亚硝酸钠–硝酸铝–氢氧化钠法最常用,但因具有邻二酚羟基的非黄酮类物质在最大波长处510 nm左右也有较强吸收,所以本法专属性不强,而银杏叶黄酮类化合物结构中含有5-羟基、4-羰基,能与AlCl3进行反应生成有色的络合物,是一个针对性较强的银杏叶总黄酮含量测定方法。
本研究在2010年版《中国药典》银杏叶项下收载的总黄酮醇苷含量测定方法基础上,对供试品溶液制备方法进行系统考察和优化,提高了检测效率,并测定了不同采收期银杏叶药材中总黄酮醇苷类成分含量测定,同时与紫外分光光度法测定的总黄酮醇苷含量比较,旨在为银杏叶药材质量标准化研究提供科学依据。
1 仪器与试药
1.1 仪器
Agilent 1200 series 高效液相色谱仪(包括在线脱气机G1322A,低压二元梯度泵G1312A,自动进样器G1329A,柱温箱G1316A,二极管阵列检测器G1315D,ChemStation化学工作站,美国Agilent科技有限公司),RQ-250B型超声波清洗器(昆山市超声仪器有限公司),PB303-N电子天平(MEETTLER TOLEDO,0.001 g),UV-1100紫外可见分光光度计(恒业仪器公司);Milli-Q Synthesis 超纯水纯化系统(美国密理博公司);XS105型电子天平(d=0.01mg,梅特勒-托利多公司),KQ-500E型超声波清洗器(功率500W,频率40kHz),0.45 μm微孔滤头(津腾公司)。
1.2 对照品
芦丁(纯度大于98%,批号100080-200707),槲皮素(纯度大于98%,批号100081-200907),山柰酚(纯度大于98%,批号110861-200808)和异鼠李素(纯度大于98%,批号110860-200608)均购于中国药品生物制品检定所。
1.3 试剂
甲醇、乙醇、盐酸、磷酸(分析纯,北京化工厂),甲酸(色谱纯,Fisher),乙腈、甲醇(色谱纯,Fisher);结晶三氯化铝(北京化工厂,分析纯)。
1.4 药材
本实验所有34批银杏叶药材(表1)分别于不同季节采集于山东郯城、陕西宁强和江苏邳州等地,经黑龙江珍宝岛药业股份有限公司许照芹高级工程师鉴定均为银杏(Ginkgo biloba L.)的干燥叶,凭证标本存放于清华大学化学系。
2 方法
2.1 色谱条件与系统适用性
色谱柱:PhenomenexLuna C18色谱柱(4.6 × 250 mm,5 μm);以乙腈-0.4%磷酸(50:50)为流动相;检测波长:360 nm;柱温:40 ℃;流速:1.0 mL·min-1;进样量:20 μL;理论塔板数以槲皮素、山柰酚和异鼠李素计算均为10000以上。3种组分之间分离度大于1.5,拖尾因子在0.8~0.9之间。
2.2 供试品溶液制备
取银杏叶粉末1.00 g,精密称定,加5%盐酸-甲醇溶液30 mL,加热回流(90 ℃)水解提取30 min,放冷,转移至50 mL量瓶中,并加甲醇至刻度,摇匀,0.45 μm微孔滤膜滤过,取续滤液,即得供试品溶液(HPLC)。
精密称取银杏叶0.5 g,置于150 mL圆底烧瓶中,加入70 %甲醇20 mL,加热回流(90 ℃)提取两次,每次30 min,合并两次70 %甲醇提取液,水浴蒸干,用甲醇定容至10mL。精密量取1 mL,置于10 mL量瓶中,加甲醇5 mL,加0.1 mol/L的三氯化铝溶液1 mL,摇匀,置70 ℃水浴加热10 min,放置15 min显色,加甲醇定容至刻度,即得(UV)。
2.3 标准曲线制备
精密称取槲皮素、山柰酚、异鼠李素对照品各2.89 mg、3.80 mg、1.70 mg,于25 mL棕色量瓶中,加5 %盐酸-甲醇溶液溶解、定容,摇匀。精密吸取该溶液0.1、0.5、1.0、2.0、4.0、8.0 mL,分别置于10 mL棕色量瓶中,加甲醇定容,摇匀,0.45 μm微孔滤膜滤过,即得各浓度对照品混合溶液(HPLC)。精密吸取各浓度对照品混合溶液20 μL,按2.1项下色谱条件进样分析,重复进样3次,以峰面积(Y)对浓度(X)作标准曲线,各指标成分的回归方程、相关系数、线性范围、检测限(LOD)及定量限(LOQ)见表1。
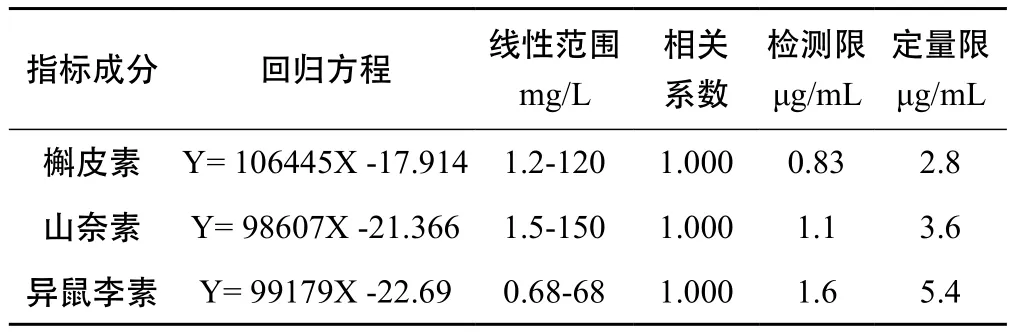
表1 回归方程、线性范围及检测限、定量限
精密称取芦丁对照品4.52 mg于10 mL量瓶中,加甲醇溶解、定容、摇匀。精密吸取该溶液0.2,0.3,0.4,0.5,0.6 mL,分别置于10 mL量瓶中,加甲醇5 mL,加0.1 mol·L-1的三氯化铝溶液1 mL,摇匀,置70 ℃水浴加热10 min,放置15 min显色,加甲醇定容至刻度,即为各浓度对照品溶液(UV法)。取各浓度对照品溶液,分别在410 nm处测定吸光度,以对照品质量浓度(X,mg·mL-1)为横坐标,吸光度(Y)为纵坐标,绘制标准曲线并进行回归计算,结果表明芦丁在0.00884~0.02652 mg·mL-1范围内线性关系良好,回归方程为:Y=28.82X-0.028(r =0.999 3)。
2.4 定量法
精密吸取各供试溶液(HPLC)20 μL,按2.1项色谱条件进样分析,每个样品测定3次。由各供试溶液所测得峰面积,根据回归方程式,计算供试品中槲皮素、山柰酚和异鼠李素含量,按下式换算成总黄酮醇苷的含量。
总黄酮醇苷含量=(槲皮素含量+山柰酚含量+异鼠李素含量)×2.51
取各供试溶液(UV),以甲醇为空白,在410 nm波长处测定吸光度,每个样品测定3次,根据芦丁回归方程式,计算供试品中总黄酮醇苷的含量。
3 结果
3.1 分析条件的选择
银杏叶供试溶液(UV)最大吸收波长为(410±1)nm,UV测定波长选择为410 nm;由槲皮素、山柰酚和异鼠李素对照品溶液紫外扫描图谱,可见各自最大吸收波长均为360 nm,故选择360 nm作为HPLC测定波长。在流动相乙腈-0.4%磷酸(50:50),流速:1.0 mL·min-1洗脱条件下,槲皮素、山柰酚和异鼠李素均达到基线分离,峰形对称,保留时间(tR)分别为16.5,28.5和32 min (图1)。

图1 银杏叶药材水解液中黄酮苷元类成分HPLC图A-对照品;B-银杏叶药材(批号:YL14110804);1-槲皮素;2-山柰酚;3-异鼠李素
3.2 精密度试验
精密吸取银杏叶(批号YL14110804)供试溶液(HPLC)20μL,按2.1项下色谱条件进样分析,重复测定6次,3指标成分峰面积值RSD为0.23%-3.35%。表明方法采用的HPLC仪器及整体系统精密度良好。
取银杏叶(批号YL14110804)供试溶液(UV),在410 nm波长处测定吸收度,重复测定6次,吸收度值RSD为0.32%,表明仪器精密度良好。
3.3 重复性试验
取银杏叶(批号YL14110804)按2.2项下制备6份供试溶液(HPLC),按2.1项下色谱条件进样分析,每份样品重复测定3次,并计算槲皮素、山柰酚和异鼠李素的含量,RSD分别为1.53%-1.64%,重复性良好。
取银杏叶(批号YL14110804)按2.2项下制备6份供试溶液(UV),在410 nm波长处测定吸收度,每份样品重复测定3次,并计算总黄酮醇苷的含量,RSD为0.271%,重复性良好。
3.4 稳定性试验
取银杏叶(批号YL14110804)供试溶液(HPLC),分别于量瓶中保存,于0,2,4,8,12,24 h按2.1项色谱条件进行分析,重复测定3次,其峰面积值RSD为0.48%-3.05%,结果表明,供试品溶液在24 h内稳定性良好。
取银杏叶(批号YL14110804)供试溶液(UV)在室温下放置,分别测定显色后0、10、20、30、40、50、60 min在410 nm处吸光度值,吸光度的RSD为0.302%,结果表明UV法供试品溶液在显色后60min内基本稳定。
3.5 加样回收试验
精密称取已知含量的银杏叶药材粉末(批号YL14110804)0.5 g,共9份,按80%,100%,120%3个目标浓度,分别精密加入槲皮素、山柰酚和异鼠李素的对照品适量,每一质量浓度取3份,按2.2项下方法制备HPLC加样回收率供试液,按2.1项下色谱条件测定,计算平均加样回收率,HPLC加样回收率在99.1%~103.4%。
精密称取已知含量的银杏叶药材粉末(批号YL14110804)0.25 g,共6份,分别精密加入芦丁对照品3.28 mg,按照2.2项下制备UV法加样回收率供试液,依法测定,计算芦丁的回收率为102.1%,结果见表2。
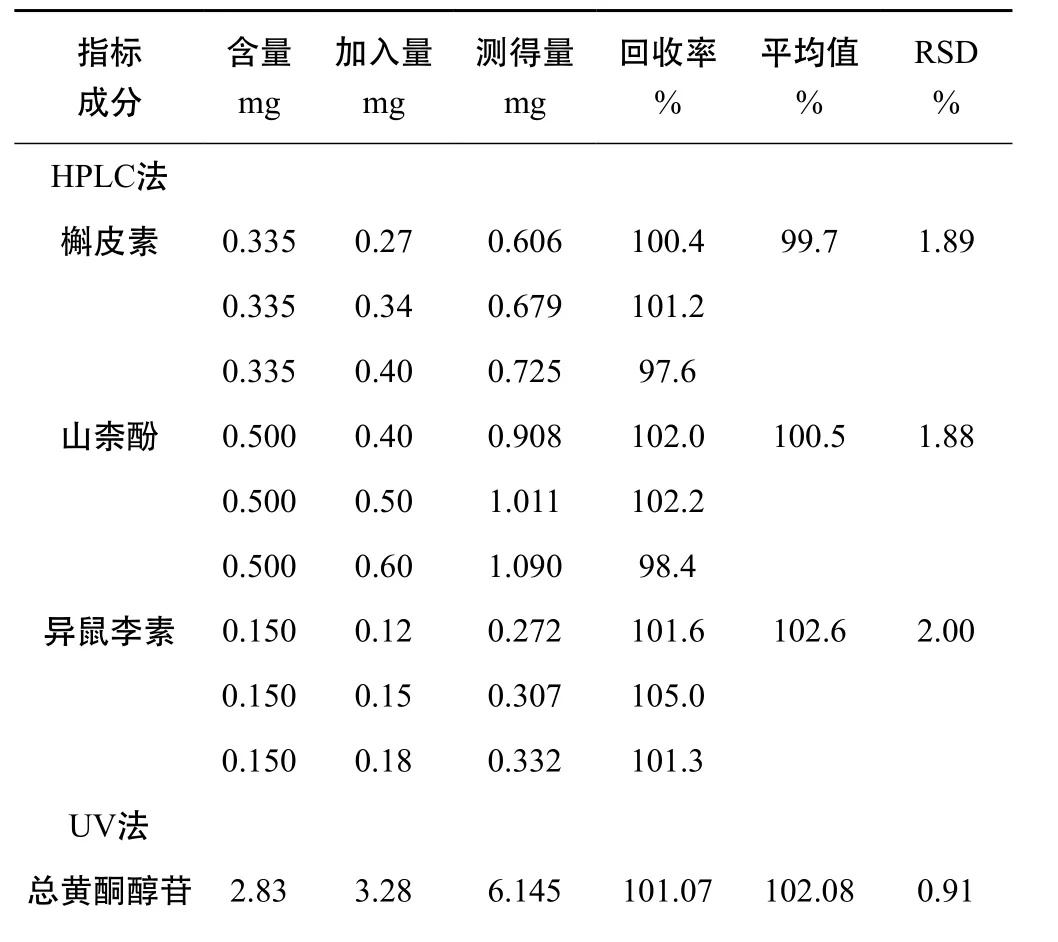
表2 加样回收率试验(n=3)
3.6 样品含量测定
分别以HPLC和UV法测定了34批银杏叶中总黄酮醇苷类成分含量,结果见表3。

表3 银杏叶总黄酮苷类成分含量测定结果
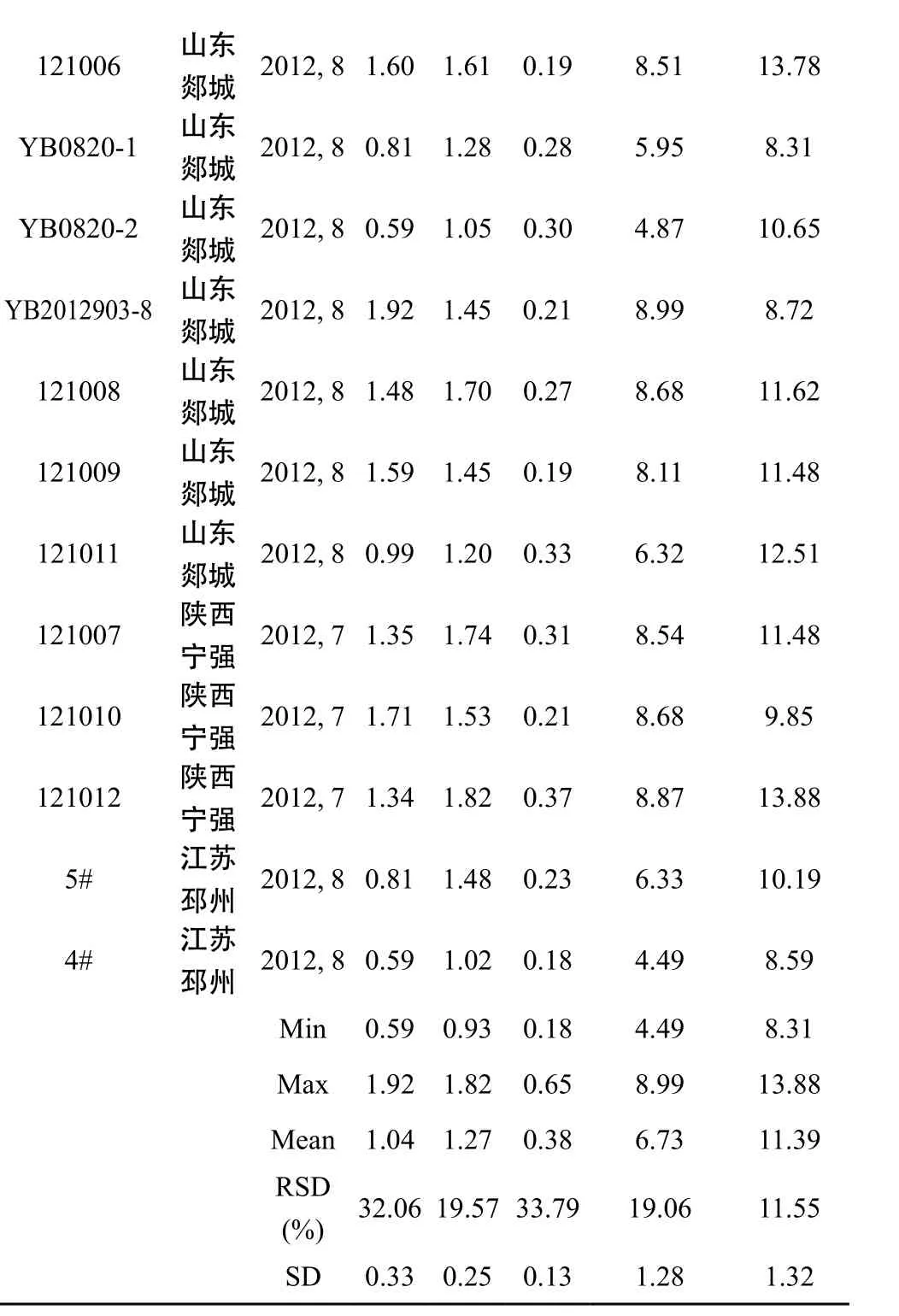
a总黄酮醇苷含量=(槲皮素含量+山柰酚含量+异鼠李素含量)×2.51
4 讨论
4.1 供试品溶液制备方法考察
2010年版《中国药典》[6]银杏叶项下总黄酮醇苷的含量测定方法中,样品供试品溶液制备方法如下:取本品中粉约1 g,精密称定,置索氏提取器中,加三氯甲烷回流提取2 h,弃去三氯甲烷液,药渣挥干,加甲醇回流提取4 h,提取液蒸干,残渣加甲醇-25%盐酸溶液(4:1)混合溶液25 mL,加热回流30 min,放冷,转移至50 mL量瓶中,并加甲醇至刻度,摇匀,即得。整个制备过程需要索氏提取器提取、加热回流提取、减压浓缩和水解等4个步骤,耗时约8小时,存在着操作繁琐,分析效率低等问题;为此本研究首先对2010年版《中国药典》分析方法的提取效率进行考察:比较了①三氯甲烷索氏提取除杂+甲醇加热回流提取+甲醇-25%盐酸溶液水解(药典方法);②甲醇加热回流提取+甲醇-25%盐酸溶液水解;③甲醇-25%盐酸溶液水解3种样品前处理方法对水解液中3种黄酮苷元含量的影响。结果如图2所示:现行药典中所采用的提取方法中三氯甲烷索氏提取除杂步骤会导致部分以槲皮素为苷元的黄酮醇苷类成分损失,而使得测定结果中水解液中槲皮素含量偏低;而甲醇加热回流提取后再水解与直接用甲醇-25%盐酸溶液加热回流水解提取相比,3种黄酮苷元类成分含量没有显著性差异。综合考虑提取效率、环境负荷等多方面因素,本研究选择直接用盐酸甲醇溶液水解提取,并对提取方式、提取溶剂、提取溶剂中盐酸浓度、提取溶剂用量、水解提取温度及时间等进行了系统考察。研究结果表明,提取温度和提取溶剂中盐酸浓度对3种黄酮苷元含量测定结果影响最为显著。图3所示为不同水解温度对3种黄酮苷元提取效率的影响,随着温度升高,3种黄酮苷元类成分提取效率逐渐升高,提取温度为90 ℃时提取效率最大,到100 ℃时略有下降,故控制水解提取温度为90 ℃。图4所示为提取溶剂中不同盐酸浓度对3种黄酮苷元提取效率的影响,采用5%盐酸甲醇溶液进行水解提取效率最高。采用本法测定批号YL14110804银杏叶HPLC供试溶液中槲皮素、山柰酚和异鼠李素的含量分别为0.67 mg/g、1.00 mg/g和0.29 mg/g,略高于药典法测定结果(槲皮素、山柰酚和异鼠李素的含量分别为0.62 mg/g、0.91 mg/g和0.26 mg/g),本法操作更为简便,省时,同时减少操作步骤也避免了中间环节的系统误差,提高检测结果的准确性。
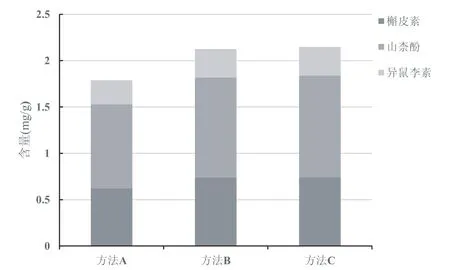
图2 不同提取方法对三种黄酮苷元类成分提取效率的比较方法A:三氯甲烷索氏提取除杂+甲醇加热回流提取+甲醇-25%盐酸溶液水解(药典方法);方法B:甲醇加热回流提取+甲醇-25%盐酸溶液水解;方法C:甲醇-25%盐酸溶液水解
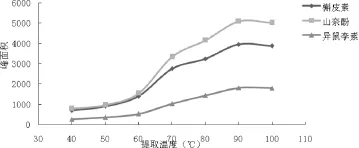
图3 不同水解温度对三种黄酮苷元提取效率的影响
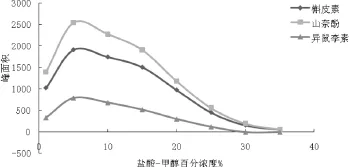
图4 提取溶剂中不同盐酸浓度对三种黄酮苷元提取效率的影响
4.2 银杏叶中总黄酮类成分含量比较
本实验建立了银杏叶药材中总黄酮醇苷类成分的含量测定方法,比较了HPLC与UV法测定结果。紫外分光光度法测定的总黄酮类成分含量显著高于HPLC法测定结果,提示在银杏叶中除黄酮醇苷类成分外,还存在有其他酚酸类成分,有待进一步研究探明它们的结构信息。本研究所收集得到的34批银杏叶药材中总黄酮醇苷类成分含量在0.45~0.90%之间,均符合2010年版《中国药典》对银杏叶药材中总黄酮醇苷类成分含量不得少于0.4%的规定。不同批次银杏叶中黄酮醇苷类成分含量差异较大,推测与不同采收季节和采收时间有关。
本实验同时开展了银杏叶中银杏酚酸类成分、银杏内酯类成分的含量与采收季节、产地等的相关性研究,以期为银杏叶药材品质综合评价和合理应用提供科学依据[7]。
[1] Teris A. van Beek, Paola Montoro. Chemical analysis and quality control of Ginkgo biloba leaves, extracts, and phytopharmaceuticals. Journal of Chromatography A, 2009, 1216: 2002–2032.
[2] 萨翼, 浅淡含中药提取物的保健食品工艺及质量控制[J], 中国中医药信息杂志, 2013, 20 (6): 3-16.
[3] Teris A. van Beek, Chemical analysis of Ginkgo biloba leaves and extracts. Journal of Chromatography A, 2009, 967: 21–55.
[4] 谢培山, 银杏叶标准提取物EGb761及银杏叶制剂的质量评价(待续)[J], 中国中药杂志, 1999, 24 (1): 3-5.
[5] 谢培山, 银杏叶标准提取物EGb761及银杏叶制剂的质量评价(续完)[J], 中国中药杂志, 1999, 24 (1): 116-118.
[6] 国家药典委员会.中国药典[S]. 一部. 北京: 中国医药科技出版社, 2010.
[7] 王荞微, 谢媛媛, 王义明, 梁琼麟, 罗国安, 银杏叶中银杏酚酸类成分含量测定方法研究[J], 中国药学杂志, 2015, 50(2): 167-173.
(责任编辑:傅舒)
Study on quantitative determination of total flavonoids in ginkgo folium
/CAO Bian-li1,2, WANG Qiao-wei2, LIAN Qi1,2, XIE Yuan-yuan2,WANG Yi-ming2, LUO Guo-an2// (1. Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, Jiangxi; 2.Department of Chemistry, Tsinghua University, Beijing 100084, China.)
Objective:To establish the quantitative determination of favonoids in ginkgo folium. Method:The favonoids content in ginkgo folium was detected by HPLC and UV-Vis method, and results from both methods were compared. The HPLC was performed on Phenomenex C18column (250mm × 4.6mm, 5μm) with the mobile phase consisting of 0.4% phosphoric acid aqueous solution and methanol (50: 50). The fow rate was 1.0 mL·min-1, and the detective wavelength was 360 nm. Result:The linear ranges of kaempferol, quercetin and rhamnetin in HPLC determination were 1.20~ 120 mg·L-1, 1.50~150 mg·L-1and 0.68~68 mg·L-1with r of 1.000. The linear range of rutin in the UV determination was 8.84 ~ 26.52 mg·L-1with r of 0.999 3, and its recovery was 102.3%. The contents of total favonoids in ginkgo folium samples detected by HPLC method were signifcantly less than those by the UV method, which suggested that it might contain other phenolic acids. Conclusion:This method is simple, accurate, and practical for the quality control of ginkgo folium.
Ginkgo folium; total favonoids; kaempferol; quercetin; rhamnetin; HPLC; quantitative analysis.
R 284.1
A
1674-926X(2016)06-005-05
重大新药创制(2014ZX09304307001-010)中药新药安全性检测技术与标准研究;
1.江西中医药大学,江西南昌330004;2.清华大学化学系,北京 100084
曹便利(1988-),女,硕士在读,从事中药质量标准研究
Tel:18710229816 Email:1063212759@qq.com
谢媛媛(1980-),女,博士,高级工程师,研究方向:中药质量控制
Tel:010-62772265 Email:yuanyuan8078@gmail.com
2015-04-12
