雷公藤多苷对溃疡性结肠炎大鼠TLR4/MyD88非依赖信号通路的作用研究
2016-05-11钦丹萍周毅骏孙佩娜曹俊敏�┱糯豪霆┐�群
钦丹萍 周毅骏 孙佩娜 曹俊敏�┱糯豪霆┐�群

[摘要]为了研究雷公藤多苷(TWP)对三硝基苯磺酸(TNBS)/乙醇溃疡性结肠炎(UC)大鼠TLR4/MyD88非依赖信号通路的调控作用,采用了TNBS/乙醇联合灌肠的方法建立TNBS/乙醇UC大鼠模型。模型建立成功后,将90只雄性Wistar大鼠随机分为正常对照组,模型对照组,TWP低、中、高剂量组(3,6,12 mg·kg-1),硫唑嘌呤(AZA)组(6 g·kg-1),每组15只。各组分别给予相应药物连续灌胃14 d。每隔3 d评估UC大鼠疾病活动指数(DAI)。14 d后解剖所有大鼠,留取相应结肠组织观察各组大鼠结肠组织大体及镜下病理表现,并对其进行评分。采用Western blot法和RTPCR法检测UC大鼠结肠组织中TLR4/MyD88非依赖信号通路相关分子(TLR4,TRAM,TRIF,NFκB,IFNγ)在mRNA及蛋白水平的表达情况。结果提示,DAI评分、大体及镜下表现和评分均提示TNBS/乙醇UC大鼠模型造模成功,TWP对UC大鼠临床症状的改善及黏膜愈合具有一定作用,该作用与AZA相比相当或强于AZA。RTPCR及Western blot实验均提示,与正常对照组相比,模型对照组中TLR4/MyD88非依赖信号通路相关的分子无论在mRNA还是蛋白水平表达均显著升高(P<001)。与模型对照组相比,TWP呈剂量依赖性地抑制该信号通路上各节点分子mRNA及蛋白水平的表达,其中TWP高剂量组中各节点分子mRNA及蛋白表达水平显著低于模型对照组(P<005)。与AZA组相比,TWP高剂量组对该信号通路上游因子(TLR4,TRAM,TRIF,NFκB)mRNA及蛋白表达水平的抑制作用略好于AZA组,而对该信号通路的末端炎症因子IFNγ mRNA及蛋白水平的抑制作用却略逊于AZA组,但上述2种差异均无统计学意义。因此,在TNBS/乙醇 UC大鼠模型中,MyD88非依赖信号通路参与了炎症活动的调控,TWP可以通过抑制TLR4/MyD88非依赖信号通路抑制IFNγ的释放,发挥抗炎作用,其作用强度与剂量呈正相关。
[关键词]雷公藤多苷(TWP);溃疡性结肠炎(UC);TLR4/MyD88非依赖信号通路
溃疡性结肠炎(ulcerative colitis,UC)与自身免疫异常相关[1],临床用药除氨基水杨酸制剂、糖皮质激素外,指南上还推荐使用免疫抑制剂[2],如硫唑嘌呤(AZA)等,但AZA主要副作用为骨髓抑制等,与氨基水杨酸制剂联用时,更易发生骨髓抑制,限制了其在临床中的应用。而中药雷公藤多苷(TWP)用于自身免疫性疾病治疗已共识[3],而TWP治疗UC的报道甚少,临床实践显示其具有较好疗效,但其作用机制不明。
Toll样受体(TLRs)是膜蛋白家族中的一员,能够识别病原相关分子,并介导固有免疫应答,与UC的发病密切相关[4]。在UC患者体内,肠上皮固有层细胞中Toll样受体4(TLR4)表达大幅度增加[5],而TLR4恰好是TLRs中的一种膜蛋白受体。由此说明TLR4信号通路在UC发病中扮演重要角色。
外来刺激因子与TLR4受体绑定是激活固有免疫系统的第一步,TLR4信号通路按是否需要接头蛋白髓样分化因子88(MyD88)介导,主要为MyD88依赖和非依赖的信号通路[6]。目前TLR4/MyD88依赖信号通路在UC发病中的机制研究已显成[7],而TLR4/MyD88非依赖信号通路(又名TLR4/TRIF信号通路)由于最终可产生大量的IFNγ,而IFNγ也与结肠炎症活动具有相关性[8],因此,本文尝试通过三硝基苯磺酸(TNBS)/乙醇UC大鼠模型作为研究载体,研究TWP的抗炎作用及抗炎机制,通过研究TWP干预 TLR4的作用,也可进一步明确TLR4/MyD88非依赖信号通路在炎症调控中的作用,并阐述TWP是否对此调控具有干预作用,从而为临床应用及后续的研究提供基础资料。
1材料
SPF级雄性Wistar大鼠90只,体重(200±20)g,7周龄,由浙江中医药大学动物中心提供,动物合格证号2007000556038,常规饲养。
雷公藤多苷片(浙江德恩制药有限公司,生产批号1311108B);硫唑嘌呤片(aspen,生产批号008953)。
5% 2,4,6三硝基苯磺酸(5% TNBS,Sigma公司);10%水合氯醛(浙江省中医院);无水乙醇(杭州龙山精细化工有限公司);中心静脉导管(上海景年医疗器械有限公司,标准编号YZB/USA 39662011);TLR4,TRAM,TRIF,NFκB,IFNγ PCR引物(Takara公司合成);βactin(cst,4970S);TLR4抗体(abcam,ab22048),TRAM抗体(R&D,AF4348),TRIF抗体(abcam,ab13810),NFκB抗体(cst,8242S),IFNγ抗体(R&D,AF585NA);兔二抗,羊二抗,电泳仪及电泳槽(Biorad);RNA抽提试剂盒(lot号9767,Takara,Shiga,Japan);反转录试剂盒(lot号RR036A,Takara,Shiga,Japan);PCR扩增仪(Applied Biosystems, Foster City, CA, USA)。
2方法
21动物分组分别将90只健康Wistar大鼠完全随机分为6组,分别为正常对照组、模型对照组、TWP低剂量组、TWP中剂量组、TWP高剂量组、AZA组,每组15只。
22模型建立大鼠适应性喂养1周左右,使体重达到(200±20)g,禁食24 h。10%水合氯醛3 mL·kg-1腹腔麻醉后,将石蜡油润滑过的深静脉置管由肛门缓慢插入结肠约8 cm处,模型对照组和药物组按每只大鼠0002 mL·g-1 5%TNBS+025 mL 50%乙醇进行灌肠,正常对照组按0002 mL·g-1生理盐水+025 mL生理盐水进行灌肠,灌肠结束加推03 mL空气,用棉签堵住大鼠肛门,轻柔大鼠腹部1 min并倒置5 min,造模结束后将大鼠平放,自然清醒后常规饮食。造模3 d后建立大鼠UC模型。
23给药①正常对照组、模型对照组:给予001 mL·g-1生理盐水灌胃;②AZA组:将AZA研成细末,在细末中加生理盐水制成混悬液,按大鼠AZA 60 mg·kg-1的剂量制成每1 mL含有06 mg AZA混悬液,以001 mL·g-1的灌胃量灌胃;③TWP低、中、高剂量组:将TWP研成细末,在细末中加生理盐水制成混悬液,按3组大鼠以TWP 30,60,120 mg·kg-1的剂量分别制成每1 mL含有03,06,12 mg TWP混悬液,以001 mL·g-1的灌胃量灌胃。以上药物每天1次,连续14 d。
24观察项目每日观察大鼠体重、毛发、饮食、大便等一般情况,并进行隐血试验及DAI评分。
25标本采集末次给药24 h后,处死大鼠,除正常对照组外,均留取病变最明显处结肠组织标本进行相关检测。
26结肠炎症评价①疾病活动指数(DAI)评分:按照Maines等[9]提出的标准,通过结合造模14 d后大鼠体重下降率、大便性状及大便隐血情况进行评分;②大体形态损伤评分:参照Wallace等[10]提出的标准进行评分;③镜下结肠损伤评分:取病变组织进行HE染色,按照Geboes等[11]的评分标准进行评分。
27RTPCR法测定TLR4/TRIF信号通路相关分子mRNA水平表达情况所取标本按RNA抽提试剂盒说明书提取总RNA,紫外分光光度计测定总RNA浓度,重复测定3次,取500 ng RNA按反转录试剂盒说明书进行逆转录反应合成cDNA,用ABI 7500 PCR仪按RTPCR说明书将cDNA进行PCR扩增,以βactin为内参,以95 ℃预变性30 s,然后进行循环扩增,95 ℃变性5 s,60 ℃退火加延伸30 s,共40个循环,反应结束后进行溶解曲线分析。采用2-ΔΔCt法分析目的基因的相对表达水平。各信号蛋白分子引物情况见表1。
28Western blot法测定TLR4/TRIF信号通路相关分子蛋白水平表达情况将所取肠组织标本研磨粉碎后,加入6倍剂量的冷蛋白裂解液[20 mmol·L-1 Tris/HCl (pH 75),10 mmol·L-1 APMSF,1 mmol·L-1 EDTA,1 mmol·L-1 DTT]制缓冲液。取一定量蛋白上样,于10%聚丙烯酰胺凝胶电泳分离,分离的蛋白质转移至PVDF膜。5%脱脂奶封闭2 h,加入TLR4(1∶500),TRAM(1∶1 000),TRIF(1∶500),NFκB(1∶1 000),IFNγ(1∶5 000)单克隆抗体,4 ℃孵育过夜。TBST洗膜5 min×3次。分别加入相应荧光二抗(1∶15 000),室温缓慢震摇2 h,TBST洗膜5 min×3次。采用Odyssey曝光机进行图像显影,Odyssey软件进行图像数据分析,目的蛋白的表达值为目的蛋白的灰密度值比上βactin的灰密度值。
29统计学方法采用SPSS 170统计软件处理数据。数据以±s形式表示,各组数据间采用单因素方差分析检验,P<005为差异有统计学意义。
3结果
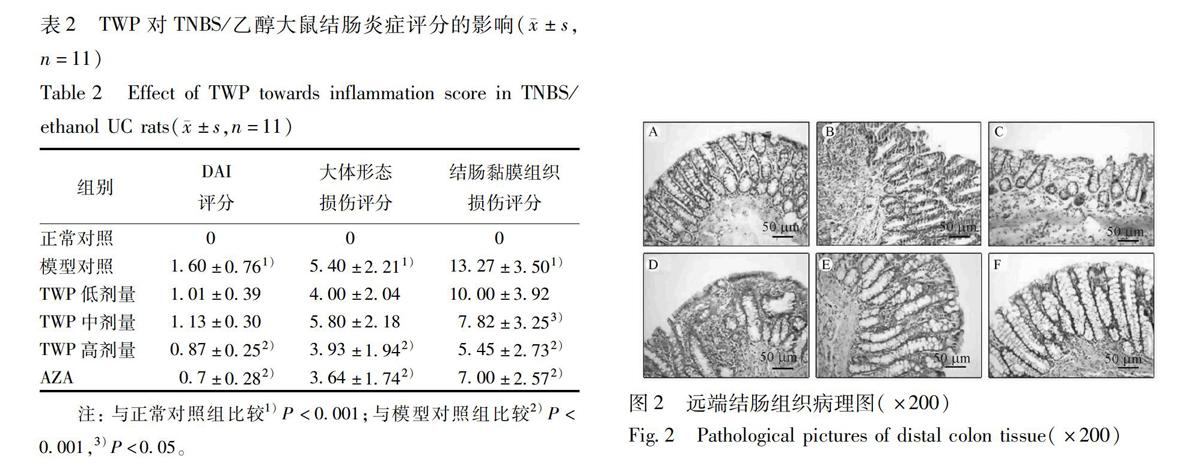
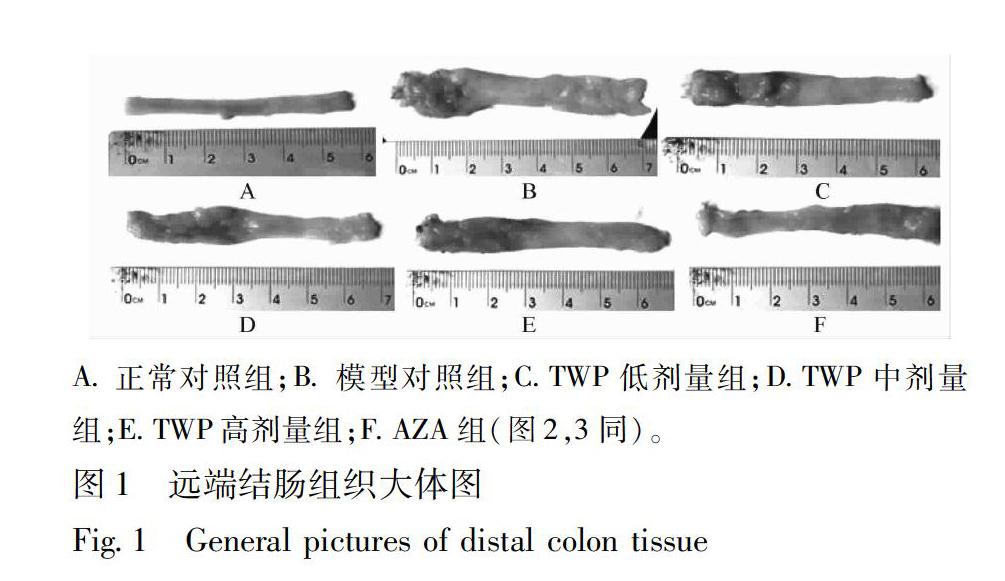
31UC大鼠结肠炎症评分治疗14 d后,与正常对照组相比,模型对照组大鼠DAI,大体形态损伤及组织学评分明显增加 (P<001);与模型对照组相比,TWP高剂量组及AZA组结肠炎症评分均有明显增加 (P<001);与TWP高剂量组相比,AZA组结肠炎症评分无显著性差异,见表2。
正常对照组肠壁无粘连,剖开黏膜皱襞纹理清晰,无糜烂和溃疡等表现;模型对照组肠壁与周围组织粘连,肠管增粗,剖开可见溃疡灶,溃疡病变处肠壁增厚,周边黏膜充血水肿;TWP低剂量组肠壁与周围组织粘连,肠管增粗,肠壁变厚,部分剖开可见溃疡、糜烂灶,局部充血、水肿;TWP中剂量组肠壁与周围组织轻度粘连,肠壁增厚,剖开偶见浅小溃疡,伴黏膜充血水肿;TWP高剂量组、AZA组肠壁与周围组织少有粘连,肠管未见明显增粗,肠壁轻度增厚,剖开未见明显溃疡,有轻度黏膜充血水肿,见图1。
正常对照组、模型对照组可见结肠黏膜水肿,黏膜层及浆肌层可见多量淋巴细胞,浆细胞及中性粒细胞浸润,溃疡形成,溃疡表面可见坏死层,肉芽组织形成;TWP低剂量组偶可见黏膜下层溃疡,中性粒细胞、淋巴细胞等炎性细胞浸润侵及肌层甚至浆膜层,部分可见隐窝破坏;TWP中剂量组黏膜主要表现为重度慢性炎症,中性粒等炎性细胞浸润侵及肌层,隐窝破坏少见;TWP高剂量组与AZA组黏膜主要表现为中度慢性炎症,部分黏膜及黏膜下层有少量炎性细胞浸润,见图2。
32Western blot法检测TLR4/MyD88非依赖信号通路相关蛋白的表达对TLR4/MyD88非依赖信号通路的各节点分子蛋白表达水平(TLR4,TRAM,TRIF,NFκB,IFNγ)而言,与正常对照组相比,模型对照组中这些重要节点分子的蛋白表达水平显著升高(P<001);与模型对照组相比,TWP呈剂量依赖性地抑制该信号通路上各节点分子蛋白水平的表达,其中TWP高剂量组中各节点分子mRNA表达水平显著低于模型对照组(P<005);在与阳性对照组AZA组比较,TWP高剂量组对该信号通路上游因子(TLR4,TRAM,TRIF,NFκB)蛋白表达的抑制作用略好于AZA组,而对该信号通路的末端炎症因子IFNγ蛋白水平的抑制作用却略逊于AZA组,但上述2种差异均无统计学意义,见图3,4。
33RTPCR法检测TLR4/MyD88非依赖信号通路相关分子mRNA的表达与正常对照组相比,模型对照组中这些重要节点分子的mRNA表达水平显著升高(P<001);与模型对照组相比,TWP呈剂量依赖性地抑制该信号通路上各节点分子mRNA的表达,其中TWP高剂量组中各节点分子mRNA表达水平显著低于模型对照组(P<005);在与
阳性对照组AZA组比较,TWP高剂量组对该信号通路上游因子(TLR4,TRAM,TRIF,NFκB)mRNA表达的抑制作用略好于AZA组,而对该信号通路的末端炎症因子IFNγ mRNA水平的抑制作用却略逊于AZA组,但上述2种差异均无统计学意义,见图5。
4讨论
本研究采用的TNBS/乙醇UC大鼠模型为研究UC的极佳模型[12]。在TNBS/乙醇灌肠造模后,观察模型对照组造模后一般情况,发现造模2 d后模型对照组大鼠出现精神、饮食、毛发、大便次数及性状的改变,隐血测试阳性。造模后DAI评分浮动于7~13分,较正常对照组显著升高,实验结束后解剖大体,观察其结肠组织均可见病变部位组织与周围
组织粘连,有较多较大的溃疡病灶,周围组织充血
水肿,高倍镜下可见结肠黏膜水肿,黏膜层及浆肌层可见大量炎症细胞浸润,溃疡形成,溃疡表面可见坏死层,肉芽组织形成,结肠组织大体形态及镜下组织病理学评分较正常对照组均有显著升高(P<001),证实本次研究应用TNBS/乙醇方法制备大鼠溃疡性结肠炎模型成功。
用TWP进行3 d的灌胃治疗后,可见大鼠精神状态开始好转,进食饮水量及活动量较模型对照组好转明显,灌胃8 d后,大便逐渐成形,偶有稀便,肛周皮毛稍黏,但无便血,体重有所恢复。实验结束后TWP高剂量组大鼠肠道黏膜溃疡、炎症状态较模型对照组改善明显,组间差异有统计学意义(P<001);与模型对照组相比,TWP高剂量组淋巴细胞、中性粒细胞、浆细胞等炎性细胞浸润减少,偶可见溃疡,溃疡较浅表,组间差异有统计学意义(P<001);与AZA组比较,镜下组织损伤评分有所降低(P<005),大体形态损伤评分略高,但差异无统计学意义,说明TWP能改善UC大鼠症状、
控制炎症活动、促进黏膜愈合上具有作用,其作用强度或相当于AZA的作用。
在TLR4/MyD88非依赖信号通路中,TLR4直接或间接通过一种Mal蛋白、Toll样受体相关分子(tolllike receptors associated molecule,TRAM)激活TIR域含适配器诱导β干扰素(TIRdomaincontaining adapterinducing interferonβ,TRIF),TRIF立即与接头蛋白募集肿瘤坏死因子受体相关因子6(TNF receptorassociated factor 6,TRAF6)绑定,激活下游TRNK结合激酶1 (TANKbinding kinase 1, TBK1),TBK1紧接着激活丝裂原激活的蛋白激酶(mitogenactivated protein kinase,MAPK)和核转录因子κB(nuclear factorκB,NFκB),而NFκB可以激活干扰素调节因子3(interferon regulatory factor 3,IRF3)[13],IRF3是诱导干扰素(IFN)家族释放IFN的重要激活因子。因此,TLR4,TRAM,TRIF,NFκB是TLR4/MyD88非依赖信号通路中的重要上游节点分子,将上述四者作为检测分子,能很好地说明四者在该信号通路中相互之间的紧密连接关系。
末端炎症因子IFNγ是一种强有力的且具有多向性的促炎症细胞因子,执行众多免疫调控功能。IFNγ可以激活一系列具有免疫活性的细胞,包括巨噬细胞、内皮细胞、淋巴细胞。同时,它又是抗原递呈细胞表面表达主要组织相容性复合体Ⅱ(MHCⅡ)分子的重要刺激因子[14]。另外,IFNγ还能降低上皮细胞屏障功能,它可以通过上调表达某些趋化因子及自身受体,促进中性粒细胞迁移,引起炎症反应[15]。在许多Th1细胞介导的实验性结肠炎模型中,肠黏膜上IFNγ的表达水平明显增高[16]。在炎症性肠病(inflammatory bowel disease,IBD)患者中,Th1细胞表型在免疫反应中起到重要作用,同时IFNγ在IBD患者肠黏膜上的表达也明显增加[17]。因此选择IFNγ作为评估TLR4/MyD88非依赖信号通路的末端炎症因子是合理的且具有意义的。
对TLR4/MyD88非依赖信号通路的上游分子(TLR4,TRAM,TRIF,NFκB)而言,Western blot及RTPCR结果均提示,与正常对照组相比,该信号通路上游分子无论在mRNA水平还是蛋白水平,模型对照组表达显著升高(P<001),提示该疾病模型与TLR4/MyD88非依赖信号通路的异常表达密切相关。与模型对照组相比,TWP呈剂量依赖性地抑制该信号通路的上游因子,其中高剂量组与模型对照组相比具有显著差异(P<005)。同时,TWP对TLR4,TRAM,TRIF,NFκB这4点组成的级联反应无论在mRNA及蛋白水平,其抑制作用呈现随剂量增加而增强的趋势。在与AZA组比较中,高剂量TWP对该信号通路上游因子的抑制作用略好于AZA组,但无显著性差异,提示抑制该信号通路为TWP抗炎的途径之一。
对TLR4/MyD88非依赖信号通路的末端炎症因子IFNγ而言,Western blot及RTPCR结果均提示,与正常对照组相比,该信号通路末端炎症因子IFNγ无论在mRNA水平还是蛋白水平模型对照组表达显著升高(P<001)。与模型对照组相比,TWP呈剂量依赖性地抑制该信号通路的末端炎症因子IFNγ,其中高剂量组与模型对照组相比具有显著差异(P<001)。与AZA组相比,高剂量TWP对该信号通路末端炎症因子的抑制作用略逊于AZA组,但无显著性差异,提示TWP对末端炎症因子IFNγ具有抑制作用。
本研究结果显示,在TNBS/乙醇 UC大鼠模型中,MyD88非依赖信号通路参与了炎症活动的调控,TWP可以通过抑制TLR4/MyD88非依赖信号通路抑制IFNγ的释放,发挥抗炎的作用,其作用强度与剂量呈正相关。
[参考文献]
[1]Zhu H, Li Y R Oxidative stress and redox signaling mechanisms of inflammatory bowel disease: updated experimental and clinical evidence[J] Exp Biol Med (Maywood), 2012, 237(5): 474
[2]中华医学会消化病分会炎症性肠病学组 炎症性肠病诊断与治疗的共识意见[J] 中华内科杂志,2012,51 (10):818
[3]Zhang C, Jiang M, He X, et al Clinical trials of integrative medicine for rheumatoid arthritis:issues and recommendations[J] Chin J Integr Med, 2015, 21(6): 403
[4]Fukata M, Shang L, Santaolalla R, et al Constitutive activation of epithelial TLR4 augments inflammatory responses to mucosal injury and drives colitisassociated tumorigenesis[J] Inflamm Bowel Dis, 2011, 17(7): 1464
[5]Shen X, Shi R, Zhang H, et al The Tolllikereceptor 4 D299G and T3991 polymorphisms are associated with Crohn′s disease and ulcerative colitis: a Metaanalysis[J] Digestion,2010,81(2): 69
[6]Wang W, Xia T, Yu X Wogonin suppresses inflammatory response and maintains intestinal barrier function via TLR4MyD88TAK1mediated NFκB pathway in vitro[J] Inflamm Res, 2015, 64(6): 423
[7]GonzálezNavajas J M, Fine S, Law J, et al TLR4 signaling in effector CD4+ T cells regulates TCR activation and experimental colitis in mice[J] J Clin Invest, 2010, 120(2): 570
[8]Kanagavelu S, Flores C, Termini J M, et al TIRdomaincontaining adapterinducing interferonβ(TRIF) regulates Th17mediated intestinal immunopathology in colitis[J] Mucosal Immunol,2015,8(2):296
[9]Marines L W, Fitzpatrick L R, French K J, et al Supression of ulcerative colitis in mice by orally available inhibitors of sphingosine kinase[J]Dig Dis Sci,2008,53(4):997
[10]Wallace J L, Keenan C M, Gale D, et al Exacerbation of experimental colitis by nonsteroidal antiinflammatory drugs is not related to elevated leukotriene B4 synthesis[J] Gastroenterology,1992,102(1): 18
[11]Geboes K, Riddell R, Ost A, et al A reproducible grading scale for histological assessment of inflammation in ulcerative colitis [J] Gut, 2000, 47(3): 404
[12]Xu J, Zheng C, Huang Y, et al Efficacy of thalidomide on trinitrobenzene sulfonateinduced colitis in young rats and its mechanism[J] Chin Med J (Engl), 2014, 127(12): 2368
[13]Kawai T , Akira SThe role of patternrecognition receptors in innate immunity: update on Tolllike receptors[J]Nat Immunol,2010,11(5):373
[14]Schroder K, Hertzog P J, Ravasi T, et al Interferonγ: an overview of signals, mechanisms and functions[J] J Leukoc Biol, 2004, 75(2): 163
[15]Soyka M B, Wawrzyniak P, Eiwegger T, et al Defective epithelial barrier in chronic rhinosinusitis: the regulation of tight junctions by IFNγ and IL4[J] J Allergy Clin Immunol, 2012, 130(5): 1087
[16]Harbour S N, Maynard C L, Zindl C L, et al Th17 cells give rise to Th1 cells that are required for the pathogenesis of colitis[J] Proc Natl Acad Sci USA, 2015,112(22):7061
[17]Dongarrà M L, Belvedere A, Ferlazzo G, et al Clinical drug response to thiopurines is associated to a lower interferonγ production by IBD patient′s T lymphocytes[J] J Crohns Colitis, 2013, 7(10): e497
[责任编辑马超一]
