牡丹和芍药种皮、种仁及种皮提取物中10种茋类成分含量及抗氧化测定
2016-05-11何春年毕武申洁彭勇肖培根
何春年 毕武 申洁 彭勇 肖培根
[摘要]常用中药牡丹和芍药种子中含有茋类成分,具有多种药理活性,为了开发和利用牡丹种子资源,该文选择种子中含量相对较高的10种茋类成分suffruticosol A, suffruticosol B, suffruticosol C,transresveratrol,cisεviniferin,transεviniferin,cissuffruticosol D,cisgnetin H,transsuffruticosol D和transgnetin H为指标进行含量测定。采用HPLCDAD,YMCpack ODSA色谱柱(46 mm×250 mm,5 μm);流动相以甲醇水梯度洗脱,流速为10 mL·min-1;柱温25 ℃;检测波长为230 nm。同时采用清除DPPH自由基的方法初步评价其抗氧化作用。结果表明:所建立的方法能够同时测定10种茋类成分的含量;牡丹和芍药种子中的茋类成分主要集中于种皮部位(总质量分数达167%以上),种仁中含量很低(总质量分数不到03%),种皮提取物富含茋类成分,总含量达75%以上。种皮提取物及10种茋类成分多具有较好的抗氧化潜力。该文对牡丹和芍药资源的综合利用,特别是种皮资源的有效开发和利用奠定了基础。
[关键词]牡丹;芍药;种皮;茋类;白藜芦醇
牡丹Paeonia suffruticosa sl和芍药P lactiflora Pall为毛茛科芍药属植物,传统上作为观赏和药用,牡丹根皮作为“牡丹皮”,芍药根作为“白芍”或“赤芍”药用已有2 000多年历史,是临床常用中药材。近年来,发现牡丹种子中富含多不饱和脂肪酸[1],2011年原国家卫生部批准牡丹籽油作为新资源食品,随后被列为国家食用油料振兴产业之一。目前,全国油用牡丹种植面积已扩大到近100万亩(1 hm2=15亩)。因此,牡丹植物资源的可持续综合利用具有广阔的开发前景。
牡丹种子中除不饱和脂肪酸外,还含有茋类、单萜苷类、黄酮类和有机酸类等多种成分[23],其中茋类成分主要为白藜芦醇及其二聚和三聚体[45]。研究表明,牡丹种子中的白藜芦醇低聚物具有多种生物活性,包括抗肿瘤[6]、抗炎[78]、抗过敏[9]和神经氨酸酶抑制等作用[10]。已有研究表明,牡丹和芍药种子中部分茋类化合物具有较好的抗氧化活性[11],但采用清除DPPH自由基的方法,以及作者曾分离得到的3个新化合物cissuffruticosol D(7),cisgnetin H(8),transsuffruticosol D(9)及牡丹和芍药种皮提取物尚没有得到评价。因此,本文对牡丹和芍药种子中主要的10种茋类成分和种皮提取物的抗氧化能力进一步比较,为牡丹和芍药种子的合理利用积累科学数据。
牡丹种子分为种皮和种仁2个部位,种仁用于榨取牡丹籽油,牡丹种皮(种壳)是牡丹籽榨油前脱去的副产品,其质量占整个种子质量的约1/3,未能得到有效利用。作者前期研究发现牡丹及其同属植物种子中普遍含有茋类成分,但对该类成分在种子中的分布特点没有明确。为了指导牡丹种子的合理利用,本文结合生产实际,把种子分为种皮和种仁2个部位,同时对种皮进行提取,分别测定10种主要的茋类成分,为牡丹以及芍药种子资源的综合利用奠定基础。
1材料
Agilent 1200高效液相色谱仪(G1322A型在线脱气机、G13llA型液相泵、G1329A自动进样器、G1316A柱温箱、G1315B型DAD检测器、Agilent色谱工作站);梅特勒托利多电子天平(AL204);ULVAC薄膜真空泵(DTC21);C9860A超声波清洗器(上海杰恩普超声设备有限公司);Quant MQX200 微孔板扫描分光光度计 (Biotek Instruments, Inc,美国)。
甲醇、乙腈为色谱纯(FisherScieniific);甲酸(CNW公司,德国);纯净水(杭州娃哈哈集团);生育酚(江苏碧云天生物科技公司提供),DPPH(Sigma公司,美国),其余试剂均为分析纯。茋类对照品suffruticosol A (1), suffruticosol B(2), suffruticosol C(3),cisεviniferin(5), transεviniferin(6), cissuffruticosol D(7), cisgnetin H (8), transsuffruticosol D(9)和transgnetin H (10)均为本实验室从牡丹种子中分离得到,经HPLC检测,纯度大于95%;对照品transresveratrol(4)(纯度>99%,成都普瑞法科技开发有限公司)。
牡丹种子和芍药种子2014年收集于北京和山东菏泽,牡丹和芍药种皮提取物为本实验室自制,制备方法为种皮加入适量乙醇多次冷浸提取,减压回收乙醇,提取浸膏真空干燥即得。
2方法与结果
2110种茋类成分含量测定
211色谱条件和系统适用性试验
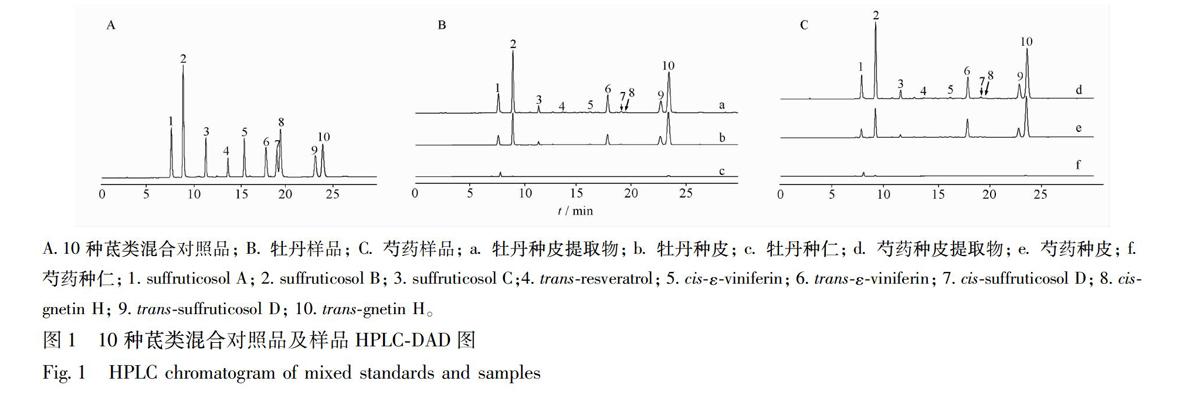
YMCpack ODSA色谱柱(46 mm×250 mm, 5μm);流动相为甲醇(A)和水(B),线性梯度洗脱,洗脱程序为0~10 min, 35%~52%(A);10~30 min,52%~60%(A)。流速为10 mL·min-1;柱温25 ℃;紫外检测波长为230 nm;进样体积为5 μL。10个对照品的液相色谱图见图1。
212对照品溶液的制备
分别精密称取10种茋类对照品适量,即1(814 mg),2(1227 mg),3(248 mg),4(717 mg),5(617 mg),6(540 mg),7(717 mg),8(774 mg),9(750 mg)和10(774 mg),用5 mL甲醇溶解并定容至刻度,作为储备液。使用时分别吸取01 mL的单个对照品储备溶液至1 mL量瓶中,加流动相至刻度,摇匀,作为混合对照品溶液。
213供试品溶液制备
分别精密称取牡丹种皮提取物约010 g;牡丹和芍药种皮约025 g;芍药和牡丹种仁约050 g。
加入约100 mL甲醇,超声提取30 min,用甲醇定容,045 μm微孔滤膜过滤,取续滤液即得。
214方法学考察
2141线性关系、检测限和定量限参照作者前期发表的文章[12]所建立的方法进行。分别精密吸取上述混合对照品储备液适量,加流动相稀释成6个不同浓度的混合对照品溶液。分别按上述色谱条件进行HPLCDAD分析,每个浓度进样3次,记录10个对照品色谱峰的峰面积Y,分别以各对照品溶液浓度为横坐标X,以各峰面积3次进样的平均值为纵坐标Y进行线性回归,得到各对照品的线性回归方程。将混合对照品溶液多次稀释,分别进行HPLCDAD分析,得到各对照品的最小检测限(LOD,S/N=3)和最小定量限(LOQ,S/N=10), 见表1。
2142精密度试验10个对照品的精密度试验方法为采用3种不同浓度(高、中、低)分别测定日内精密度和日间精密度。日内精密度是连续进样6次,测定10个对照品色谱峰的保留时间和峰面积,并计算其RSD,分别在009%~025%和038%~35%;日间精密度为每隔12 h进样,连续3d内共进6次,测定10个对照色谱峰的保留时间和峰面积,并计算其RSD,分别在011%~091%和034%~37%。表明仪器精密度良好。
2143稳定性试验同一份牡丹种皮样品在25℃下避光保存,分别在0,6,12,18,24,48 h测定,以峰面积的平均标准偏差为指标评价样品的稳定性,结果表明样品在48 h内稳定(RSD<19%)。
2144重复性试验取同一份牡丹种皮样品6份,按供试品溶液制备方法制备,按上述色谱条件测定,各对照品色谱峰的峰面积对应的浓度的RSD小于22%,结果表明此方法的重复性良好。
2145加样回收率试验用加样回收率测定方法的准确度,即向已知含量的样品(牡丹种皮)中加入3种浓度(高、中、低)混合对照品溶液,按供试品溶液制备方法和样品一起提取和分析,每个浓度重复3次,按上述色谱条件测定。各对照品成分的回收率在9665~1029% (RSD<31%)。结果见表2。
215样品测定
将样品按上述高效液相条件进行测定,结果见表3。
测定结果表明牡丹和芍药种子中的茋类成分组成和含量上相似,均主要集中于种皮部位(总量高于167%),种仁中含量很低(总量不到03%),种皮提取物富含茋类成分,总量达75%以上。10中茋类成分质量分数顺序为transgnetin H (10)>suffruticosol B(2)> transεviniferin(6)>transsuffruticosol D(9)≈suffruticosol A(1)>suffruticosol C (3)>transresveratrol (4)≈cisεviniferin (5)≈cisgnetin H (8)>cissuffruticosol D(7)。另外,3对顺反异构化合物含量比较发现,反式结构含量明显高于順式结构,如化合物10>8;9>7;6>5。
22种皮提取物及10种茋类成分抗氧化能力的测定
牡丹及芍药种皮提取物及10种茋类化合物抗氧化能力采用清除DPPH自由基的方法,参照相关文献[13],即吸取稀释不同浓度的样品溶液各7 μL,分别添加到新鲜配置的193 μL的02 mmol·L-1浓度的DPPH溶液中,混匀,避光反应30 min,同时以生育酚(Trolox)作为对照,乙醇为空白对照,于517 nm波长处测定吸收度。按照以下公式计算DPPH自由基清除率。实验重复3次,求得清除率的平均值。以IC50(清除率大达50%时所需的浓度)作为抗氧化能力的强弱。
DPPH自由基清除率=(A0-A1)·A0-1×100/%
式中A1为测试样品吸收度;A0为空白对照的吸收度。
测定结果表明,牡丹种皮提取物(MD)和芍药种皮提取物(SY)及10种茋类化合物均具有一定的清除DPPH自由基活性,2种种皮提取物的IC50值分别为4910,5031 mg·L-1,无显著性差异;10种茋类化合物中suffruticosol B(2)和transresveratrol(4)的IC50值较低,分别为634,460 μmol·L-1,与生育酚相当(IC50 490 μmol·L-1),具有较强的清除DPPH自由基能力;化合物suffruticosol A的IC50最高,活性较弱,而其他7个茋类化合物活性一般。另外,结果也表明实验中的白藜芦醇及其低聚物随聚合度增加清除DPPH自由基能力无明显构效关系, 见图3。
1suffruticosol A; 2suffruticosol B; 3 suffruticosol C ; 4 transresveratrol ; 5 cisεviniferin ; 6 transεviniferin ; 7 cissuffruticosol D; 8 cisgnetin H; 9 transsuffruticosol D; 10 transgnetin H; MD 牡丹种皮提取物; SY 芍药种皮提取物; Trolox 生育酚。
图3牡丹和芍药种皮提取物及10种茋类化合物清除DPPH自由基能力
Fig3The removal ability of DPPH free radicals of peony seed coat extract and its ten stilbenes
3分析与讨论
天然茋类化合物(stilbenoids)是一类以1, 2二苯乙烯为骨架结构的天然多酚类化合物,代表性的为白藜芦醇和 combretastatin A4,前者潜在的营养和药用价值已被广泛认可,后者具有强的抑制微观蛋白多聚化已被修饰为磷酸化盐衍生物CA4P,目前作为甲状腺未分化癌治疗药物已处于临床Ⅲ期。
天然白藜芦醇低聚物是白藜芦醇在自然界通过低聚化和异构化等方式修饰产生的结构类型多样的一类数目最多的重要茋类化合物,除了作为天然的植物抗毒素外,具有多种药理活性[14],如抗病原微生物(细菌、真菌和病毒)、抗肿瘤、抗氧化、雌激素样、抗炎和免疫调节等。许多研究表明一些茋类低聚体的抗氧化、抗肿瘤和抗炎活性明显强于其单体白藜芦醇,作用机制也不尽相同。激励国内外学者从中发现选择性高、毒副作用小的新型药物候选物和药物资源[1516]。然而由于结构复杂性使得缺乏有效的全合成方法[17],同时该类化合物大多在自然界中含量低、难以分离和结构鉴定,限制了对其系统研究和开发。因此寻找高含量、活性强的茋类低聚体的植物资源,并在此基础上通过人工修饰、改善生物利用度和选择性是当前的主要手段。
本文研究表明,牡丹和芍药种子中白藜芦醇及其低聚物等茋类成分特征性地分布于种皮部位,含量达167%以上,明显高于目前已知的其他天然植物。而牡丹和芍药种仁仅含有少量的茋类成分,有利于对牡丹和芍药种子的分类利用。牡丹和芍药种皮中茋类成分经提取后能得到有效富集,总茋类成分含量在提取物中可达75%以上,有利于种皮中活性茋类成分的开发利用。
牡丹(包括油用和药用)植物人工栽培面积大,资源丰富,但在使用上其种壳作为废弃物未能得到有效利用,而白藜芦醇低聚物在种皮中含量高,这为将来开发利用提供了资源保障。另外,国内外学者和作者研究表明,牡丹种子中的茋类化合物具有多种生物活性,特别是抗肿瘤活性较强,对肺癌和乳腺癌细胞增殖的抑制浓度低,分别比白藜芦醇强20和68倍,且无明显毒性[6],提示牡丹种皮中的茋类成分是重要的潜在药物资源。
[参考文献]
[1]Li S S, Yuan R Y, Chen L G, et al Systematic qualitative and quantitative assessment of fatty acids in the seeds of 60 tree peony (Paeonia section Moutan DC) cultivars by GCMS[J] Food Chem, 2015, 173: 133
[2]何春年, 肖伟, 李敏, 等 牡丹种子化学成分研究[J] 中国中药杂志, 2010, 35(11): 1428
[3]He C N, Peng Y, Xiao W, et al Determination of chemical variability of phenolic and monoterpene glycosides in the seeds of Paeonia species using HPLC and profiling analysis[J] Food Chem, 2013, 138: 2108
[4]Satyajit D S, Pensri W, Laurence D Identification and ecdysteroid antagonist activity of three resveratrol trimers (suffruticosols A, B and C) from Paeonia suffruticosa[J] Tetrahedron, 1999, 55 (2): 513
[5]He C N, Peng Y, Xu L J, et al Three new oligostilbenes from the seeds of Paeonia suffruticosa[J] Chem Pharm Bull, 2010, 58 (6): 843
[6]Gao Y, He C N, Ran R, et al The resveratrol oligomers, cis and trans gnetin H, from Paeonia suffruticosa seeds inhibit the growth of several human cancer cell lines[J] J Ethnopharmacol, 2015, 169:24
[7]Kim H J H, Sang C, Choi S W Inhibition of tyrosinase and lipoxygenase activities by resveratrol and its derivatives from seeds of Paeonia lactiflora [J] Nutr Food, 2002, 7(4):447
[8]Ryu H W, Song H H, Shin I S, et al Suffruticosol A isolated from Paeonia lactiflora seedcases attenuates airway inflammation in mice induced by cigarette smoke and LPS exposure[J] J Funct Foods, 2015, 17: 774
[9]Myungsuk K, Sue J L, Sarangerel O, et al Gnetin H isolated from Paeonia anomala inhibits FcεRImediated mast cell signaling and degranulation[J] J Ethnopharmacol, 2014, 154: 798
[10]Heung J Y, Hyung W R, Seong H J, et al Profiling of neuraminidase inhibitory polyphenols from the seeds of Paeonia lactiflora[J] Food Chem Toxicol, 2013, 55: 144
[11]Kim H J, Chang E J, Cho S H, et al Antioxidative activity of resveratrol and its derivatives isolated from seeds of Paeonia lactiflora[J] Biosci Biotechnol Biochem, 2002, 66(9): 1990
[12]He C N, Peng Y, Wu Q L, et al Simultaneous determination of ten stilbenes in the seeds of Paeonia species using HPLCDAD[J] J Liq Chromatogr Relat Technol, 2013, 36(12): 1708
[13]Li A N, Li S, Li H B, et al Total phenolic contents and antioxidant capacities of 51 edible and wild flowers[J]J Funct Food, 2014,6:319
[14]Xiao K, Zhang H J, Xuan L J, et al Stilbenoids: chemistry and bioactivities[J] Stud Nat Prod Chem, 2008, 34:453
[15]Ito T, Akao Y, Yi H, et alAntitumor effect of resveratrol oligomers against human cancer cell lines and the molecular mechanism of apoptosis induced by vaticanol C[J]. Carcinogenesis, 2003, 24(9):1489
[16]Shen T, Wang X N, Lou H X Natural stilbenes: an overview[J] Nat Prod Rep, 2009, 26: 916
[17]Snyder S A, Gollner A, Chiriac M I Regioselective reactions for programmable resveratrol oligomer synthesis[J] Nature, 2011, 474(7352):461
[责任编辑丁广治]
