不同基因型幽门螺杆菌对人胃黏膜上皮细胞引起免疫损伤的作用
2016-05-10136000吉林省四平市中心人民医院消化内科朱立宁姚志新212001镇江江苏大学附属江滨医院消化内科徐岷张尤历
136000 吉林省四平市中心人民医院消化内科(朱立宁,姚志新);212001 镇江,江苏大学附属江滨医院消化内科(徐岷,张尤历)
·临床研究·
不同基因型幽门螺杆菌对人胃黏膜上皮细胞引起免疫损伤的作用
朱立宁徐岷张尤历姚志新
136000吉林省四平市中心人民医院消化内科(朱立宁,姚志新);212001镇江,江苏大学附属江滨医院消化内科(徐岷,张尤历)
幽门螺杆菌(Hp)是一种革兰氏阴性微需氧螺旋状细菌,其与慢性胃炎、胃溃疡、十二指肠溃疡和胃癌等疾病密切相关。国际癌症机构已将Hp列为Ⅰ级致癌因子。Hp感染在全世界非常普遍,然而只有少部分最终在其他诱因的共同作用下导致胃癌的发生,提示不同基因型的Hp在胃癌的发生发展中起了重要的作用[1]。Hp含有的CagA基因及VacA基因分别编码细胞毒素相关蛋白及空泡毒素,根据两种基因表达情况将Hp菌株分为:Ⅰ型含有CagA及VacA基因,并表达两种蛋白(即CagA+VacA+);Ⅱ型不含CagA基因,不表达两种蛋白(即CagA-VacA-);以及一些中间表达型,即表达一种毒力因子(即CagA+VacA-和CagA-VacA+)。本研究以不同基因型的Hp与胃黏膜上皮细胞共孵育,检测炎性因子白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)、IL-10的水平变化,以揭示不同基因型Hp的毒力变化及其对免疫微环境的影响,探讨不同基因型的Hp对胃黏膜炎性反应的影响和致瘤性。
1材料和方法
1.1材料
人胃黏膜上皮细胞株(GES-1)来自江苏大学生命科学院细胞库;国际标准菌株NCTC11637(CagA+VacA+)由英国胃肠病学会主席英国诺丁汉大学王后医学中心教授Atherton馈赠;菌株S32(CagA+VacA-)、Z47(CagA-VacA+)、S71(CagA-VacA-)来自江苏大学生命科学院菌株库。主要试剂及仪器:哥伦比亚培养基,DMEM培养基,人HpVacA ELISA试剂盒,人IL-8、IL-10、TNF-α ELISA试剂盒,分光光度计,PCR仪。
1.2方法1.2.1Hp培养及基因鉴定菌株接种于哥伦比亚培养基(哥伦比亚培养琼脂加10%脱纤维羊血及选择性抗生素),37℃微需氧条件下培养72~96 h。将菌株提取基因组后采用PCR方法鉴定CagA+及CagA-的菌株,利用Primer Premier 5.0软件设计CagA基因引物:上游5′-GCCACTACCACCACCGACAT-3′,下游5′-TGCCTAGCTCCAGGACCAC-3′(上海生工技术有限公司),PCR产物长266 bp。经人HpVacA ELISA试剂盒鉴定VacA+及VacA-的菌株。
1.2.2GES-1培养将人胃黏膜上皮细胞株GES-1采用DMEM加10%小牛血清常规培养,待细胞生长良好时用于下一步实验。
1.2.3Hp感染细胞模型的建立将处于指数生长期的细胞消化计数,调整浓度为1×105/mL,吸取悬液于24孔培养板中(每孔1 mL)贴壁培养过夜。用分光光度计调整Hp浓度为1.0×109CFU/mL(A660=1×108CFU/mL),分别取4种不同菌株的菌液100 μL加入培养板中,取100 μL布氏肉汤加入培养板中作为对照,每组重复24孔,培养箱共孵育,取8 h培养上清置于-70℃保存(共孵育超过10 h则有细胞不同程度脱壁、变形及死亡),用于行ELISA检测。
1.2.4实验分组将布氏肉汤处理细胞的上清液作为对照组,将4种不同基因型Hp菌株(CagA-VacA-型、CagA-VacA+型、CagA+VacA-型、CagA+VacA+型)处理细胞的上清液,分别定为CagA-VacA-组、CagA-VacA+组、CagA+VacA-组及CagA+VacA+组。
1.2.5ELISA检测IL-8、IL-10、TNF-α含量严格按照试剂盒说明书进行操作,450 nm波长读取吸光度值,绘制标准曲线,根据标准曲线取得上述待测品浓度值。
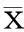
2结果
2.1不同基因型Hp菌株的筛选
提取HpDNA,以CagA基因引物进行PCR鉴定,样本琼脂糖凝胶电泳,在266 bp处可见阳性扩增条带,筛选出CagA+及CagA-的菌株,结果见图1;Hp培养后,PBS洗涤、离心,留取上清,经HpVacA ELISA试剂盒筛选出VacA+及VacA-的菌株,结果见表1。经上述两种方法从菌株库中分离出4种不同基因型的Hp,分别为:NCTC11637(CagA+VacA+)、S32(CagA+VacA-)、Z47(CagA-VacA+)和S71(CagA-VacA-)。

注:M为DL 2000 Marker;泳道1为Z47菌株;2为S71菌株;3为NCTC11637菌株;4为S32菌株。3、4可见266 bp CagA基因PCR扩增片段,1、2未见CagA基因PCR扩增片段
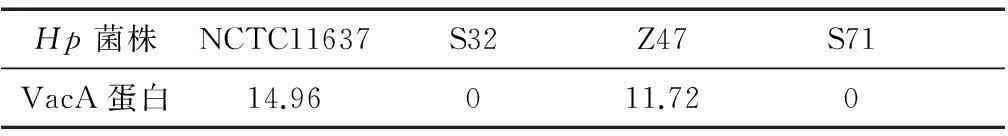
图1 CagA基因型PCR扩增产物电泳图
2.2不同基因型Hp菌株对胃上皮细胞分泌IL-8水平的影响
CagA+VacA+组及CagA+VacA-组IL-8浓度为(58.11±4.15)pg/mL、(56.38±4.40)pg/mL,高于CagA-VacA+组、CagA-VacA-组及对照组,差异具有统计学意义(P<0.01);后者IL-8浓度分别为(52.32±3.18)pg/mL、(50.84±3.52)pg/mL和(51.30±3.16)pg/mL。见表2。
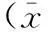
表2 不同组别上清中细胞因子水平比较±s,pg/mL)
注:与对照组、CagA-VacA-组及CagA-VacA+组相比,aP<0.01
2.3不同基因型Hp菌株对于胃上皮细胞分泌TNF-α水平的影响
CagA+VacA+组及CagA+VacA-组TNF-α浓度为(5.17±0.77)pg/mL、(5.03±0.86)pg/mL,高于CagA-VacA+组、CagA-VacA-组及对照组,差异具有统计学意义(P<0.01);后者TNF-α浓度分别为(4.20±1.29)pg/mL、(3.88±1.17)pg/mL和(4.17±1.20)pg/mL。见表2。
2.4不同基因型Hp菌株对胃上皮细胞分泌IL-10水平的影响
CagA+VacA+组及CagA+VacA-组IL-10浓度分别为(7.99±1.48)pg/mL、(8.27±1.60)pg/mL,低于CagA-VacA+组、CagA-VacA-组及对照组,差异具有统计学意义(P<0.01);后者IL-10浓度分别为(10.35±1.47)pg/mL、(10.06±1.78)pg/mL和(10.52±1.65)pg/mL。见表2。
3讨论
Hp定植于胃黏膜上皮细胞后,因受到Hp菌体成分及外泌毒素的刺激而合成多种促炎因子,趋化多种免疫相关细胞聚集到胃黏膜固有层,活化的免疫细胞继续释放细胞因子,募集更多免疫细胞,形成瀑布式循环反应。患者出现明显临床症状时,各种细胞因子在胃黏膜内高表达或低表达,并伴有明显的炎性细胞浸润,这些表现是从Hp定植于胃黏膜上皮细胞开始的[2-3]。本研究关注了不同基因型Hp与胃上皮细胞作用时,胃上皮细胞来源的IL-8、TNF-α、IL-10的表达水平,而且这些细胞因子与Hp导致的后续的炎性细胞浸润等病理生理过程密切相关。
IL-8和TNF-α在炎性反应的发生发展中起着重要的作用,而且与肿瘤发生密切相关。IL-8在Hp阳性的胃窦黏膜中表达较Hp阴性者明显增加,且与炎性程度呈正相关[4]。在慢性胃炎、消化性溃疡患者中,Hp阳性患者胃窦黏膜上皮细胞TNF-α mRNA表达高于Hp阴性患者,且与Hp密度、炎性细胞浸润程度呈正相关[5]。TNF-α除了抗瘤细胞活性外,还可以通过影响靶细胞膜的磷脂代谢引起细胞凋亡和组织损伤[6],Hp感染后,TNF-α分泌增加,造成胃黏膜上皮细胞凋亡与增殖平衡失调,这可能是引起消化性溃疡、萎缩性胃炎、胃癌的重要机制[7-8]。IL-10有很强的抗炎作用,可以抑制IL-8、TNF-α等多种炎性因子的合成,其在Hp致病中可能有类似的效应。在胃部疾病中,各种损伤因子可改变胃黏膜的微环境,导致促炎与抗炎细胞因子之间的失衡,如IL-8、TNF-α等的上调,从而促进炎性反应,IL-10则通过调节免疫、抑制促炎因子的分泌和活性,起着保护黏膜、减少组织损伤的作用[9]。机体受到病原体刺激后,会产生炎性反应,促炎因子和抑炎因子相互制约,共同起着清除病原体、恢复机体免疫稳定状态的作用。Hp感染后,可诱导胃黏膜产生TH1优势的免疫反应,分泌大量的促炎细胞因子(如IL-8、TNF-α),造成黏膜的免疫损伤,与此同时TH2细胞受到抑制,分泌IL-10减少,导致B细胞分泌的IgA减少,不能有效清除Hp,使Hp持续存在,炎性反应持续存在[10]。
本研究提示,Hp感染人胃黏膜后,IL-8、TNF-α、IL-10分泌水平受CagA+基因型Hp影响,而与VacA+基因型Hp无关。因此,CagA+基因型Hp菌株定植于胃黏膜,可打破IL-8、TNF-α、IL-10分泌水平的平衡,易引起细胞微环境免疫失衡,导致胃上皮细胞损伤,从而引起胃黏膜上皮细胞过度凋亡,造成胃黏膜上皮细胞凋亡与增殖平衡失调。从免疫原理分析,CagA+基因型Hp菌株具有较强的毒力。
通过不同基因型的Hp对胃黏膜上皮细胞诱导IL-8、TNF-α、IL-10分泌能力差异的分析,揭示了CagA+基因型Hp菌株具有较强的毒力,对胃黏膜上皮细胞免疫微环境的影响明显,说明CagA+基因型Hp菌株介导的炎性反应可增加胃黏膜损伤,易导致胃黏膜萎缩,并进展为慢性萎缩性胃炎,甚至胃癌。因此,Hp基因分型对于指导临床治疗及判断预后具有重要意义。
参考文献
1 Amieva MR, El-Omar EM. Host-bacterial interactions in Helicobacter pylori infection[J]. Gastroenterology, 2008, 134: 306-323.
2 Moon RT, Kohn AD, De Ferrari GV, et al. WNT and beta-eatenin signalling: diseases and therapies[J]. Nat Rev Genet, 2004, 5: 691-701.
3 Naito M, Yamazaki T, Tsutsumi R, et al. Influence of EPIYA-repeat polymorphism on the phosphorylation-dependent biological activity of Helieobaeter Pylori CagA[J]. Gastroenterology, 2006, 130: 1181-1190.
4 Kumar S, Kumari N, Mittal RD, et al. Association between pro-(IL-8) and anti-inflammatory (IL-10) cytokine variants and their serum levels andH.pylori-related gastric carcinogenesis in northern India[J]. Meta Gene, 2015, 6: 9-16.
5 Triantafillidis JK, Gikas A, Merikas E. Treatment of inflammatory bowel disease patients with anti-TNF-α factors and immunosuppressives does not influence the prevalence of Helicobacter pylori infection[J]. Indian J Gastroenterol, 2014, 33: 383-384.
6 Fiorucci S, Santucci L, Migliorati G. Isolated guinea pig gastric chief cells express tumor necrosis factor receptors coupled with the sphingomyelin pathway[J]. Gut, 1996, 38: 182-189.
7 Neu B, Puschmann AJ, Mayerhofer A, et al. TNF-α induces apoptosis of parietal cells[J]. Biochem Pharmacol, 2003, 65: 1755-1760.
8 Koyama S. Flow cytometric measurement of tumor necrosis factor-related apoptosis-inducing ligand and its receptors in gastric epithelium and infiltrating mucosal lymphocytes in Helicobacter pylori-associated gastritis[J]. J Gastroenterol Hepatol, 2003, 18: 763-770.
9 Rizzuti D, Ang M, Sokollik C, et al. Helicobacter pylori inhibits dendritic cell maturation via interleukin-10-mediated activation of the signal transducer and activator of transcription 3 pathway[J]. J Innate Immun, 2015, 7: 199-211.
10 Abbas Z, Yakoob J, Usman MW, et al. Effect of Helicobacter pylori and its virulence factors on portal hypertensive gastropathy and interleukin (IL)-8, IL-10, and tumor necrosis factor-alpha levels[J]. Saudi J Gastroenterol, 2014, 20: 120-127.
(本文编辑:周骏)
(收稿日期:2015-05-20)
基金项目:江苏省卫生厅科技项目(H201047)
DOI:10.3969/j.issn.1673-534X.2016.01.016
