基质金属蛋白酶-9与急性脑出血后脑水肿的相关性研究
2016-05-09李文杰
张 方 李文杰
河南焦作市第二人民医院 焦作 454150
基质金属蛋白酶-9与急性脑出血后脑水肿的相关性研究
张 方 李文杰
河南焦作市第二人民医院 焦作 454150
目的 探讨急性自发性脑出血后血肿周围脑水肿的形成,观察基质金属蛋白酶-9(MMP-9)的动态变化,分析脑水肿与MMP-9的相关性。方法 20例出急性脑出血患者血清MMP-9的含量进行动态观察,分别于发病后24 h、第3天、第7天、第14天清晨抽取静脉血3 mL(除前2次外均需空腹),采用酶联免疫法检测。对脑水肿面积以及血肿面积,神经功能缺损评分情况进行统计。结果 脑出血患者血清MMP-9水平呈动态变化,发病3~7 d明显升高,之后下降,脑出血急性期血清MMP-9水平与血肿周围脑水肿量呈正相关。MMP-9与出血后脑水肿的发生时间存在一致性。结论 MMP-9参与了脑出血急性期脑水肿形成的机制,MMP-9的高表达可能是出血早期引起BBB开放、血管源性脑水肿的重要原因,阻断脑出血后MMP-9的激活及降低其过度表达是防治脑水肿形成的一个潜在途径。
急性脑出血;脑水肿;基质金属蛋白酶-9;相关性
脑出血(intracerebrbral hemorrhage,ICH)是急性脑血管病中病死率最高的,也具有较高的致残率,给社会和家庭带来巨大的经济负担。脑出血后血肿的占位效应,脑水肿的产生和扩大,血脑屏障的破坏以及血肿周边组织的缺血,血肿自身的毒性作用均是引发脑组织损伤的主要因素。基质金属蛋白酶-9(matric metalloproteinase-9,MMP-9)又称胶原酶,是基质金属蛋白酶(MMPs)的一种。近年来其对脑水肿的影响倍受关注,研究发现阻断 MMP-9的过高表达可能是防治ICH后脑水肿的有效手段。现报道如下。
1 对象与方法
1.1 入选标准 2009-12—2012-12我院神经内科20例急性原发性脑出血患者,均符合1995年全国第4次脑血管病会议修订的《各类脑血管疾病诊断要点》中的脑出血的诊断标准。排除标准:(1)排除抗凝剂、血液病及瘤卒中导致的脑出血、外伤后脑出血、溶栓后脑出血、动脉瘤及动(静)脉畸形导致的脑出血;(2)脑干功能衰竭者及脑疝已形成的患者;病情进展过快, 短期即陷深昏迷;意识状况分级Ⅴ级患者;血压过高>26.6/16 kPa,眼底出血者;(3)凡处于全身衰竭状态、体温过低者、并发低血压或伴严重心、肾功能不全者;(4)经检查证实为脑肿瘤、脑寄生虫病、癫痫史、代谢障碍、风湿性心脏病及其他心脏病合并房颤者;(5)非基底节区出血,或出血量<30 mL或>60 mL;(6)精神病及对局麻药物过敏者;(7)年龄>75岁者;孕产期及喂乳期妇女。
1.2 一般资料及分组 入选病例20例,经头颅CT检查均诊断为脑出血,符合纳入标准。经影像学检查均有不同程度的脑水肿,存在不同程度的意识障碍、运动功能障碍及颅内压增高表现。年龄(55.85±8.73)岁,入院时出血量(49.70±7.46)mL,水肿量(26.65±5.92)mL,神经功能缺损(MESSS)评分20.65±5.25。正常对照组为我院同期门诊体检的健康者20例,年龄(60.45±8.05)岁。2组年龄、性别及病史无显著性差异(P>0.05),具有可比性。
1.3 方法 脑出血组患者分别于发病24 h内、24 h、第3天、第7天、第14天清晨抽取静脉血3 mL(除前2次外均需空腹),2 500 r/min离心8~10 min,取血清置于-70 ℃冰箱保存待检。
1.4 观察指标及评分标准
1.4.1 影像学指标:脑血肿及周围水肿体积分别于治疗后第1、7及14天复查头颅CT。可根据病情变化随时行头颅CT检查。血肿体积的计算依据多田公式,血肿周围水肿体积=π/6×L(血肿的最大层面水肿区域的长径)×S(与最大长径垂直的直径)×slice(血肿的层数),实际血肿周围水肿体积=血肿周围水肿的体积-同一时间血肿体积。
1.4.2 神经功能缺损评分:分别在入院时、30 d进行神经系统体格检查。
1.4.3 实验室检查指标:检测血清MMP-9的含量,分别于发病24 h内、24 h、第3天、第7天、第14天各检测1次。
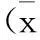
2 结果
脑出血患者血肿量、脑水肿量、神经功能缺损评分、MMP-9的表达情况比较见表1、2,图1。入院后30 d与入院时神经功能缺损评分(MESSS)比较,入院时20.65±5.25,入院后30 d 为11.00±3.06,差异有统计学意义(P<0.05)。
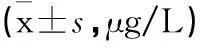
表1 不同时间MMP-9水平比较
注:与对照组比,*P<0.05

表2 第7天及第14天血肿量及脑水肿量±s)
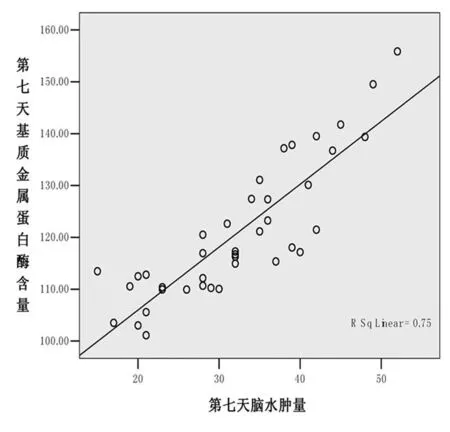
图1 第7天MMP-9含量和脑水肿量的相关性
脑出血后,血肿周围水肿带形成于3~5 d达到高峰,此时水肿体积是初始的1.5~2倍[1],故脑出血治疗后第7天水肿量较前明显增加,脑出血后第14天血肿及水肿均有所吸收及消退,脑出血后血清MMP-9表达水平与脑水肿呈正相关,脑出血6 h后MMP-9开始表达,3~7 d达高峰,之后开始下降,提示MMP-9与出血后脑水肿的发生时间存在一致性。相关性分析结果显示,急性期(出血后第7天)患者血清MMP-9含量与血肿周围水肿量呈正相关(r=0.866,P<0.01),可见MMP-9的表达增加可能是出血早期引起脑水肿形成的重要原因,结合CT结果证实MMP-9的作用时间与脑水肿的变化一致,MMP-9参与了脑出血急性期脑水肿形成的机制。
3 讨论
本研究发现,脑出血患者血清MMP-9水平于发病后3~7 d明显升高,且MMP-9的含量与CT所示出血灶周围脑水肿量呈显著正相关。由此可见,脑出血患者有MMP-9的过度表达,测定MMP-9水平可反映脑水肿的严重程度,由此推测MMP-9的高表达可能是出血早期引起BBB开放、血管源性脑水肿的重要原因。在吸收期MMP-9水平呈下降趋势,但仍高于正常水平,结合CT结果证实MMP-9的作用时间与脑水肿的变化一致。
脑出血后在血肿周围存在水肿形成和继发性缺血损伤区。脑水肿是除血肿外造成颅内压增高和继发性神经损伤的重要机制之一,易导致脑出血患者病情加重,并发脑疝,是出血性脑卒中患者早期死亡的重要原因[2-3],脑水肿根据发病机制不同,神经病理学家Klazo将BE分为两种类型,一种为细胞毒性BE(cell's toxic brain edema,CTBE);另一种为血管源性BE(vasogenic brain edema,VBE),两者通常同时存在。出血后脑水肿的主要发病机制:(1)血肿周围继发性脑缺血所致的神经功能损害[4];(2)凝血酶的细胞毒性作用[4]及对BBB的破坏[5];(3)各种炎症因子释放增加所致的炎症反应[6];(4)基质金属蛋白酶(matric metalloproteinase,MMP)表达增高导致血管基底膜的损伤[7];(5)自由基损害、细胞内钙超载、水通道蛋白高表达等。已有研究表明,自发性脑出血24 h内脑水肿为细胞能量代谢障碍导致的细胞毒性脑水肿,后期则是血脑屏障破坏所致的血管源性脑水肿,是脑出血最为严重的继发性损伤,其产生和发展是导致病情恶化的关键因素[5]。MMP-9属 MMPs家族中明胶酶类,MMPs是一组降解细胞外基质蛋白酶,细胞外基质是构成血管基底膜的主要成分,在一定程度上决定血管的完整性。基质金属蛋白酶-9(matric metalloproteinase-9,MMP-9)对脑水肿的影响倍受关注,MMP-9是人体内最重要的蛋白酶之一,主要由单核细胞、巨噬细胞、中性粒细胞、成纤维细胞、内皮细胞等合成与分泌。MMP-9的表达增加可能是脑出血后引起血-脑屏障(blood brain barrier,BBB)开放、形成血管源性脑水肿的重要原因之一。Abilleira等[8]报道ICH患者发病24 h内血清MMP-9水平升高;Alvarez-Sabln等[9]研究显示,ICH患者血清MMP-9水平与血肿周围水肿体积相关。ICH后MMP-9被释放和激活,促进血管基底膜降解,增加血-脑屏障通透性,导致血肿周围水肿加重,因此,阻断MMP-9可能是防治ICH后脑水肿的有效手段。
[1] 王卓尔,吴亚双,王明礼.高血压壳核出血脑水肿CT动态观察[J].佳木斯医学院学报,1995,18(4):2.
[2] KozlerP, Pokerny J, Langmeier M, et al.Pathophysiology and clinical aspects of brain edema[J].Cas Lek Cesk,2002,14(18):571.
[3] Kawai N, Kawanishi M, Okauchi M, et al.Effects of hypothermia on thrombin-induced brain edema formation[J].Brain Res, 2001,895(1/2):50-58.
[4] Xue M, Bigio M, Frcpc K, et al.Acute tissue damage after injection of thrombin and plasmin into rat striatum[J].Stroke, 2001,32(9):2 164-2 169.
[5] Lee KR, Kawai N, Kim S, et al.Mechanisms of edema formation after intracerebral hemorrhage:effect of thrombin on cerebral blood flow, blood-brain barrier permeability, and cell survival in rat model[J].J Neurosurg, 1997,86(2):272-278.
[6] Del Bigio MR, Yan HJ, Buist R, et al.Experimental intracerebral hemorrhage in rats.Magnetic resonance imaging and histopathological correlates [J].Stroke, 1996,27(12):2 312-2 319.
[7] Rosenberg GA.Matrix melloproteinases in brain injugy [J].Neurotrauma, 1995,12(5):833-842.
[8] Abilleira S, Montaner J, Molina CA, et al.Matrix metalloproteinase-9 concentration after spontaneous intracerebral hemorrhage[J].Neurosurg, 2003,99(1):65-70.
[9] Alvarez-Sabin J,Delgado P,Abilleira S,et al.Temporal profile of matrix metalloproteinase and their inhibitors of matrix after spontaneous intracerebral hemorrhage relationship to clinical and radiological outcome[J].Stroke, 2004,35(6):1 361-1 362.
(收稿 2015-03-12)
R743.34
A
1673-5110(2016)07-0077-03
