进境草种种带真菌的检测与初步鉴定
2016-05-07雷娅红况卫刚郑春生汪万春李春杰高文娜
雷娅红,况卫刚,郑春生,汪万春,李春杰,高文娜
(1.草地农业生态系统国家重点实验室兰州大学草地农业科技学院,甘肃兰州 730020;2.中国农业大学农学与生物技术学院,北京 100193; 3.北京出入境检验检疫局检验检疫技术中心,北京 101312)
进境草种种带真菌的检测与初步鉴定
雷娅红1,况卫刚2,郑春生3,汪万春3,李春杰1,高文娜3
(1.草地农业生态系统国家重点实验室兰州大学草地农业科技学院,甘肃兰州 730020;
2.中国农业大学农学与生物技术学院,北京 100193; 3.北京出入境检验检疫局检验检疫技术中心,北京 101312)
采用平皿测定法对我国北京口岸2014年进境草种高羊茅(Festuca arundinacea)、多年生黑麦草(Lolium perenne)和苏丹草(Sorghum sudanense)携带真菌进行分离培养,利用ITS4和ITS5引物对其内转录间隔区(Internal Transcribed Spacer,ITS)进行扩增,PCR产物纯化后测序并与数据库中的已知序列进行BLAST比对,对种带真菌进行初步鉴定。研究结果表明,不同来源种子携带真菌种类差异较大,从5个国家的7个进境草种批次中共检测出13属21种48株真菌,主要菌群为镰刀菌属(Fusarium spp.)、曲霉属(Aspergillus spp.)、茎点霉属(Phoma spp.)和链格孢属(Alternaria spp.)。基于ITS序列构建系统发育树,能够将所有分离到的真菌鉴定到属,但是在种水平上鉴定有限,不能将细极链格孢(Alternaria tenuissima)、细交链孢(A.alternata)和乔木链格孢(A.arborescens)很好地区分开。本研究明确了5个来样量较大国家的草种带菌情况,ITS基因能够运用于口岸草种携带真菌的初步检测鉴定。
进境草种;种带真菌; ITS;鉴定
本研究利用ITS基因结合形态学系统性地对我国来样量较大的5个国家的几个重要草种种带真菌进行了检测鉴定,旨在明确我国进出境口岸草种的带菌情况,对草种质量进行评价,为客户购买提供参考和指标,为快速通关提供技术支持,为进出境检疫管理部门提供执法依据。
1 材料和方法
1.1研究材料
1.1.1供试草种 2014年7个草种批次,来源于美国、新西兰、澳大利亚和丹麦的多年生黑麦草(Lolium perenne),来源于美国的高羊茅(Festuca arundinacea)以及来源于加拿大的苏丹草(Sorghum sudanense),由北京出入境检验检疫局检验检疫技术中心提供,材料详细信息如表1所示。
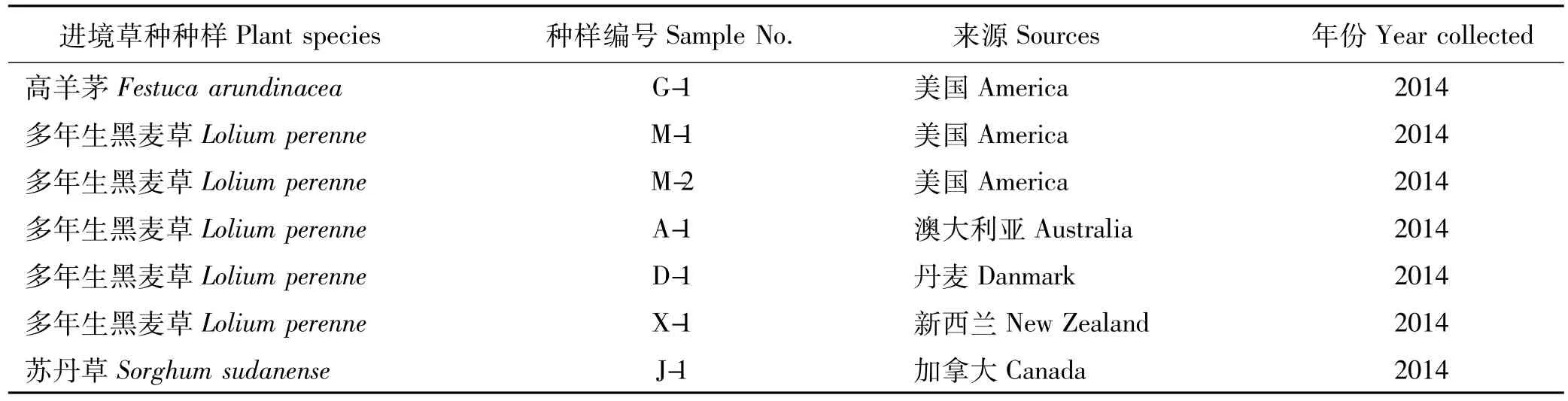
表1 进境牧草种样Table 1 The imported grass samples used in this study
1.1.2主要试剂和仪器 ABPDA(Antibiotic Potato Dextrose Agar,含抗生素青、链霉素各100 mg·L-1的马铃薯葡萄糖琼脂培养基) ;植物基因组试剂盒,1×TAE电泳缓冲液购自天根生化; DL2000 Marker购自宝生物(大连)工程有限公司。
培养箱为日本三洋公司生产的WE52B5-959 型; Olympus BX51显微镜; PCR仪,凝胶成像系统分别为美国伯乐公司生产的icycler thermal cyci型和Universal HoodII型。
1.2草种种带真菌检测
每个种子批次随机取200粒草种,不经表面消毒,直接均匀地摆放于ABPDA平板培养基上,每皿10
随着我国农牧业和草业种植结构的调整,牧草种子需求量连年上升,供求严重失衡[1],黑麦草属(Lolium)和早熟禾属(Poa)等属草种进口量总体大幅度增长[2],草种进口量的增长使得其携带病原真菌的机率大大提高,很多病原菌对种子发芽、种苗活力都有一定的负作用,严重影响农业发展,造成巨大经济损失。如细交链孢(Alternaria alternata)、镰刀菌属(Fusarium spp.)、茎点霉属(Phoma spp.)等病原真菌都可引起黑麦草(L.perenne)及高羊茅(Festuca arundinacea)等草坪草发生病害,造成一定的经济损失[3-4]。真菌病害引起的各种叶枯、叶斑、腐烂、坏死等症状严重影响草坪质量和美观[5]。近几年来,北京口岸入境草种数量连续位居全国第一,据统计从2009年到2013年,北京口岸入境草种总量近7.5万t,如此大规模草种通过口岸入境给检验检疫带来巨大压力,因此,对进境草种进行病原真菌快速检测至关重要,同时对检测出的真菌进行准确分类,也是深入开展我国进出境口岸检疫性工作的必要前提和基础。口岸检疫主要采用传统的形态学方法对病原菌进行检测鉴定,缺乏有效高通量的检测手段,难以满足日益增长的检疫要求。目前内转录间隔区(Internal Transcribed Spacer,ITS)基因已被广泛用于真菌分类及鉴定[6-8],在真菌中整体的识别成功率可以达到72%[9]。ITS基因在不同物种间存在丰富的变异,为病原菌的分类鉴定及系统发育等研究提供了十分重要的依据,而且为建立病原菌的分子监测与疫病的快速诊断技术奠定了基础,对植物病害的防治具有重要意义[10]。粒,5皿为一重复,共设4个重复,于25℃黑暗条件下培养,每天进行观察,挑取真菌菌丝到新鲜PDA平板中进行纯化保存、镜检[11]。参考《真菌鉴定手册》[12],利用分子生物学技术结合真菌形态特征观察进行初步鉴定,并计算每种菌的分离率。
1.3种带真菌DNA提取
分离纯化的真菌在ABPDA培养基培养14 d后,采用天根生化植物基因组试剂盒提取各种带真菌DNA。具体步骤为:取约100 mg新鲜菌丝加入液氮充分碾磨;迅速转移到预先装有700 μL 65℃预热缓冲液GP1的离心管中,颠倒混匀后,65℃水浴20 min;加入700 μL氯仿,充分混匀,12 000 r·min-1离心5 min;取上层水相置新的离心管中,加入700 μL缓冲液GP2;混匀后,转入吸附柱CB3中,12 000 r·min-1离心30 s,弃废液;向CB3中加入500 μL缓冲液GD,12 000 r·min-1离心30 s,弃废液,将CB3放入收集管中;向CB3中加入600 μL漂洗液PW,12 000 r·min-1离心30 s,弃废液;重复上次步骤;将CB3放回收集管中,12 000 r·min-1离心2 min,弃废液;将CB3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液,转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50~200 μL洗脱缓冲液TE,室温放置2~5 min,12 000 r ·min-1离心2 min,将溶液收集到离心管中,于-20℃保存备用。
1.4 PCR扩增和测序
利用真菌ITS通用引物对ITS4 (5’TCCTCCGCTTATTGATATGC 3’)和ITS5 (5’GGAAGTAAAAGTCGTAACAAGG 3’)[13]进行PCR扩增。PCR反应体系为25 μL,含2×Taq PCR MasterMix溶液(天根生化),各引物(浓度10 μmol·L-1) 1 μL,模板2 μL,补充ddH2O至25 μL。扩增程序为: 94℃预变性5 min; 94℃变性30 s,52℃退火30 s,72℃延伸1 min,34个循环; 72℃延伸7 min。PCR扩增产物用1.5%的琼脂糖凝胶进行电泳检测,点样5 μL,用1×TAE电泳缓冲液在100 V的电场下电泳30 min左右,然后利用紫外凝胶成像仪观察照相并分析。PCR产物切胶回收送样上海英俊公司进行测序,所有序列提交至Genbank数据库(http: / / www.ncbi.nlm.nih.gov/genbank)。
1.5种带真菌ITS序列分析与系统发育树构建
对测序结果中碱基序列和序列峰图进行分析,利用DNASTAR软件包中的SeqMan对所获得的序列进行校对拼接。利用BioEdit软件[14]对每个碱基逐一进行人工校对,保证序列信息的准确可靠性。峰形混乱的低质量序列,重新进行测序以获得高质量的DNA序列。经校对的序列用Clustal X[15]软件进行序列比对。序列比对结果输入MEGA5.2软件,用邻接法(neighbor-joining,NJ)构建系统发育树,进行1 000次重抽样计算系统树中节点的置信度。
2 结果
2.1进境草种携带的真菌
经分离培养,利用ITS序列结合形态学特征观察从7个进境草种批次中共检测出13属21种48个菌株。不同草种携带的真菌种类差异较大,加拿大苏丹草(J-1)和丹麦多年生黑麦草(D-1)主要携带球状茎点霉(P.glomerata),分离率分别为36.3%和40.0%;澳大利亚多年生黑麦草(A-1)主要携带出芽短梗霉(Aureobasidium pullulans),分离率为28.5%;美国多年生黑麦草(M-1)主要携带浸染链格孢(A.infectoria),分离率为37.5%;美国多年生黑麦草(M-2)主要携带双隔膜德雷克斯孢菌(Drechslera biseptata),分离率为33.3%;新西兰多年生黑麦草(X-1)主要携带黑附球菌(Epicoccum nigrum),分离率为50%;美国高羊茅(G-1)仅携带亮白曲霉(A.candidus),分离率为100%(表2)。
2.2种带真菌形态学观察结果
分离纯化的种带真菌在ABPDA培养基培养14 d后,利用单反数码相机拍摄菌落形态照片,采用O-lympus BX51显微镜观察孢子形态,图1和图2分别为部分种带真菌菌落和孢子形态特征。
2.3种带真菌ITS-PCR扩增产物的电泳检测结果
采用ITS4和ITS5引物扩增纯培养的种带真菌的ITS序列,部分扩增产物的琼脂糖凝胶电泳检测结果如图3所示,可看到扩增条带清晰明亮、无拖尾和杂带现象,且各产物长度大约为500 bp,扩增效果良好,说明样品符合测序要求。
2.4系统发育树构建
测序所得结果在GenBank数据库中进行同源性比对,BLAST结果表明,各样品与数据库中属、种的相似度在98%以上,能够将枝孢霉(Cladosporium spp.)、镰刀菌(Fusarium spp.)、曲霉(Aspergillus spp.)、茎点霉(Phoma spp.)、链格孢(Alternaria spp.)和德氏霉(Drechslera spp.)等真菌鉴定到属。进一步采用邻接法构建系统发育树,所有的菌株均由本研究分离获得,如图4所示,不同的种均位于不同的末端分支,同一个种的菌株都不同程度地聚在一起,但是对于种的鉴定能力有一定的局限,不能将细极链格孢(A.tenuissima)、细交链孢(A.alternata)和乔木链格孢(A.arborescens)等区分开。图4中系统发育树内容依次为本研究真菌编号、Genbank登录号以及真菌拉丁名。

表2 草种种带真菌种类及分离率(%)Table 2 The percentage frequency(%) of fungi species isolated from seed samples
3 讨论与结论
目前DNA条形码技术广泛运用于物种的检测鉴定研究中,国内外学者对真菌条形码技术也进行了大量研究,在真菌分类鉴定工作方面也取得了突破性的进展[16]。由于真菌在ITS区大小合适、引物通用性强,扩增成功率高、便于高通量测序[17],以及ITS在真菌物种之间有广泛的序列多态性等特点,使得ITS序列适合于真菌物种的分子鉴定和物种属间或种间差异较明显的菌群间的系统发育关系分析[9],在2011年国际真菌DNA条形码工作会议上,ITS基因被确定为真菌鉴定的通用条形码。
本研究通过对草种携带真菌进行分离培养,利用分子生物学技术同时结合形态学方法鉴定出13 属22种48株种带真菌,来源不同的草种带菌情况差异较大,主要包括枝孢霉、镰刀菌、茎点霉、德氏霉、链格孢、轮枝菌、曲霉等真菌,明确了我国口岸引自5个国家7个草种携带真菌情况,为检疫部门对于草种携带真菌检测提供了理论依据。基于ITS基因构建的系统发育树(图4),结果表明不同属的真菌独立形成一枝,ITS对于不同的属有较好的鉴别能力。但是在种水平上鉴定能力有限,在Alternaria spp.形成的独立分支中,A.tenuissima,A.alternata和A.infectoria亲缘关系较近聚在一起,这与李永等[18]研究结果一致,ITS不能将链格孢属亲缘关系较近的29个小孢子种区分开。后续研究需进一步结合DNA条形码技术筛选出合适的基因对其进行检测鉴定,或利用多基因联合分析,如Pryor和Bigelow[19]利用ITS、甘油醛-3-磷酸(glyceraldehyde-3-phosphate dehydrogenase,gpd)和线粒体小亚基核糖体(mitochondrial small subunit rDNA,mtSSU) 3个基因联合分析,对链格孢属21个种进行系统发育分析。

图1 ABPDA培养基种带真菌菌落形态Fig.1 Colony morphology of fungal species on ABPDA

图2 ABPDA培养基种带真菌孢子形态Fig.2 Microconidia morphology of fungal species on ABPDA

图3 PCR扩增产物的琼脂糖凝胶电泳Fig.3 Agrarose gel electrophoresis results of PCR products
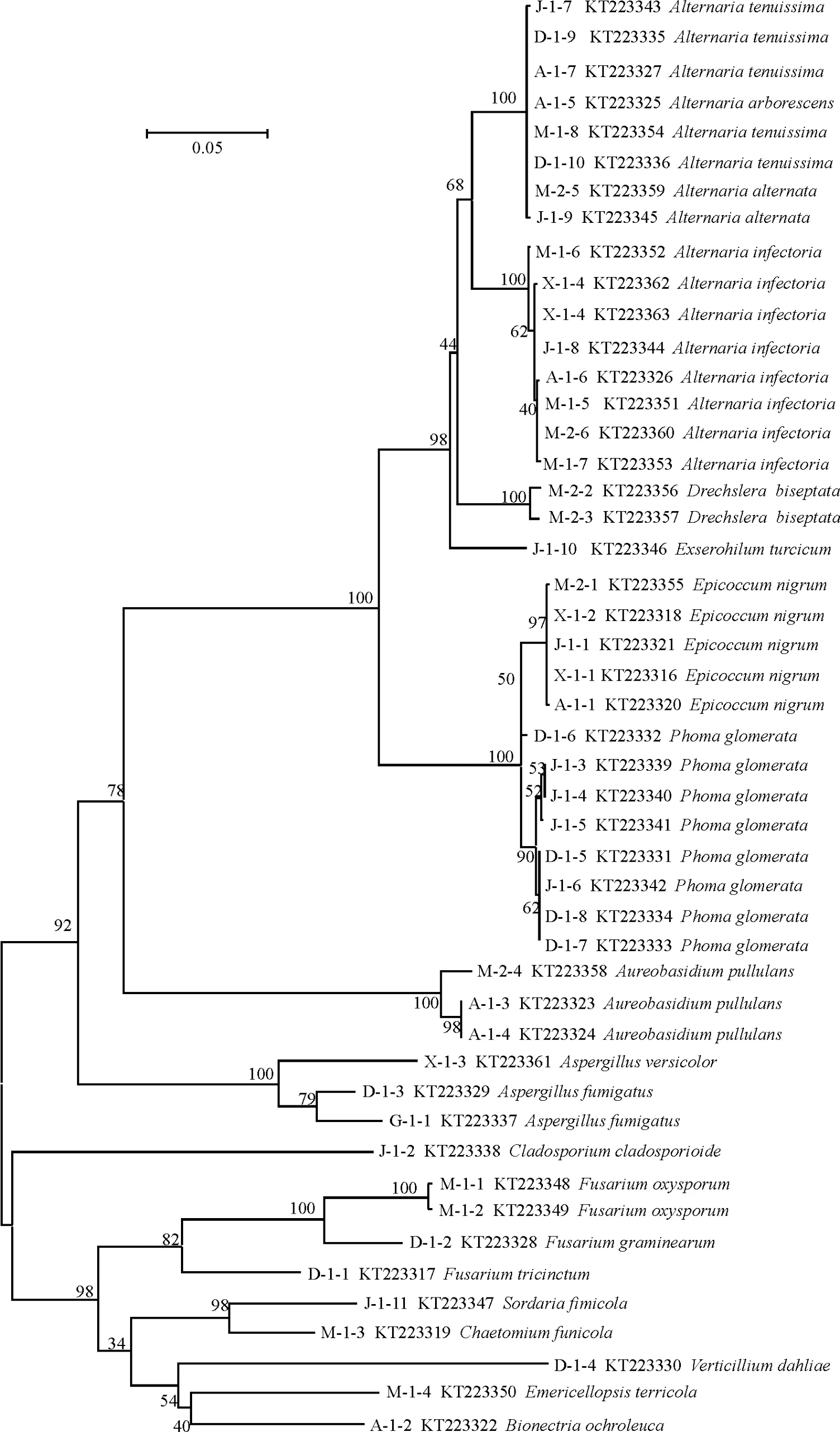
图4 基于ITS序列构建系统发育树Fig.4 Neighbor-joining trees based on ITS sequences
外界环境条件适宜时,种子携带真菌可能对植物健康生长产生严重的影响,对我国草业生产造成重大的经济损失,有研究表明,草种携带的德氏霉属(Drechslera spp.)、镰刀菌属(Fusarium spp.)、茎点霉属(Phoma spp.)等真菌能够侵染草坪草,造成较为严重的危害[20-21],镰刀菌属、链格孢属(Alternaria spp.)、曲霉属(Aspergillus spp.)影响草种的萌发和出苗生长,是许多草类苗期病害的病原,也是某些重要病害的初侵染源之一,在生产安全上不容忽视[22-23]。孔瑞芳[24]对苏丹草种子和幼苗进行致病性测定发现,大斑德氏霉(D.turcnica)、禾谷镰刀菌(F.graminearum)和燕麦镰刀菌(F.avenaceum)等分离自8个苏丹草品种上的病原真菌显著降低了种子发芽率、根长和苗长。本研究通过分离培养获得了镰刀菌、茎点霉、曲霉、轮枝菌及枝孢霉等真菌,但尚未对分离的真菌进行致病性测定,有待后续进一步完善。
研究结果表明,ITS序列能够有效地对真菌检测鉴定,可以应用于口岸进境草种携带真菌初步鉴定,为我国农业生产提供技术支撑。相对于传统的形态学鉴定方法,ITS序列分析用于真菌鉴定更客观高效[25],本研究分离的种带真菌多数较难利用形态学观察确定,仅有少数能较为准确的识别,但仍需分子生物学技术加以辅助鉴定。ITS基因的广泛应用为真菌的准确分类鉴定提供有力的技术基础,缩短了真菌鉴定时间,加快了通关进程,对检疫工作起到了积极的作用。但是ITS基因对于部分真菌不能够准确鉴定到种,需要进一步筛选其它基因辅助鉴定,Genbank中含有大量的ITS序列信息,构建并完善ITS序列数据库有利于实现对真菌高通量检测鉴定,符合口岸快速通关要求,易于标准化。
References)
[1]阿那尔.我国牧草种子生产现状.新疆畜牧业,2011(5) : 11-12.Anaer.Grass seed production status in China.Journal of animal husbandry in Xinjiang,2011(5) : 11-12.(in Chinese)
[2]王显国,韩建国.我国草种进口状况分析与展望.中国种业,2004(5) : 12-14.Wang X G,Han J G.Imported grass seed situation analysis and prospect in China.China Seed Industry,2004(5) : 12-14.(in Chinese)
[3]张翔,邓其骥,楼洁琼,李春杰.兰州大学草坪与绿地植物病虫害调查与养护技术.草业科学,2005,22(8) : 62-66.Zhang X,Deng Q J,Lou J Q,Li C J.Investgation and protective techniques for turf and virescene plants'disease and insect harm in Lanzhou University.Pratacultural Science,2005,22(8) : 62-66.(in Chinese)
[4]李春杰,南志标.引种草坪草的适应性评价及病害和草害.草业科学,2003,20(4) : 68-72.Li C J,Nan Z B.Evaluation of adaptability,diseases and weeds of introduced turfgrass varieties.Pratacultural Science,2003,20(4) : 68-72.(in Chinese)
[5]何秋,刘建秀.草坪草真菌病害的研究进展.草业科学,2006,23(4) : 95-104.He Q,Liu J X.Advances in fungi diseases research on turfgrass.Pratacultural Science,2006,23(4) : 95-104.(in Chinese)
[6]Abd-Elsalam K A,Aly I N,Abdel-Satar M A,Khalil M S,Verreet J A.PCR identification of Fusarium genus based on nuclear ribosomal-DNA sequence data.African Journal of Biotechnology,2004,2(4) : 82-85.
[7]Schoch C L,Seifert K A,Huhndorf S,Robert V,Spouge J L,Levesque C A,Chen W.Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for fungi.Proceedings of the National Academy of Sciences,2012,109(16) : 6241-6246.
[8]Kelly L J,Hollingsworth P M,Coppins B J,Ellis C J,Harrold P,Tosh J,Yahr R.DNA barcoding of lichenized fungi demonstrates high identification success in a floristic context.New Phytologist,2011,191(1) : 288-300.
[9]Schoch C,Seifert K,Crous P.Progress on DNA barcoding of fungi.IMA Fungus,2011,2(1) : 5-9.
[10]陈剑山,郑服丛.ITS序列分析在真菌分类鉴定中的应用.安徽农业科学.2007,35(13) : 3785-3786,3792.Chen J S,Zheng F C.Application of ITS sequences in fungi classification and identification.Journal of Anhui Agricultural Sciences,2007,35(13) : 3785-3786,3792.(in Chinese)
[11]李春杰,南志标.苜蓿种带真菌及其致病性测定.草业学报,2000,9(1) : 27-36.Li C J,Nan Z B.Seed-borne fungi of lucerne and their pathogenicity to lucerne seed and seedling.Acta Prataculturae Sinica,2000,9(1) : 27-36.(in Chinese)
[12]魏景超.真菌鉴定手册.上海:上海科学技术出版社,1979.Wei J C.Fungal Identification Manual.Shanghai: Shanghai Scientific&Technical Publishers,1979.(in Chinese)
[13]White T J,Bruns T,Lee S,Taylor J W.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics.PCR protocols: a guide to methods and applications,1990,18: 315-322.
[14]Hall T A.BioEdit: A user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT.Oxford: Nucleic Acids Symposium Series,1999,41: 95-98.
[15]Larkin M A,Blackshields G,Brown N P,Chenna R.Clustal W and Clustal X version 2.0.Bioinformatics,2007,23(21) : 2947-2948.
[16]Rossman A.Report of the planning workshop for all fungi DNA barcoding.Inoculum,2007,58(6) : 1-5.
[17]Seifert K A.Progress towards DNA barcoding of fungi.Molecular Ecology Resources,2009,9(s1) : 83-89.
[18]李永,岳志强,朴春根,林彩丽,方鹏飞,郭民伟,王曦茁,林乐民.链格孢属真菌的分子复核鉴定及系统发育研究.中国农学通报,2013,29(27) : 165-169.Li Y,Yue Z Q,Piao C G,Lin C L,Fang P F,Guo M W,Wang X Z,Lin LM.Molecular identification and phylogeny of genus Alternaria.Chinese Agricultural Science Bulletin,2013,29(27) : 165-169.(in Chinese)
[19]Pryor B M,Bigelow D M.Molecular characterization of Embellisia and Nimbya species and their relationship to Alternaria,Ulocladium and Stemphylium.Mycologia,2003,95(6) : 1141-1154.
[20]Wiewióra B,Prończuk M.Rhizoctonia solani and other fungi detected in perennial ryegrass seeds after harvest and storage.Phytopathologia Polonica,Poland,2002,26: 19-27.
[21]Weber Z,Urbański P.Fungi occurring on turfgrasses in Poznań.Phytopatologia,2009,51: 7-12.
[22]Wiewióra B.Relationship between seedborne fungi of red fescue (Festuca rubra) and seed germination capacity.Phytopathologia,2011,60: 47-56.
[23]龚月娟,李建强.五种牧草及三种草坪草种子寄藏真菌检测初探.草业学报,2004,13(5) : 116-120.Gong Y J,Li J Q.Preliminary study on detection of seed-borne fungi in five forage varieties and three turfgrass varieties.Acta Prataculturae Sinica,2004,13(5) : 116-120.(in Chinese)
[24]孔瑞芳.苏丹草(Sorghum sudanense)种带真菌及其防治.兰州:兰州大学硕士学位论文,2009.Kong R F.Seed-borne fungi of sudangrass(Sorghum sudanense) and their control.Master Thesis.Lanzhou: Lanzhou University,2009.(in Chinese)
[25]张裕君,刘跃庭,廖芳,郭京泽.DNA条形码技术研究进展及其在植物检疫中的应用展望.中国植保导刊,2010,30(4) : 15-17.Zhang Y J,Liu Y T,Liao F,Guo J Z.Research progress of DNA barcode technology and prospect of its application in plant quarantine.China Plant Protection,2010,30(4) : 15-17.(in Chinese)
(责任编辑 王芳)
Detection and identification of seed-borne fungi isolated from imported grass seeds
Lei Ya-hong1,Kuang Wei-gang2,Zheng Chun-sheng3,Wang Wan-chun3,Li Chun-jie1,Gao Wen-na3
(1.Key Laboratory of Grassland Agro-ecosystems,College of Pastoral Agriculture Science and Technology,Lanzhou University,Lanzhou 730020,China; 2.Department of Plant Pathology/Key Laboratory of Plant Pathology,China Agricultural University,Beijing 100193,China; 3.Beijing Entry-Exit Inspection and Quarantine Bureau,Beijing 101312,China)
The 7 grass seed samples imported from 5 countries were analyzed for seed-borne fungi by Petri-dish testing.The samples included perennial ryegrass (Lolium perenne),tall fescue (Festuca arundinacea) and sudan grass (Sorghum sudanense) in 2014.The ITS (Internal transcribed spacer) segment was amplified using ITS4 and ITS5 as primers,then purified and sequenced.The ITS sequences obtained were blasted with known ITS sequences in database.The results showed that 48 fungal strains belonged to 21 species of 13 genera were isolated,and the seed-borne fungal species of seed samples were significantly different from each other.The fungal species were mainly Fusarium spp.Aspergillus spp.,Phoma spp.,and Alternaria spp..According to the ITS phylogenetic tree,all fungi could be identified to genus,which were hard to species.Alternaria tenuissima,A.alternata,and A.arborescens couldn’t be separated.The study analyzed seed-borne fungi of imported grass seeds from 5 countries,and the ITS sequences were applied for seed-borne fungi of imported grass seeds preliminary detection and identification.
imported grass seeds; seed-borne fungi; ITS; identification
Li Chun-jie E-mail: chunjie@ lzu.edu.cn; Gao Wen-na E-mail: gaown@ bjciq.gov.cn
S432.4+4
A
1001-0629(2016) 1-0046-08*
10.11829/j.issn.1001-0629.2015-0146
雷娅红,况卫刚,郑春生,汪万春,李春杰,高文娜.进境草种种带真菌的检测与初步鉴定.草业科学,2016,33(1) : 46-53.
Lei Y H,Kuang W G,Zheng C S,Wang W C,Li C J,Gao W N.Detection and identification of seed-borne fungi isolated from imported grass seeds.Pratacultural Science,2016,33(1) : 46-53.
2015-03-13 接受日期: 2015-07-08
国家质量监督检验检疫总局科技计划项目——进境牧草种子真菌筛查技术研究初探(2015IK225) ;国家质量监督检验检疫总局科技计划项目“进境种子携带植物病原细菌筛查技术初探”(2014IK005) ;国家质量监督检验检疫总局公益性课题——应用SiRNA测序技术筛查重要检疫性植物病毒方法研究(201310068) ;进境牧草种子有害生物风险评估(2015BK024)
雷娅红(1991-),女,甘肃定西人,在读硕士生,主要从事禾草内生真菌研究。E-mail: leiyh14@163.com
李春杰(1968-),男,甘肃镇原人,教授,博士,主要从事禾草内生真菌研究。E-mail: chunjie@ lzu.edu.cn;高文娜(1978-),女,北京人,高级农艺师,博士,主要从事植物检疫工作。E-mail: gaown@ bjciq.gov.cn
