生物信息学分析人C型凝集素16 A的结构与功能
2016-05-06任晨霞麻丽霞曹文君
任晨霞,麻丽霞,郭 萍,郭 颖,曹文君
(长治医学院山西省高等学校血脂代谢与血液病重点实验室,山西 长治 046000)
生物信息学分析人C型凝集素16 A的结构与功能
任晨霞,麻丽霞,郭萍,郭颖,曹文君*
(长治医学院山西省高等学校血脂代谢与血液病重点实验室,山西 长治 046000)
摘要:C型凝集素16 A基因(C-type lectin domain family 16A, Clec16a)是糖尿病、多发性硬化病等自身免疫性疾病的易感基因,但针对该基因功能的研究报道很少.通过生物信息学相关数据库和在线软件对CLEC16A蛋白分子的理化性质,亚细胞定位,跨膜区和信号肽,二级结构,结构域,磷酸化、泛素化、糖基化等蛋白翻译后修饰,以及蛋白相互作用网络等进行分析.结果表明,人Clec16a基因的共识编码序列为1053个氨基酸组成的多肽,是酸性不稳定的亲水蛋白,无跨膜区和信号肽,定位于多个亚细胞结构,其主要二级结构元件为α螺旋和随机卷曲,无已知的功能性结构域,存在磷酸化、泛素化、糖基化修饰位点.为深入研究CLEC16A功能及其参与的疾病分子机制提供一定的参考.
关键词:C型凝集素16A;生物信息学;结构;功能
C型凝集素(C-type lectin)是依赖于钙离子识别碳水化合物配体的蛋白家族,参与质膜糖蛋白的更新、细胞间粘附及天然免疫的抗原识别等功能[1].C型凝集素域家族16的成员A(C-type lectin domain family 16, member A, Clec16a)基因内含子的单核苷酸多态性与糖尿病[2]、多发性硬化病[3,4]、肾上腺功能障碍[5]、自身免疫性甲状腺疾病[6]和类风湿性关节炎[7]等疾病密切相关.虽然已知Clec16a是上述疾病的易感基因,其在B-淋巴细胞、自然杀伤细胞和树突细胞中高表达[4],但其在哺乳动物细胞中的功能尚未明确阐述.
目前,研究的比较清楚的是CLEC16A调控糖尿病线粒体自噬过程[8]以及调控白细胞抗原II(Human leukocyte antigen class II, HLA-II))信号通路[9]的功能.CLEC16A参与自噬体与溶酶体的融合过程,CLEC16A可以稳定线粒体自噬关键调控蛋白NRDP1(Neuregulin receptor degradation protein 1),防止其被蛋白酶体降解.含有Clec16a致糖尿病SNPs位点病人的胰岛细胞中,Clec16a表达量下降,分泌的胰岛素减少,敲除小鼠胰岛的Clec16a基因会引起线粒体中耗氧量和ATP浓度的降低.胰腺十二指肠同源框蛋白PDX1(Pancreatic and duodenal homeobox 1)作为转录因子调控胰腺细胞CLEC16A的表达量促进线粒体自噬的功能[10].HLA-II在内质网合成后,被运输到后期内涵体中,后期内涵体转移至核周区域成熟并被酸化激活蛋白水解酶,后者为HLA-II加载抗原呈递所必需的多肽,HLA-II才能被正确定位于细胞膜上发挥作用.RNA干扰CLEC16A的表达后,后期内涵体无法正常成熟,导致HLA-II在胞浆中积累和在细胞膜上的减少.这与果蝇的CLEC16A同源蛋白Ema参与内涵体成熟的功能是一致的[11].Clec16a基因突变的致病机理以及CLEC16A蛋白参与的具体信号通路仍是未知的.
总之,深入研究Clec16a的功能,为了解糖尿病等自身免疫疾病的发病机制提供重要的线索,也为其作为新的治疗靶点提供依据.本文采用生物信息学方法预测与分析CLEC16A蛋白的结构与功能,为进一步实验研究该蛋白的分子功能提供一定的参考.
1材料和方法
1.1材料
CLEC16A的氨基酸序列来源于NCBI的GenBank数据库和Uniprot数据库.
1.2方法
采用Expasy数据库(Expert Protein Analysis System)的ProtParam Tool分析工具,对CLEC16A蛋白进行理化性质分析, PrortScale Tool分析工具对CLEC16A蛋白进行亲水性分析;采用SPORTⅡ软件预测CLEC16A的亚细胞定位;分别采用SignalP 4.0 和TMHMM 2.0软件分析预测CLEC16A的信号肽和跨膜区域; SOPMA工具分析CLEC16A的二级结构,通过NCBI的Conserved Domain数据库分析CLEC16A的结构域;分别通过 NetPhosK 1.0和 PhosphoSitePlus分析CLEC16A的翻译后修饰情况;通过STRING数据库,构建CLEC16A蛋白的相互作用网络.
2结果
2.1CLEC16A的理化性质分析
Clec16a基因含有24个外显子,编码产物NP_056041.1为该基因的蛋白质共识编码序列,含有1053个氨基酸.通过蛋白质在线分析工具ExPASy中的ProtParam分析得到凝集素16A蛋白分子式为C5200H8243N1419O1600S46,分子量为117714.9 Da,亮氨酸,丝氨酸和谷氨酸含量较丰富,分别占11.2 %,9.3 %和7.0 %.CLEC16A分子的理论等电点为5.54,属酸性蛋白.在哺乳动物网织红细胞内的半衰期是30 h,不稳定系数为 56.14,大于40分类为不稳定蛋白质.脂肪系数为89.44,总的平均亲水性为-0.263,ExPASy中的PrortScale预测CLEC16A亲水性最强的位点是第245位的精氨酸,分值为-3.389;疏水性最强的位点是502和503位的亮氨酸和半胱氨酸,分值都是2.800.CLEC16A的整个氨基酸序列中亲水区域多于疏水区域(图1),因此属于亲水蛋白.
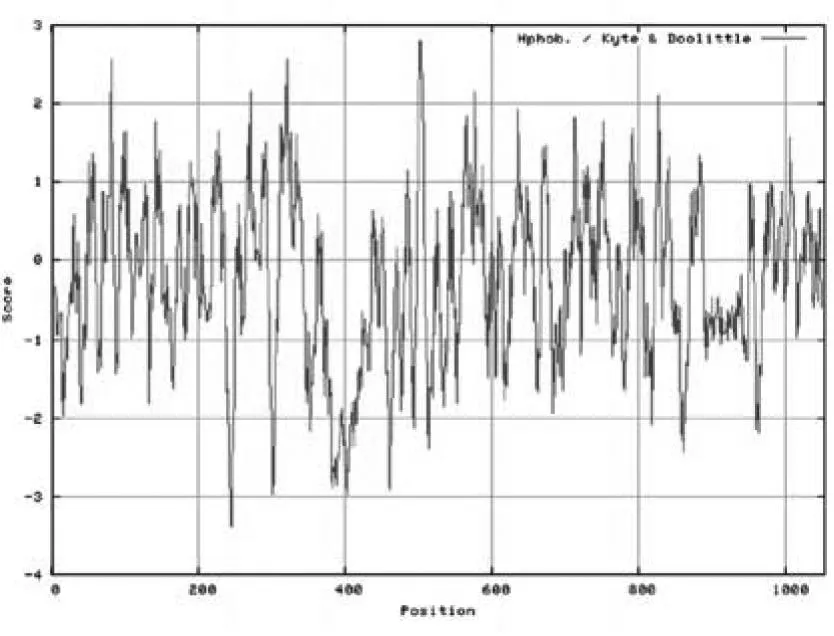
图1 CLEC16A的亲/疏水性分析
2.2CLEC16A的亚细胞定位、跨膜结构域与信号肽分析
PSORT通过蛋白的N端定位信号序列、氨基酸组成和排列顺序以及含有的蛋白结构模体等综合判断预测,CLEC16A有34.8 %的可能性定位于细胞核,定位于线粒体、高尔基体、细胞浆、分泌系统囊泡、细胞骨架和细胞外的可能性分别为21.7 %、13.0 %、8.7 %、8.7 %、4.3 %、4.3 %和4.3 %,说明该蛋白存在于细胞核和线粒体的可能性比较大,也可能在细胞的各个亚细胞结构中是动态存在的.
使用在线工具 TMHMM Server v. 2.0 预测分析如图 2所示,CLEC16A不存在跨膜结构域.通过 SignalP 4.1 在线工具对CLEC16A的信号肽进行分析,结果如图 3 所示.原始剪切位点C 值最大切割点在第62位氨基酸,分值为 0.112;被结合的剪切点Y 值最高在第22位氨基酸,为 0.114;信号肽分值最大在第 13个氨基酸位置,分值为 0.153.综合推断CLEC16A无信号肽区域(图3).
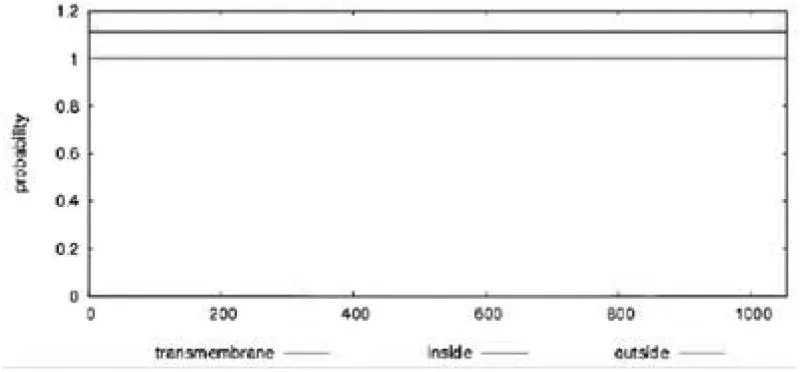
图2 CLEC16A跨膜结构域分析
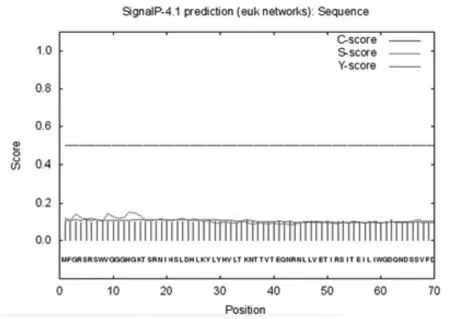
图 3 CLEC16A的信号肽分析
2.3CLEC16A的二级结构与结构域分析
用在线软件SOPMA对CLEC16A的二级结构分析,其结构中α螺旋结构占37.23 %,无规卷曲占36.66 %,延伸链占18.71 %,β转角占7.41%(图4);α螺旋和无规卷曲是主要二级结构.
NCBI的Conserved Domain数据库预测CLEC16A的保守结构域,结果见图5.CLEC16A属于PFL蛋白超家族,在N端含有大约150个氨基酸残基的保守序列,是功能未知的保守蛋白质家族.
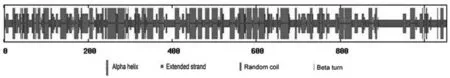
图4 CLEC16A的二级结构预测

图5 CLEC16A功能结构域分析
2.4CLEC16A转录后修饰分析
分别采用 NetPhosK 1. 0 和 PhosphoSitePlus 分析CLEC16A蛋白的磷酸化修饰位点,两种方法同时预测的位点有: Ser7、Ser863、Ser982.泛素化修饰位点为第445位的赖氨酸.NetNGlyc 1.0在线预测到第36、64、107、155、459、771、956位天冬酰胺可被糖基化修饰(图6).
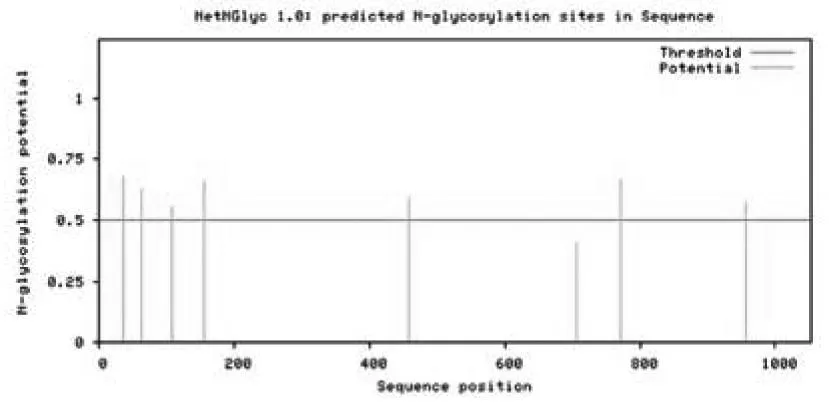
图6 CLEC16A糖基化位点分析
2.5CLEC16A蛋白质相互作用分析
利用 STRING数据库搜索CLEC16A的相互作用蛋白,所构建相互作用网络如图7,成分主要有白介素2受体(interleukin 2 receptor alpha, IL2RA)、泛素蛋白C(ubiquitin C, UBC)、蛋白质酪氨酸磷酸酶22(protein tyrosine phosphatase, PTPN22)、类苏氨酸合酶2(threonine synthase-like 2, THNSL2)和表皮生长因子样结构域特定的O-GlcNAc糖基转移酶(EGF domain-specific O-linked N-acetylglucosamine (GlcNAc) transferase, EOGT).
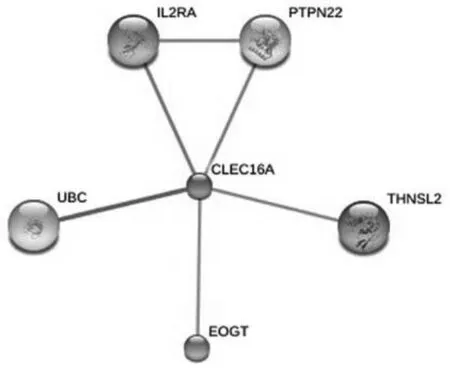
图7 CLEC16A蛋白相互作用网络
3讨论
最先开始对Clec16a研究是全基因组测序发现Clec16a的单核苷酸多态性与糖尿病和多发性硬化病密切相关[12,13],随后开启了对该基因的研究.到目前为止,大部分研究聚焦于CLEC16A突变与疾病的相关性上,但该分子仍被归类于功能未知的基因.CLEC16A属于C型凝集素蛋白家族成员,典型的C型凝集素结含长约120个氨基酸的糖类识别功能结构域(Carbohydrate recognition domain,CRD).本文通过蛋白结构分析发现,不同物种的CLEC16A含有进化保守的N端序列,预测属于功能未知的PFL结构域,但是并无可识别CRD结构域序列,说明Clec16a基因的名字是有争议的,并不是经典的C型凝集素蛋白,可能具有更多新的功能.Clec16a基因致病作用最强的SNPs出现在非编码区[14],其中的具体机制仍是未知的.
磷酸化和糖基化修饰是蛋白质功能调节的主要途径,本文预测到CLEC16A存在多个磷酸化位点和糖基化位点并预测到CLEC16A与磷酸酶PTPN22和糖基转移酶EOGT相互作用,这些分子调控方式及其具体作用需要进一步验证和探索.此外,泛素化修饰可介导蛋白质特异性降解,影响蛋白质的细胞定位和活性.本文分析发现CLEC16A蛋白存在多个潜在的泛素化位点,相互作用网络中含有泛素蛋白C,提示CLEC16A通过泛素化修饰调节其活性形式和蛋白量.
CLEC16A蛋白质相互作用网络成员包括白介素2受体IL2RA,IL-2对T细胞免疫记忆和机体对自体与非自体物质的识别中起重要作用,在多发性硬化病的T细胞免疫中起重要作用.IL2RA与CLEC16A都是多发性硬化病的易感基因[15,16], IL2RA单克隆抗体赛尼哌(Daclizumab)可明显减轻多发性硬化病的症状[17],预示针对CLEC16A的新治疗手段值得我们开发.
此外,高等动物和低等动物,动物和植物中均含有CLEC16A同源蛋白,说明该分子在进化过程中高度保守,参与的生化过程也应是真核生物所共有的保守过程.Soleimanpour等人研究证实,CLEC16A参与调控线粒体自噬过程,该过程正是一个真核细胞共有的保守功能[8].
总之,本研究为今后更进一步揭示CLEC16A的功能与其作为治疗靶点提供一定的理论依据.
参考文献:
[1]Davison L J, Wallace C,Cooper J D, et al. Long-range DNA looping and gene expression analyses identify DEXI as an autoimmune disease candidate gene[J]. Hum Mol Genet,2012,(2):322-333.
[2]Sang Y,Zong W, Yan J,et al. The correlation between the CLEC16A gene and genetic susceptibility to type 1 diabetes in Chinese children[J]. Int J Endocrinol,2012,(4):245384.
[3]Zoledziewska M, Costa G, Pitzalis M,et al. Variation within the CLEC16A gene shows consistent disease association with both multiple sclerosis and type 1 diabetes in Sardinia[J]. Genes Immun,2009,(1):15-17.
[4]International Multiple Sclerosis Genetics Consortium (IMSGC),Beecham A H,Patsopoulos N A,et al. Analysis of immune-related loci identifies 48 new susceptibility variants for multiple sclerosis[J]. Nat Genet,2013,(11):1353-1360.
[5]Skinningsrud B,Husebye E S,Pearce S H,et al. Polymorphisms in CLEC16A and CIITA at 16p13 are associated with primary adrenal insufficiency[J]. J Clin Endocrinol Metab,2008,(9):3310-3317.
[6]Muhali F S,Cai T T,Zhu J L,et al. Polymorphisms of CLEC16A region and autoimmune thyroid diseases[J]. Genes Genomes Genetics,2014,(6):973-977.
[7]Skinningsrud B,Lie B A,Husebye E S,et al. A CLEC16A variant confers risk for juvenile idiopathic arthritis and anti-cyclic citrullinated peptide antibody negative rheumatoid arthritis[J]. Ann Rheum Dis,2010,(8):1471-1474.
[8]Soleimanpour S A,Gupta A, Bakay M,et al. The diabetes susceptibility gene Clec16a regulates mitophagy[J]. Cell,2014,(7):1577-1590.
[9]van Luijn M M,Kreft K L,Jongsma M L,et al. Multiple sclerosis-associated CLEC16A controls HLA class II expression via late endosome biogenesis[J]. Brain,2015,(6):1531-1547.
[10]Soleimanpour S A,Ferrari A M,Raum J C,et al. Diabetes Susceptibility Genes Pdx1 and Clec16a Function in a Pathway Regulating Mitophagy in β-Cells[J]. Diabetes,2015,(10):3475-3484.
[11]Kim S,Wairkar Y P,Daniels R W,et al. The novel endosomal membrane protein Ema interacts with the class C Vps-HOPS complex to promote endosomal maturation[J]. J Cell Biol,2010,(5):717-734.
[12]Hakonarson H,Grant S F,Bradfield J P,et al. A genome-wide association study identifies KIAA0350 as a type 1 diabetes gene[J].Nature,2007,(7153): 591-594.
[13]International Multiple Sclerosis Genetics Consortium (IMSGC). Risk alleles for multiple sclerosis identified by a genomewide study[J]. N Engl J Med,2007,(9): 851-862.
[14]Mero I L,Ban M,Lorentzen R,et al. Exploring the CLEC16A gene reveals a MS-associated variant with correlation to the relative expression of CLEC16A isoforms in thymus[J]. Genes Immun,2011,(3):191-198.
[15]Hartmann F J,Khademi M,Aram J,et al. Multiple sclerosis-associated IL2RA polymorphism controls GM-CSF production in human TH cells[J]. Nat Commun,2014,(5):5056.
[16]Traboulsee A L,Bernales C Q,Ross J P,et al. Genetic variants in IL2RA and IL7R affect multiple sclerosis disease risk and progression[J]. Neurogenetics,2014,(3):165-169.
[17]Wiendl H,Gross C C. Modulation of IL-2Rα with daclizumab for treatment of multiple sclerosis[J].Nat Rev Neurol,2013,(7):394-404.
(责任编校:晴川)
Bioinformatic Analysis of C-type Lectin Domain Family 16A REN Chenxia, MA Lixia, GUO Ping, GUO Ying, CAO Wenjun*
(Key Laboratory of Lipid Metabolism and Haematology, Changzhi Medical College,
Changzhi Shanxi 046000, China)
Abstract:C-type lectin domain family 16 A is a susceptibility gene of autoimmune diseases such as diabetes and multiple sclerosis; however, its genetic function is rarely reported. In this article, we analyzed physical and chemical properties, the subcellular localization, transmembrane region and signal peptide, secondary structure, the conserved domains, protein modification after translation, and protein-protein interaction networks of CLEC16A through bioinformatics. Results showed that the consensus coding sequence of clec16a gene was a 1053 amino acids peptide. The hydrophilic protein was not stable, without transmembrane area and signal peptide, and located in multiple cellular structure. The main secondary structure elements were alpha helix and random curl, without known functional domains. Phosphorylation, ubiquitin, glycosylation modification sites existed. It provided certain reference for further research on molecular mechanism and functions of CLEC16A participating in diseases.
Key Words:C-type lectin domain family 16 A; bioinformatics; structure; function
中图分类号:Q71
文献标识码:A
文章编号:1008-4681(2016)02-0013-04
*通讯作者
作者简介:任晨霞(1987— ),女,山西长治人,长治医学院山西省高等学校血脂代谢与血液病重点实验室助教,硕士.研究方向:生物化学与分子生物学.
基金项目:长治医学院科技创新团队项目(批准号:CX201507);长治医学院普及项目(批准号:QDZ201503).
收稿日期:2016-03-04
