油橄榄加工废液对小麦和玉米种子萌发及相关酶活性的影响
2016-05-06白万明苏玲玲郭晓敏孔维宝
刘 娜,白万明,苏玲玲,郭晓敏,孔维宝,3
( 1 西北师范大学 生命科学学院,兰州 730070;2 陇南田园油橄榄科技开发有限公司,甘肃陇南 746000;3 甘肃特色植物有效成分制品工程技术研究中心,兰州 730070)
油橄榄加工废液对小麦和玉米种子萌发及相关酶活性的影响
刘娜1,白万明2,苏玲玲1,郭晓敏1,孔维宝1,3
( 1 西北师范大学 生命科学学院,兰州 730070;2 陇南田园油橄榄科技开发有限公司,甘肃陇南 746000;3 甘肃特色植物有效成分制品工程技术研究中心,兰州 730070)
摘要:用不同稀释倍数的油橄榄加工废液(OMWS)处理小麦和玉米种子,采用计数法、测量法和比色法测定了发芽率、根长和相关生化参数,以探索OMWS对种子萌发特性及相关酶活性的影响。结果表明:不同稀释倍数的OMWS对小麦和玉米种子的发芽率、发芽势和生长存在不同程度的影响;低稀释倍数(高浓度)的OMWS(原液和5倍稀释液)在抑制种子发芽的同时,对叶芽和根的生长存在延缓甚至毒害作用;随着稀释倍数的提高(浓度降低),这种抑制作用逐渐减弱,而高稀释倍数(30和50倍稀释液)处理则表现出一定程度的促生作用,这种影响存在浓度依赖性。OMWS处理同样可导致种子可溶性蛋白质含量以及过氧化氢酶(CAT)、过氧化物酶(POD)和苯丙氨酸解氨酶(PAL)活性的变化,呈现高浓度抑制和低浓度诱导增强的趋势;OMWS处理后小麦和玉米根的生长与POD和PAL活性存在明显正相关性。研究认为,OMWS对小麦和玉米种子的发芽及生长存在高浓度抑制和低浓度诱导的双重作用,并可能以多酚的影响为主;鉴于OMWS中多酚及其氧化产物可能产生的高浓度抑制、植物毒性和低浓度诱导化感作用,其在用做有机肥料或土壤改良剂时应做适当稀释处理。
关键词:油橄榄加工废液;小麦;玉米;种子;发芽力;酶活性
油橄榄(OleaeuropaeaL.)是世界著名的木本油料树种,其成熟果实经物理压榨分离后可制取橄榄油,橄榄油富含不饱和脂肪酸、酚类物质和脂溶性维生素等多种活性成分,是广受世界人民青睐的高级食用植物油[1]。目前,在橄榄油加工过程中,油橄榄鲜果经磨浆、离心分离、生产初榨橄榄油后产生大量的油橄榄加工废弃物(OMW),其中含有可观的果渣油、橄榄多酚和萜类化合物等多种生物活性物质。这一具有经济价值的加工副产物在国内未能得到深入研究和有效利用,造成了极大的资源浪费和环境污染[2]。随着中国油橄榄产业的不断发展,油橄榄种植面积、鲜果产量和国产橄榄油产量逐年增长,加之油橄榄果实加工的时间段相对集中,产生的OMW产量也随之增加。对于国内油橄榄加工企业来说,如何在生产橄榄油的同时开发利用好OMW废弃资源,是企业实现经济和环境双重效益亟待考虑并解决的重要问题[3-4]。
OMW中含有大量的植物营养素,其最简单的利用方式是经预处理(脱油脂、过滤、自然发酵或堆肥)之后直接还田用做有机肥料。但是因OMW中含有高浓度的多酚及其氧化产物,使其对土壤生物和植物有一定的植物毒性。Piotrowska等[5]研究发现,施用OMW对土壤的短期影响主要表现为土壤物理、化学和生化特性的改变,例如微生物生物量、基础呼吸、可溶性C和N、土壤水解酶和氧化还原酶活性的变化;同时,由于OMW存在的植物毒性使西红柿种子的发芽能力大大降低。Altieri等[6]以不同浓度(0,25%,50%,75%)的OMW作为泥碳替代物,评价其作为草莓无土栽培生长基质的可行性,结果表明虽然高浓度的OMW添加量(75%)可造成培养早期对草莓轻微的植物毒性,但是产量数据和组织分析结果显示OMW可替代泥炭作为一种有效、廉价的无土栽培营养基质。为了实现OMW的有效脱毒,Annibale等[7]用香菇(Lentinulaedodes)处理OMW评价真菌的脱毒效果,硬质小麦的发芽能力实验结果表明,用香菇处理后OMW的植物毒性显著降低;用未稀释和稀释2倍的经香菇真菌脱毒处理后的OMW进行小麦发芽实验,其发芽率分别为34%和57%,而未经真菌处理对照组的发芽几乎完全被抑制。这说明,OMW作为有机肥使用时,须慎重考虑其对土壤生物、植物种子和植物体存在的毒性问题。本试验以小麦和玉米种子为供试植物材料,研究国产油橄榄三相分离废弃物之一——油橄榄加工废液(OMWS)对种子萌发特性及其相关抗氧化酶活性的影响,以期为认识OMWS对种子萌发特性的影响及其农业还田循环利用提供实验依据和应用参考。
1材料和方法
1.1实验材料
1.1.1材料与试剂小麦和玉米种子分别为市售‘陇春25号’和‘豫玉22号’种子。油橄榄加工废液(OMWS)由陇南田园油橄榄科技开发有限公司提供,废液置于密封塑料桶中在4 ℃下存放。实验用水为蒸馏水,HgCl2、磷酸盐、Tris碱、HCl、H2O2、愈创木酚、邻苯二酚、考马斯亮蓝-G250、L-苯丙氨酸等所有试剂均为分析纯,牛血清蛋白为生化试剂。
1.1.2仪器设备主要包括培养皿、BS210S型分析天平(北京赛多利斯)、Labtech UV-8100紫外可见分光光度计(北京莱伯泰科)、CT15RT型台式高速冷冻离心机(上海天美)、奥立龙MODEL868型pH计(美国热电)、GZP-250S光照恒温培养箱(上海精宏)和恒温水浴锅(江苏金坛)。
1.2材料培养与处理
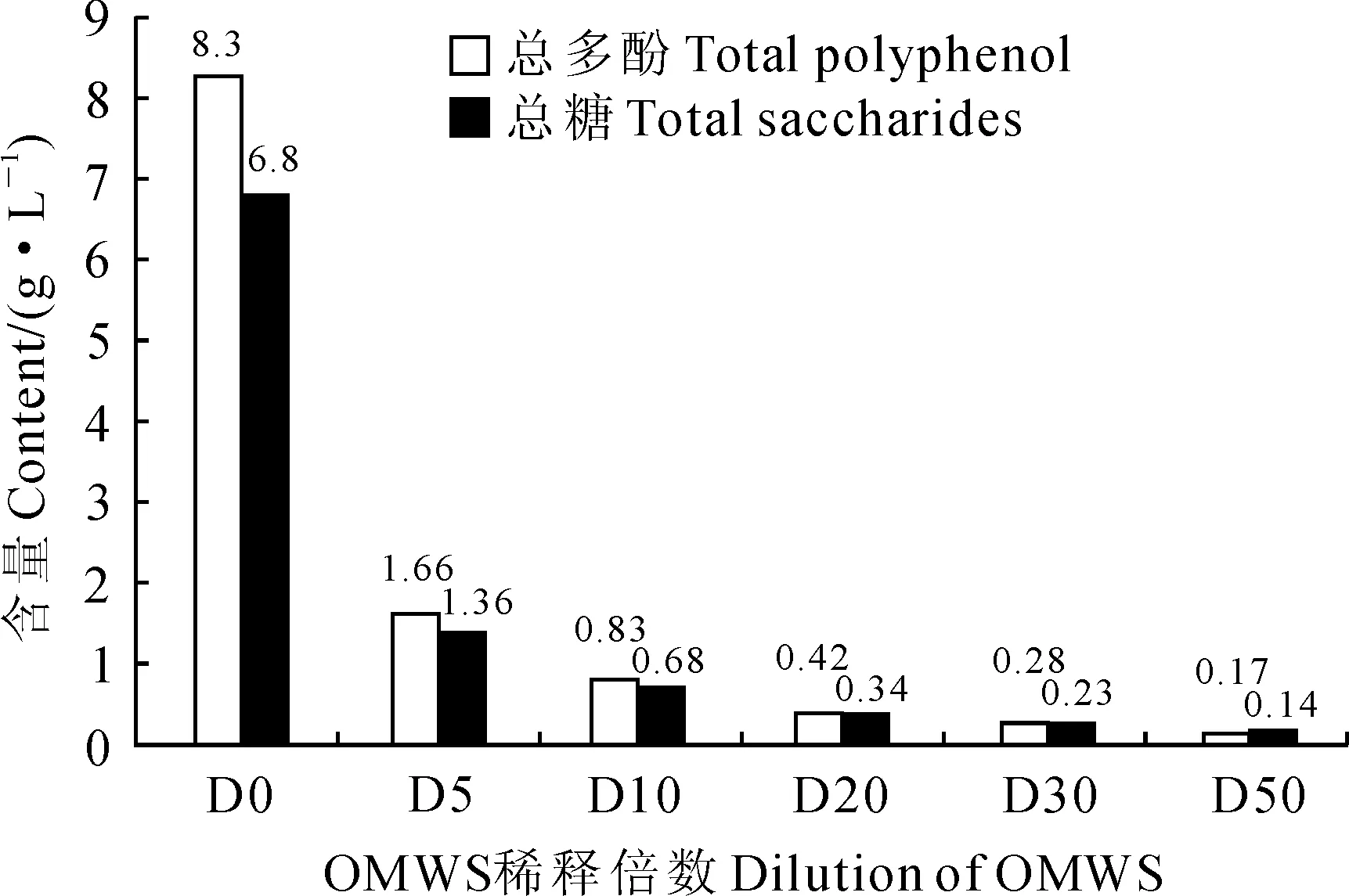
1.2.1油橄榄加工废液(OMWS)浸种液的制备量取一定量OMWS,以5 000 g离心15 min,取上清液作为浸种原液,取适量浸种原液将其用无菌蒸馏水分别稀释成不同浓度的OMWS,共设计原液(不稀释)以及稀释5、10、20、30、50倍6个处理液水平,处理液2 ℃低温封存待用。测得OMWS浸种原液中总多酚和总糖含量分别为8.3和6.8 g·L-1,在不同稀释倍数下处理液中的总多酚和总糖含量详见图1所示。
1.2.2种子的处理与培养分别将小麦和玉米种子分选清洗后先用0.1%的HgCl2溶液浸泡15 min消毒,再用蒸馏水反复冲洗3次,接着在20 ℃水浴锅中用蒸馏水浸种吸水(小麦浸种12 h、玉米浸种24 h,中间换水间歇1次),然后随机取种子置于铺有2层滤纸的培养皿中(小麦种子每皿50粒,玉米种子每皿20粒),分别用适量不同稀释度的OMWS喷施,以蒸馏水作对照,在无光照、(18±2) ℃温度下进行发芽实验,每个处理设置3个平行组,每隔12 h喷4 mL OMWS处理液或蒸馏水(对照组)。每天观察发芽及生根情况并做好记录和计数,发芽生长10 d后结束培养。
1.2.3粗酶液的提取发芽结束时取小麦和玉米幼苗,用蒸馏水反复冲洗干净,再用滤纸吸干表面水分。将称重后的样品放入预冷的研钵中,加入约20倍(mL)预冷至4 ℃的提取液(pH 7.0,50 mmol·L-1磷酸缓冲液)和适量石英砂,充分研磨匀浆后将匀浆液移入50 mL离心管中,再用预冷的相同缓冲液洗涤完全研钵中的匀浆液,并一同移入离心管中,总提取液体积控制在40 mL左右,在4 ℃振荡浸提30 min后以5 000 g离心20 min,取上清液用缓冲液定容至50 mL,适当稀释后做为测定蛋白质和酶活力的试样。
1.3测定指标及方法
1.3.1种子萌发指标种子培养期间每天统计种子萌发的粒数,萌发以胚芽突破种皮为标准。发芽率以每皿发芽种子数占总种子总数的百分比计。发芽势以发芽3 d时发芽种子数占供试种子数的百分比计。发芽10 d结束时,采用测量法测定发芽种子的根长(cm)。
D0为原液,D5~D50分别表示原液稀释5、10、20、30、50倍;下同
1.3.2蛋白质含量吸取上述粗酶液样品0.5 mL,加蒸馏水0.5 mL,加5 mL考马斯亮兰染液,充分混合均匀,放置2~5 min后,以加1 mL水和5 mL染液试管作为空白对照,用1 cm光程比色杯在595 nm下测定光密度A595,计算蛋白质含量,单位表示为mg·g-1(鲜重)[8]。以不同浓度牛血清蛋白为标准溶液测定其相应光密度值A595,做出标准曲线,得到OMWS废液中蛋白质含量的计算公式:C=499.49A-1.031 7(R2=0.993 4)。式中,C为蛋白质含量(mg·L-1),A为595 nm下的吸光值。
1.3.3酶活性相关酶活力测定方法参照文献[8],并作适当改良。
(1)过氧化氢酶(CAT)活性准确吸取2.5 mL pH 7.0、50 mmol·L-1磷酸缓冲液和0.4 mL 0.1 mol·L-1H2O2,加入0.1 mL 粗酶液样品后迅速摇匀启动反应,每隔30 s记录1次240 nm处的吸光值A240,记录3 min,以每分钟A240下降0.1计为1个酶活力单位U,结果以U·g-1(鲜重)表示。
(2)过氧化物酶(POD)活性准确吸取2.5 mL pH 7.0 50 mmol·L-1磷酸缓冲液和0.4 mL 0.1 mol·L-1愈创木酚(含5 mmol·L-1H2O2),加入0.1 mL试样粗酶液迅速摇匀后启动反应,每隔30 s记录1次470 nm处的吸光值A470,记录3 min,以每分钟A470上升0.1计为1 U,结果以U·g-1(鲜重)表示。
(3)苯丙氨酸解氨酶(PAL)活性在试管中加入1.5 mL 0.1 mol·L-1pH 8.8 的Tris-HCl缓冲液,再加入1 mL 0.1 mol·L-1的L-苯丙氨酸底物,加入0.5 mL试样粗酶液,摇匀后在37 ℃水浴中反应1 h,反应结束后测定290 nm处的吸光值A290,以1 mL 0.1 mol·L-1的L-苯丙氨酸加2 mL 0.1 mol·L-1pH 8.8的Tris-HCl缓冲液的试管作为空白对照。以每小时A290上升0.01计为1个酶活力单位U,结果以U·g-1(鲜重)表示。
1.4数据分析
用Excel 2007软件对数据进行整理统计和绘图,用Origin Pro 8.0软件做显著性分析。
2结果与分析
2.1不同浓度OMWS处理对小麦和玉米种子发芽率与发芽势的影响
不同浓度OMWS处理对小麦种子的萌发有一定的影响。OMWS处理液在高浓度(如原液、D5)时对初期小麦种子的萌发有一定的抑制作用,而随着稀释倍数的增大,这种抑制作用随之减缓。小麦种子萌发期间用原液直接处理的种子,虽然在初期得以萌发,但后期因持续处理却使已萌发的种子大部分死亡,不能正常生长(图2,A中用虚线示意部分),而其他浓度处理组的小麦种子发芽率均达到了100%(图2,A)。另外,除OMWS原液处理组的小麦种子发芽势为83.3%之外,其他处理组均达到了100%(图2,C)。说明适当稀释后的OMWS对小麦种子的发芽影响较小,同时也表明实验用小麦种子的活力较强、发芽整齐度较高。
同时,不同浓度OMWS处理对玉米种子发芽的影响也较为显著,且OMWS的处理浓度越高(即稀释倍数越小),抑制玉米种子发芽和延迟萌发的作用越明显(图2,B)。其中,高浓度的OMWS处理玉米种子后,其萌发特性和小麦种子类似,起始萌发的种子经OMWS持续处理后部分死亡;而随着OMWS处理浓度的降低,玉米种子的发芽率逐渐升高,D50处理组的发芽率和发芽势与对照组基本持平。由图2,C可知,与小麦种子的发芽势表现不同,玉米种子发芽势在不同浓度处理组别之间存在较大差异,反映出不同浓度OMWS处理对其发芽存在的抑制作用,导致供试玉米种子发芽的整齐度差异较大。由图2也反映出小麦种子的萌发时间较短,在发芽第2天即完全萌发,而玉米种子萌发的持续时间较长,在发芽第5天发芽率趋于恒定。
2.2不同浓度OMWS处理对小麦和玉米幼苗叶芽生长及生根的影响
从发芽10 d时各浓度处理组的典型性幼苗表现来看,不同浓度OMWS处理对小麦和玉米种子叶芽生长和生根作用的影响显著(图3)。与对照组相比,小麦和玉米种子萌发后其叶芽和根的生长与OMWS的处理浓度存在很高的相关性,即OMWS稀释倍数越小、浓度越高,叶芽和根的长度越短,而且OMWS处理组的叶芽和根相比于对照组要粗壮一些。以上结果表明,OMWS处理对小麦和玉米的叶芽生长和生根有较大影响,较高浓度的OMWS在抑制和延缓种子萌发的同时,还抑制了叶芽和根的生长;而OMWS稀释度较高、浓度较低的处理组(如D30和D50),对小麦和玉米叶芽和根的生长具有一定的促进作用;这种抑制或促进作用存在明显的OMWS浓度依赖性。
进一步的根长调查结果显示,不同浓度OMWS处理对小麦和玉米种子发芽后的生根作用影响显著(图4);与对照组相比,各实验组测得平均根长均存在显著性差异(P<0.05)。OMWS原液持续处理最终导致已发芽小麦种子的死亡,因此未能进行取样测试。其中,小麦D5和D10处理组的根长分别显著小于对照组96.5%和55.4%,而小麦D20、D30和D50组的根长分别显著大于对照组71.5%、109.7%和172.2%;玉米原液组、D5、D10、D20和D30组的根长均显著小于对照组,降幅为98.3%~41.7%,只有D50组的根长显著大于对照组,增幅为16.7%。综上结果可知,OMWS对小麦、玉米种子的发芽特性和生根的影响作用存在显著的浓度依赖性,高浓度的OMWS在抑制种子发芽的同时也抑制根的生长,而使用较低浓度的OMWS处理(如D50)对种子的发芽影响较小,而且表现出一定的促进生长效果。
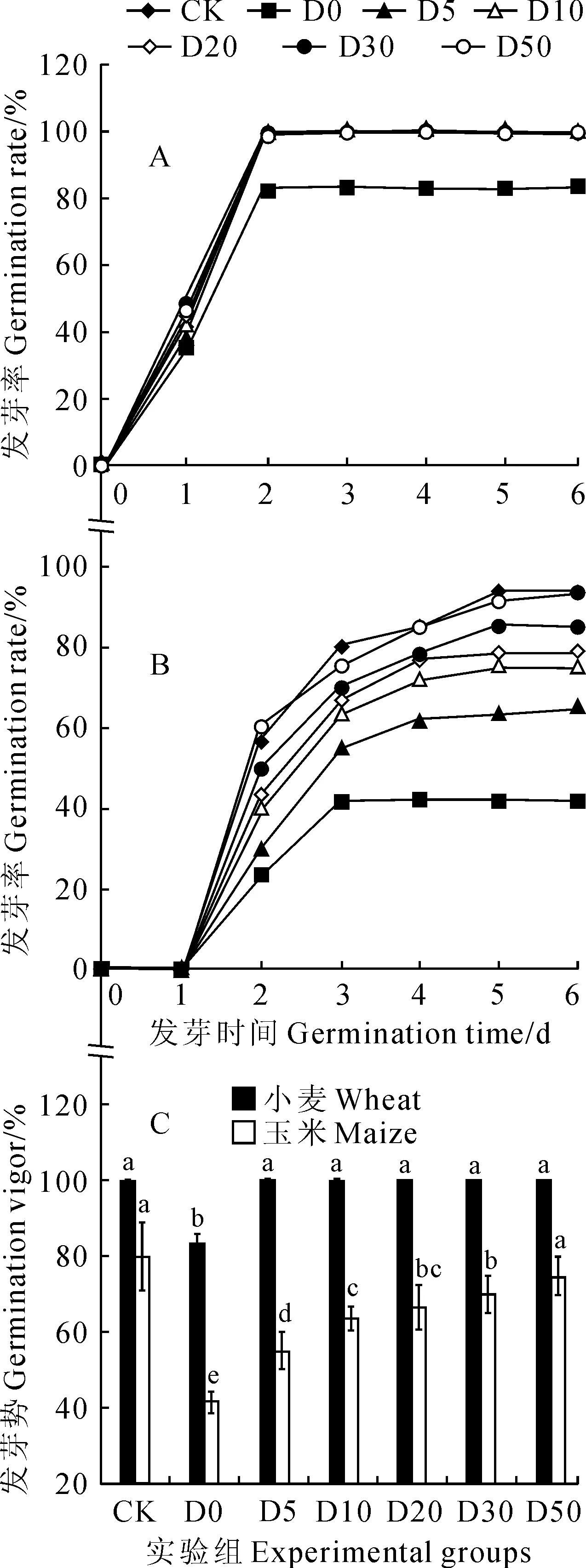
不同小写字母表示处理组间在0.05水平存在显著性差异;下同
2.3不同浓度OMWS处理对小麦和玉米全株幼苗可溶性蛋白质含量的影响
图5结果显示,不同浓度的OMWS处理对发芽结束时小麦和玉米全株幼苗可溶性蛋白质含量有不同程度的影响。其中,小麦幼苗可溶性蛋白质含量在高浓度OMWS处理组(原液组、D5和D10)与对照组存在显著性差异,原液组显著低于对照15.6%,D5和D10处理组分别显著高于对照16.6%和14.3%,而其余处理组与对照组不存在显著性差异;玉米幼苗可溶性蛋白质含量在原液、D5、D30、D50组处理下均显著低于对照,降幅为39.6%~8.4%,在D10处理下却显著高于对照8.5%,而在D20组处理下与对照的含量相当。以上结果说明不同浓度的OMWS处理时导致种子处于不同的发芽态势,导致其蛋白质分解程度的差异,进而导致全株幼苗可溶性蛋白质含量的差异。

图3 不同OMWS处理组中小麦和玉米

图4 不同浓度OMWS对小麦和
2.4不同浓度OMWS处理对小麦和玉米幼苗相关酶活性的影响
各实验组全株幼苗发芽结束时抗氧化和生根相关的酶活性如图6所示。首先,不同浓度OMWS处理对小麦和玉米幼苗过氧化氢酶(CAT)活性的影响显著(图6,A)。小麦和玉米幼苗的CAT活性在不同浓度OMWS处理下均显著低于对照组,降幅分别为90.5%~41.1%和88.5%~12.3%,而且随着OMWS处理浓度的降低总体呈现先升后降的变化趋势;在OMWS处理组中,两种作物幼苗CAT活性均以原液组呈现最低,而小麦幼苗CAT活性以D20和D30处理组的相对较高,玉米幼苗CAT活性则以D10组的相对较高。其次,小麦和玉米幼苗过氧化物酶(POD)活性均随着OMWS处理浓度的降低(即稀释倍数的增大)呈现逐渐上升的趋势;各OMWS处理中,小麦和玉米幼苗的POD活性在原液、D5和D10组均显著低于对照,小麦幼苗D20组和玉米幼苗的D20、D30处理组与对照无显著差异,小麦幼苗D30、D50处理组和玉米幼苗的D50处理组均显著高于对照组(图6,B)。此外,小麦和玉米幼苗苯丙氨酸解氨酶(PAL)活性在不同浓度OMWS处理下的变化趋势与POD活性类似,即随着OMWS处理浓度的降低均呈现逐渐上升的趋势;幼苗PAL活性均在D20浓度时与对照组相当,处理浓度低于D20时显著高于对照,处理浓度高于D20时显著低于对照(图6,C)。以上结果说明OMWS处理在影响小麦和玉米种子萌发的同时,也从生理生化水平上影响幼苗抗氧化酶及相关酶活性,而且其影响程度也随着OMWS处理浓度的高低而存在差异。
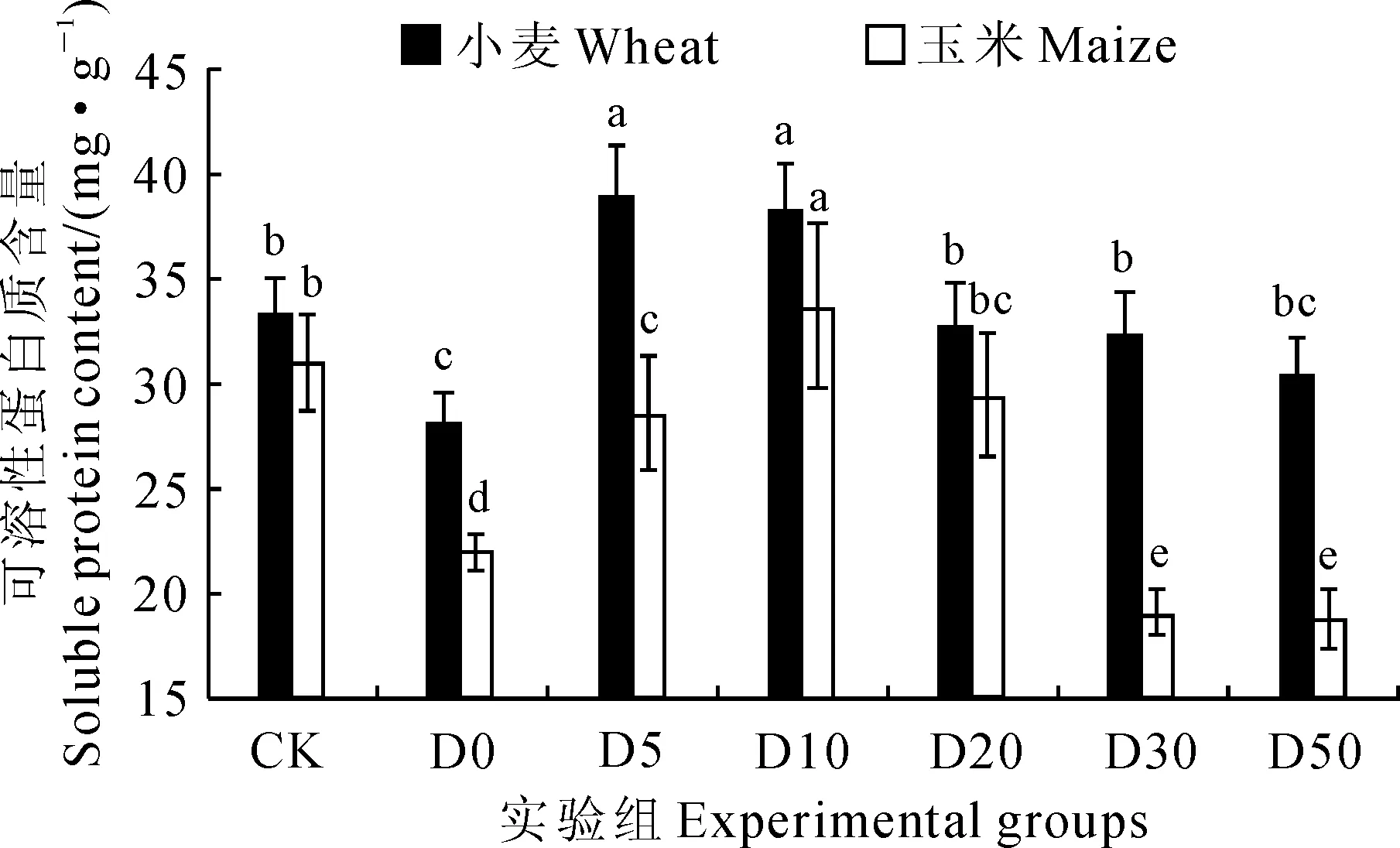
图5 小麦和玉米幼苗可溶性蛋白质含量
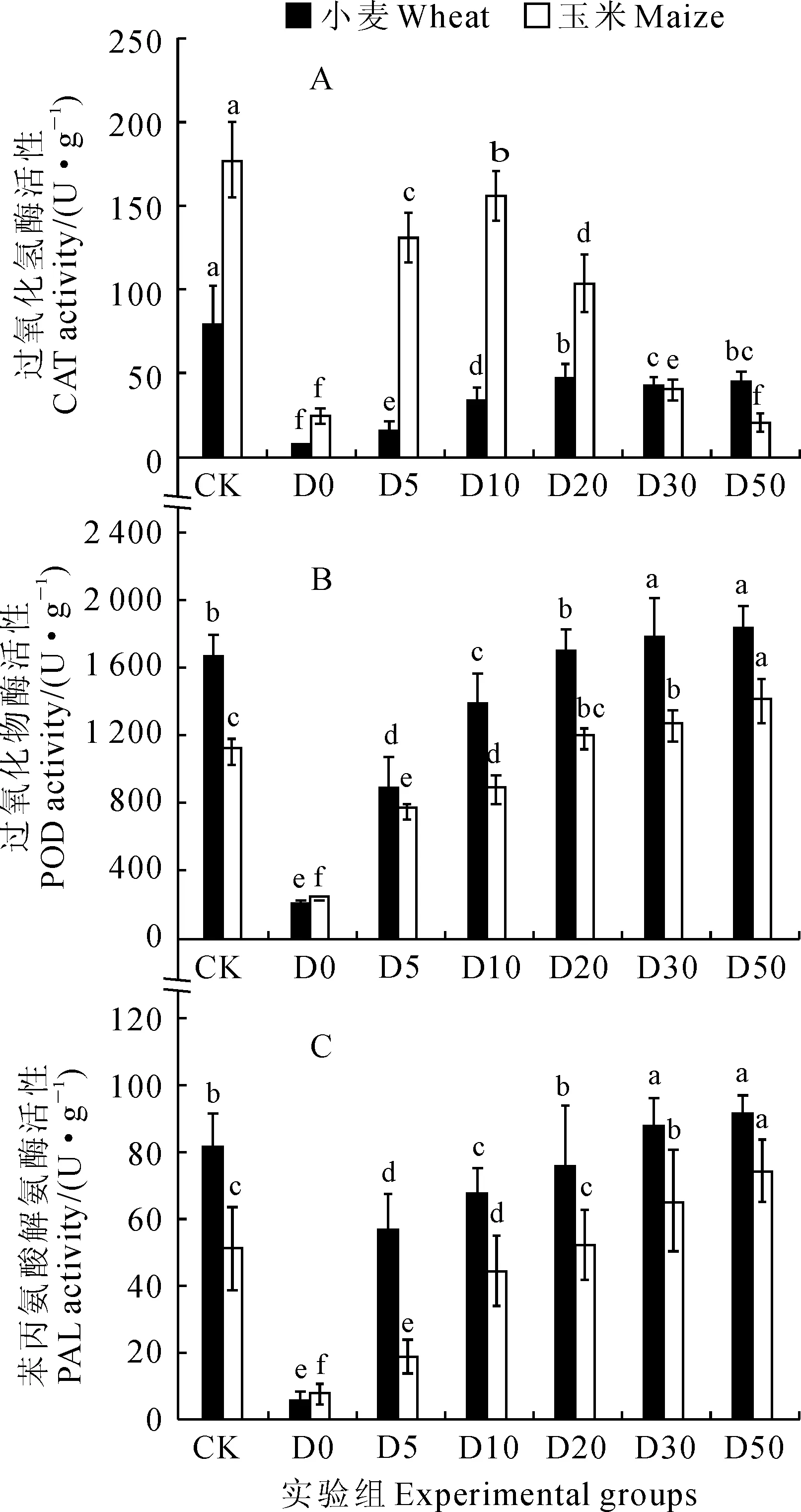
图6 不同浓度OMWS处理下小麦和玉米
3讨论
OMWS的主要成分为水、酚类物质、糖类、有机酸和矿物质等,其化学需氧量和生物需氧量高,有机物含量高、可生化处理特性强,富含生物活性物质,可开发利用价值高[9]。OMWS中酚类物质的主要种类有苯醇类(羟基酪醇)、环烯醚萜类(橄榄苦苷)、酚酸类、黄酮类等[10]。OMWS用作有机肥或土壤改良剂时,主要利用其中有益的有机碳、氮和矿物质等,而其中存在的高浓度多酚及其氧化产物对土壤生物和植物存在一定的植物毒性,应通过一定的预处理方式降低其毒性[11]。研究显示酚类物质对苜蓿种子萌发存在显著的浓度依赖性,而且因种类差异而存在不同程度的影响;在高浓度下(10-3mol·L-1),阿魏酸、香豆素、香草酸和香豆酸4种酚酸对苜蓿种子萌发均表现出显著的抑制作用,其抑制作用随着浓度的降低而逐渐减弱[12]。
首先,本研究中用不同浓度的OMWS处理小麦和玉米种子会对其萌发特性(发芽率和发芽势)产生不同程度的影响。其中,高浓度的OMWS中因含有较高浓度的多酚(如原液组含量为8.3 g·L-1,D5组含量为1.66 g·L-1)会使种子萌发受到抑制(甚至产生毒害),导致已萌发的小麦和玉米种子在持续的处理过程中全部或部分死亡;而随着OMWS处理浓度的降低,这种抑制作用逐渐减弱,相反在较低浓度(D30,0.28 g·L-1;D50,0.17 g·L-1)处理组种子的发芽率和发芽势与对照组相当或略高。这主要是由于OMWS中高浓度多酚对种子萌发存在抑制作用,低浓度酚类物质存在一定的化感促生作用,而且其中含有的糖类和矿物质为种子萌发及生长提供了必要的营养物质。OMWS中的高浓度多酚对种子萌发及生长产生的毒性可能源于3个方面[12]:(1)高浓度多酚及氧化产物抑制种子萌发所需的关键酶类及细胞分裂,使种子萌发过程缺乏必须的能量以及合成代谢所需的中间产物,从而降低种子活力、抑制其萌发;(2)高浓度多酚改变种子萌发时种皮的渗透性以及种子的吸水作用,增加种子内部物质的大量渗透;(3)高浓度处理液中的糖类等营养物质导致微生物污染、生物酸化,从而造成种子腐烂或产生毒害。
其次,本研究中用不同浓度的OMWS持续处理小麦和玉米种子时,其在影响萌发特性的同时还影响生根和叶芽的生长。高浓度的OMWS在抑制萌发率和发芽势的同时还抑制根和叶芽的生长,而随着OMWS浓度的降低这种抑制作用逐渐消除。幼苗根和叶芽的生长与OMWS的稀释倍数存在较高的相关性,小麦和玉米幼苗根的长度与OMWS稀释倍数的相关系数r分别为0.961和0.994,与多酚浓度的相关系数分别为-0.588和-0.602。这一结果提示OMW作为土壤改良剂时对植物存在较强的化感作用,因酚类物质的浓度不同而对植株的生长产生不同的影响,外观方面反映在幼苗根和叶芽的生长上。宋亮等[12]研究发现酚类物质对苜蓿幼苗生物量的影响同样存在浓度依赖性。高浓度(10-3mol·L-1)的酚酸均显著降低苜蓿幼苗地下生物量,而低浓度组(10-6mol·L-1)则表现出显著的促进作用;酚酸化感物质处理苜蓿幼苗后,随浓度的增加幼苗的地上及地下鲜重与对照相比逐渐降低。另有研究显示[13],二硝基重氮酚废水中的硝基酚类化合物污染土壤对上海青和小白菜2种蔬菜种子萌发与生长存在明显的浓度梯度影响。土壤硝基酚类化合物含量在0~12 mg·kg-1时对上海青、小白菜的发芽率有不显著的促进作用,超过24 mg·kg-1时对上海青发芽率产生明显抑制,达到36 mg·kg-1时明显抑制小白菜发芽率;污染土壤中硝基酚类化合物含量与2种蔬菜根和芽伸长抑制率呈显著线性相关。酚酸对大豆种子萌发亦有影响,苯甲酸、肉桂酸、香草酸、2种混合酚酸及3种混合酚酸的协同处理均不同程度地抑制大豆种子的萌发,不仅降低其萌发率,胚根长和干重也有不同程度的降低[14]。本研究发现与上述结果相似。
第三,OMWS处理同样影响小麦和玉米幼苗的可溶性蛋白质含量及CAT、POD和PAL活性。在发芽实验结束时,较高浓度的OMWS原液处理严重抑制种子的萌发能力,导致种子蛋白质酶解作用受阻;中等浓度OMWS处理(D10)在适度抑制和延缓种子萌发的同时,造成蛋白质水解和营养物质转化的缓慢进行,使其可溶性蛋白质含量相对较高;而低浓度OMWS处理组在促进种子萌发的同时,使较多的种子蛋白质水解产物转化合成其它幼苗生长所需的物质,进而导致可溶性蛋白质含量降低。Roshchina等[15]研究了酚酸对大豆等4种种子的化感作用,认为对羟基苯甲酸和香草酸等化感物质通过抑制受体植物的抗氧化酶(SOD和CAT)活性,导致体内活性氧增多,造成膜质过氧化,从而破坏膜结构。与对照组相比,本研究中OMWS处理对小麦和玉米幼苗CAT、POD和PAL活性有不同程度的影响,且在高浓度条件下抑制作用显著;与对照组相比,随着OMWS浓度的降低,CAT活性呈先升后降,而POD和PAL活性呈逐渐增高趋势。这种抑制主要和OMWS中存在的酚类物质等对种子的发芽与生长存在化感作用相关。分析认为,在不同浓度OMWS处理条件下,发芽结束时各组的幼苗处于不同的生长阶段:高浓度组(原液和D5)抑制作用显著导致种子死亡或发芽迟缓,中浓度(D10和D20)组虽有抑制延缓作用但种子能正常生长,而低浓度(D30和D50)组存在一定的诱导作用使种子萌发和生长相对较快。在OMWS作用下使种子处于不同的发芽程度是导致各实验组酶活性存在较大差异的原因之一。另一原因可能和OMWS处理液中不同浓度的还原性酚类物质对CAT、POD和PAL活性存在一定的抑制或诱导作用有关。种子活力、生长特性与OMWS中多酚的浓度直接造成幼苗酶活性的差异。这一结果与酚酸物质对苜蓿幼苗POD活性的影响方式类似[12],即总体呈现高浓度抑制和低浓度诱导的趋势。而CAT活性在低浓度组(D30和D50)逐渐降低可能归因于OMWS中适宜浓度的多酚为种子发芽和生长提供了良好的抗氧化物质和还原力,进而抑制了CAT的活性。
另外,本研究发现,整株POD和PAL活性的变化趋势与幼苗生根存在高度的相关性。其中,根长与其POD和PAL活性的相关系数在小麦中分别为0.827和0.740,在玉米中则分别为0.717和0.722;随着OMWS浓度的降低,小麦和玉米的根长不断增加,POD和PAL的活性也不断升高。这一结果反映出POD和PAL在植株生根过程中存在促进作用。蒋小满等[16]发现在诱导南瓜组培苗不定根形成过程中,POD活性及同工酶谱的变化与生根作用密切相关,不定根形成时POD活性迅速升高。POD活性与光叶楮扦插根的生长和延伸同样存在密切关系[17]。PAL是苯丙烷类化合物生物合成的关键酶和限速酶,同时对诱导植物体合成木质素具有重要作用,因此PAL的活性直接影响植株体内酚类物质合成和根的生长[18]。
综上所述,OMWS中存在的多种酚类物质直接通过化感作用影响小麦和玉米种子的萌发、幼苗和根的生长,以及幼苗蛋白质含量和相关酶(CAT、POD和PAL)活性,而且这种影响存在高度的浓度依赖性。OMWS中存在的多酚和糖类物质等对种子萌发和幼苗生长存在双重作用和影响,即在高浓度处理时多酚对种子萌发和生长的抑制和毒害作用占主导地位,而在低浓度处理时其中的酚类物质、多糖和矿物质等通过协同化感作用产生促进作用。由此导致的种子发芽程度的不同进一步造成其生理生化参数的改变,最终影响幼苗的生长和生根作用。这一结果暗示OMWS作为有机肥或改良剂施用时应进行适当的稀释处理以降低对植物的毒害作用,而在较低浓度水平施用可起到良好的化感作用和促生效果。今后进一步将从OMWS组成分析、微生物发酵预处理及其对土壤理化特性、土壤生物种类和丰度、植株地上/地下生物量的影响等方面进行探讨。
参考文献:
[1]KALUA C M,ALLEN M S,BEDGOODJR D R,etal.Olive oil volatile compounds,flavour development and quality:a critical review[J].FoodChemistry,2007,100(1):273-286.
[2]孔维宝,李阳,白万明,等.微波辅助提取油橄榄果渣多酚的工艺研究[J].食品与发酵工业,2011,37(4):233-237.
KONG W B,LI Y,BAI W M,etal.Microwave assisted extraction of ployphenols from olive processing pomace[J].FoodandFermentationIndustries,2011,37(4):233-237.
[3]邓煜,刘婷,梁芳.中国油橄榄产业现状和对策[J].经济林研究,2015,33(2):172-174.
DENG Y,LIU T,LIANG F.Status and countermeasures of olive industry in China[J].EconomicForestResearches,2015,33(2):172-174.
[4]MUKTADIRUL BARI CHOWDHURY A K M,AKRATOS C S,VAYENAS D V,etal.Olive mill waste composting:a review[J].InternationalBiodeterioration&Biodegradation,2013,85:108-119.
[5]PIOTROWSKA A,IAMARINO G,RAO M A,etal.Short-term effects of olive mill waste water(OMW) on chemical and biochemical properties of a semiarid mediterranean soil[J].SoilBiologyandBiochemistry,2006,38(3):600-610.
[6]ALTIERI R,ESPOSITO A,BARUZZI G.Use of olive mill waste mix as peat surrogate in substrate for strawberry soilless cultivation[J].InternationalBiodeterioration&Biodegradation,2010,64(7):670-675.
[7]D′ANNIBALE A,CASA R,PIERUCCETTI F,etal.Lentinula edodes removes phenols from olive-mill wastewater:impact on durum wheat(TriticumdurumDesf.) germinability[J].Chemosphere,2004,54(7):887-894.
[8]王学奎.植物生理生化实验原理和技术(第2版)[M].北京:高等教育出版社,2006.
[9]ZBAKH H,ABBASSI A E.Potential use of olive mill wastewater in the preparation of functional beverages:a review[J].JournalofFunctionalFoods,2012,4(1):53-65.
[11]DERMECHE S,NADOUR M,LARROCHE C,etal.Olive mill wastes:biochemical characterizations and valorization strategies[J].ProcessBiochemistry,2013,48(10):1 532-1 552.
[12]宋亮,潘开文,王进闯,等.酚酸类物质对苜蓿种子萌发及抗氧化酶活性的影响[J].生态学报,2006,26(10):3 393-3 403.
SONG L,PAN K W,WANG J C,etal.Effects of phenolic acids on seed germination and seedling antioxidant enzyme activity of alfalfa[J].EcologicaSinica,2006,26(10):3 393-3 403.
[13]李清,杨爱江,刘方,等.二硝基重氮酚(DDNP)废水中的硝基酚类化合物污染土壤对2种蔬菜种子萌发与生长的影响[J].西北农业学报,2013,22(2):159-163.
LI Q,YANG A J,LIU F,etal.Effect of the soil with pollution of dinitrodiazophenol(DDNP) wastewater with the itrophenols on the seed germination and growth of two vegetables[J].ActaAgriculturaeBoreali-OccidentalisSinica,2013,22(2):159-163.
[14]陈龙,李建东,王国骄,等.几种酚酸对大豆种子萌发的化感效应[J].种子,2011,30(5):83-86.
CHEN L,LI J D,WANG G J,etal.Allelopathy effects of several phenolic acids on seed germination of soybean[J].Seed,2011,30(5):83-86.
[15]ROSHCHINA V V,ROSHCHINA V D.The Excretory Function of Higher Plant[M].New York:SpringerLink,1993:213-215.
[16]蒋小满,赵建萍,毕可华.“艾西丝”南瓜诱导生根过程中过氧化物酶活性及同工酶的研究[J].西北植物学报,1998,18(3):397-400.
JIANG X M,ZHAO J P,BI K H.Studies on peroxidise activity and isoperoxidase inCucurbitamoschataduring rooting induction[J].ActaBot.Boreal.-Occident.Sin.,1998,18(3):397-400.
[17]宋丽红,曹帮华.光叶楮扦插生根的吲哚乙酸氧化酶、多酚氧化酶、过氧化物酶活性变化研究[J].武汉植物学研究,2005,23(4):347-350.
SONG L H,CAO B H.Studies on activities of indoleacetic acid oxidase,polyphenol oxidase and peroxidase in cuttings ofBroussonetiapapyriferaduring rooting process[J].JournalofWuhanBotanicalResearch,2005,23(4):347-350.
[18]LIU C J,ZHANG X B.Multifaceted regulations of gateway enzyme phenylalanine ammonia-lyase in the biosynthesis of phenylpropanoids[J].MolecularPlant,2015,8(1):17-27.
(编辑:裴阿卫)
Effect of Olive Mill Wastewater on the Germinability and Related Enzyme Activities of Wheat and Maize Seeds
LIU Na1,BAI Wanming2,SU Lingling1,GUO Xiaomin1,KONG Weibao1,3
(1 College of Life Science,Northwest Normal University,Lanzhou 730070,China;2 Longnan Tianyuan Olive S&T Development Co.,Ltd.,Longnan,Gansu 746000,China;3 Bioactive Products Engineering Research Center for Gansu Distinctive Plants,Lanzhou 730070,China)
Abstract:The effects of different diluted olive mill wastewater(OMWS) on the germinability and related enzyme activities of wheat and maize seeds were investigated.The germination rate,root length,and related biochemical parameters were tested using the methods of counting,weigh,and colorimetry,respectively.The results showed that the influence on the germination rate,germination vigor,and growth was based on the concentrations of OMWS.The OMWS with low dilution ratio(Original and D5) treatments were not only inhibited the seeds germination,but also delayed the growth of leafbud and root,even had more phytotoxicity.The inhibition reduced with the decreasing of OMWS concentration.However,higher dilution ratio groups(D30 and D50) promoted the seed growth behavior.The effects of OMWS on the changes in soluble protein content,catalase(CAT),peroxidase(POD),and phenylanlanine ammonia lyase(PAL) activities also displayed the tendency of inhibition under high,and induction under low concentration.There was significant positive correlation between root length and POD and PAL activities.It was concluded from the results that the influence of OMWS on the germination and growth of wheat and maize seeds had dual effects with inhibition and induction according to the dilution of OMWS.The most important effect was possibly attributed to the contents of phenolic compounds in OMWS.In view of the phytotoxicity caused by phenolics and oxidation products,we suggest to do a dilution pretreatment when OMWS used as organic fertilizer or soil conditioner.
Key words:olive mill wastewater;wheat;maize;seeds;germinability;enzyme activity
中图分类号:Q945.34;Q945.79
文献标志码:A
作者简介:刘娜(1982-),女,硕士,实验师,主要从事资源植物学研究。E-mail:liuna@nwnu.edu.cn
基金项目:国家自然科学基金(31360192);甘肃省基础研究创新群体项目(1506RJIA116)
收稿日期:2015-11-15;修改稿收到日期:2016-01-06
文章编号:1000-4025(2016)03-0565-08
doi:10.7606/j.issn.1000-4025.2016.03.0565
