Microsoft Excel在高中化学定量实验中的应用
——用质量差法测定化学反应速率及浓度对速率的影响
2016-05-05杨秋旸
杨秋旸
(深圳第二外国语学校 广东深圳 518110)
Microsoft Excel在高中化学定量实验中的应用
——用质量差法测定化学反应速率及浓度对速率的影响
杨秋旸
(深圳第二外国语学校广东深圳518110)
摘要:使用电子天平、锥形瓶、注射器、干燥管等常规仪器,通过精确测量大理石和盐酸反应体系的质量变化,利用质量差法计算生成的CO2的质量,从而精确计算出用盐酸表示出的速率;借助Excel软件对众多数据进行处理,快速计算出反应速率,并精确绘制出速率-时间图,直观地反映出盐酸浓度的变化对速率快慢产生的影响。该实验展示了现代计算机技术在高中化学定量实验中的应用所体现的精确性和高效性。
关键词:Excel;质量差;反应速率;实验设计
人教版高中化学教材(选修4)第18页实验2-1(如图1)旨在达到如下三个教学目的:1.使学生巩固化学反应速率的计算方法;2.使学生了解浓度对化学反应速率的影响;3.使学生了解在同一反应中用不同物质所表示的化学反应速率在数值上与化学方程式中各物质前的计量数存在着正比关系[1]。该实验通过量筒收集反应生成的H2并读取其体积,最终转化成用盐酸表示的反应速率。该实验装置设计简易便于操作,然而作为一个定量实验却存在着严密性欠佳的严重缺陷:首先,气体的体积受温度、压强等多种因素的影响,测量误差较大;其次,Zn与H2SO4反应的热效应较大,温度的改变对速率造成的影响没有进行变量控制。为此,笔者对该实验进行如下改进。
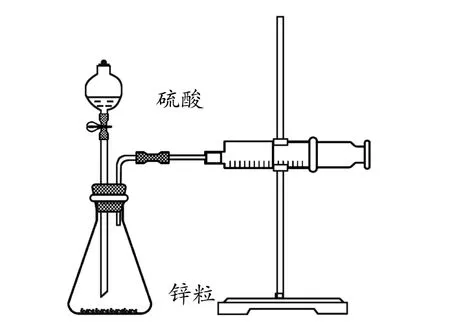
图1 测量锌与硫酸反应速率的装置
一、实验构想
质量相对于气体的体积而言受温度、压强的影响很小,可忽略不计,所以,通过测量反应中某个反应物或生成物的质量变化及时间变化来计算反应速率,就可以大大减小实验误差,提高定量实验的精确度。对有气体生成的反应连续称量其体系的质量便可以通过质量差法计算出生成的气体质量。如果,生成的气体摩尔质量较大,便可使测量数据比较灵敏[2]。然后,再通过方程式中的计量数算出其他反应物或生成物的质量、物质的量、物质的量浓度,最终计算出反应速率。
由于连续称量质量及各种物理量之间的转化涉及到的数据偏多,计算量较大,如果能够借助Microsoft Excel软件对数据进行处理就可以给我们的工作带来很大的方便。首先,由学生自己或在教师的指导下编写各个数据的计算公式,借以巩固反应速率的计算方法及进一步熟悉各物理量之间的转换关系;然后,在实验过程中直接输入测量数据,可迅速得出结论。
二、实验原理
以锥形瓶做反应容器,向其中加入大理石颗粒和盐酸,使之发生反应CaCO3+2HCl=CaCl2+H2O+CO2↑,用电子天平连续称量体系质量,质量变化就等于CO2的质量。将CO2的质量输入Excel表格,根据编写好的计算公式自动生成用盐酸表示的速率,并在Excel中做出速率-时间曲线图,从数据或曲线变化均可看出浓度和速率之间的关系。
三、实验仪器及药品
秒表、电子天平、250mL锥形瓶、60mL注射器、干燥管、棉花、烧杯,粒径4mm左右的大理石、氯化钙、4mol/L的盐酸。
四、实验装置
实验装置如图2所示,实验中使用的电子天平量程为1000g,精确度是0.01g。为防止HCl和H2O的挥发造成误差,在干燥管的下部装有用水湿润的棉花,以吸收挥发出来的HCl,干燥管的上部装有无水CaCl2,以吸收挥发出来的水蒸气;两者之间用干燥的棉花隔开。为了保持收集数据的连贯性,使测量的数据更少地受到其它因素的干扰,本实验采用注射器注射盐酸的方法。

图2 改进后的实验装置图
五、实验过程
(1)根据反应CaCO3+2HCl=CaCl2+H2O+CO2↑,在Excel表格中嵌入CO2的质量(g)与用盐酸表示的速率(mol·L-1·min-1)、盐酸的浓度(mol/L)的转化关系,并做好相关量的统计表(如图3)。
综上所述,可得如下计算公式:

各时间段内平均反应速率:
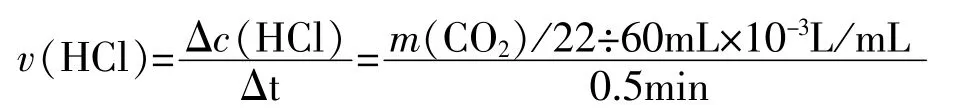

图3 碳酸钙与盐酸反应实验数据统计表
C4:fx=B3-B4
D4:fx=C4*73/44
E4:fx=D4/36.5/0.05/0.5
F4:fx=(F3*0.05-D4/36.5)/0.05
其他公式通过“下拉”操作自动生成。
(2)在锥形瓶中加入约20g的大理石,塞上带有注射器及干燥管的胶塞,置于电子天平上,用注射器向锥形瓶中推入50mL浓度为4mol/L的稀盐酸。
(3)反应片刻后,每隔30s记录一次反应体系的总质量,将数据输入表1中的B(3-10),电脑将自动计算出其它数据。
(4)选定数据A(4—10)和E(4—10),利用Excel散点图生成速率-时间图(如图4)。
(5)实验结束后,立即将锥形瓶中的液体倾倒入烧杯中,使反应停止,并清洗锥形瓶中的大理石。回收的CaCO3可以重复使用,如用于实验室制备CO2。
六、实验结果及讨论
所得实验数据详见表1,生成的速率-时间图见图4。表1的最后两列数据及图4中的曲线斜率变化均表明:随着反应的进行,盐酸浓度逐渐减小,反应速率逐渐减小。
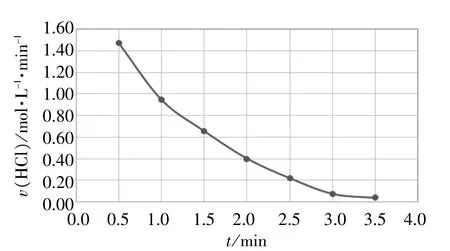
图4 碳酸钙与盐酸反应的v-t图
大理石颗粒大小及溶液体积多少在反应前后变化均不明显,可视为不变;该反应前后温度变化亦不明显,且该反应属于放热反应,温度的升高对反应的速率影响与浓度减小对反应速率的影
液在温度和溶剂的量不变的情况下,溶质是不会从溶液中分离的,可是在实际生产中需要将溶质从溶液中分离出来,比如氯化钠从海水中分离出来,这就产生了新旧知识的矛盾,提高学生探究兴趣。
2.注意学生的后续发展
教学过程中不应该仅关注眼前利益,即只关注学生能考得高分,而应该注意学生的后续发展,将初中知识与高中及以后的发展相结合。本节课中的溶解与结晶的动态平衡的介绍,让学生能初步形成动态观,为高中的平衡知识的学习做铺垫。
3.注重学生的探究实验
化学本就是一门以实验为基础的学科,课堂上应注重学生的探究实验,有利于增强学生课堂的有效关注度,提高课堂效率;有利于增强学生的实验操作能力,提高实验功能。本节课的两组学生实验,学生在自己的动手操作过程中感受了固体从溶液中析出,现象明显,既学到了知识,又体验了成功的喜悦,这是演示实验无法比拟的。
参考文献
[1]王祖浩主编.九年级化学教师教学指导书[M].上海:上海教育出版社,2014,11:16-26
[2]中学化学国家课程标准研制组.九年级义务教育教科书化学[M].上海:上海教育出版社,2015,11:21-23
[3]杨剑春,夏建华.“空气”第一课时教学设计及点评[J].中学化学教学参考,2015,(6):29-32
doi:10.3969/j.issn.1008-0546.2016.04.030
文章编号:1008-0546(2016)04-0083-02
中图分类号:G633.8
文献标识码:B
