饮食中的有机化合物
——乙醇
2016-05-04山东姚爱芝
◇ 山东 姚爱芝
(作者单位:山东省东营市河口一中)
饮食中的有机化合物
——乙醇
◇ 山东 姚爱芝
【学习目标】
1) 学生通过联系生活,能够说出乙醇的物理性质和用途;通过实验探究活动,能够完成乙醇与钠、氧气反应的实验操作并能够正确写出相应的化学方程式.
2) 通过理论探究乙醇的分子结构,共同归纳总结,能够解释羟基对乙醇性质的影响.
3) 通过对喝酒上头、酒驾、乙醇汽油等与日常生活有紧密联系的问题的认识,体会化学来源于生活又服务于生活的道理.
环节1 创设情景,引入新课.
【引入】 我国的酒文化源远流长,关于酒的诗词名句有很多,同学们知道哪些?说说看.
【教师点拨学生回答】 略.
【创设情景】 播放一段有关“不上头的好酒——绵柔杜康”的广告视频,提出问题“好酒喝了真的不上头吗?”,让我们一起走进酒的世界,去揭开这个谜底吧!
【提出问题】 酒的有效成分是什么?
环节2 实验探究并联系生活,认识乙醇的物理性质.
【学生实验】 观察乙醇并结合生活中对乙醇的了解得出乙醇的物理性质.
【教师展示】 用乙醇擦去手上划的中性笔油.
环节3 学生动手拼插球棍模型,了解乙醇分子结构.
【理论探究】 经测定乙醇的分子式为C2H6O,请同学们根据有机物中“碳有4个键、氢有1个键、氧有2个键”的理论拼插出乙醇的可能结构,并写出对应的结构式.
【学生活动】 学生利用手中的模型动手拼插,会拼出2种结构.
【共同活动】 展示学生拼插出的结构,并与学生一起书写对应的结构式:
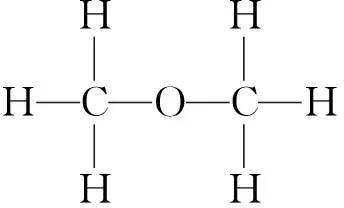
【过渡】 到底哪种才是乙醇的结构呢?我们需要通过实验进一步来探究.
环节4 实验探究乙醇的结构.
【实验探究1】 乙醇与钠的反应.
实验步骤: 1) 向试管里注入约2 mL乙醇.
2) 取绿豆粒大小的一块钠置于乙醇中,观察发生的现象,检验生成的气体.
注意事项:
1) 钠的取用方法:用镊子从试剂瓶中取出金属钠,用滤纸吸干表面的煤油,切去表面的氧化物,用小刀切下绿豆粒大小的一块,剩余的放回原试剂瓶.
2) 检验气体的方法:用拇指堵住试管口,一段时间后靠近酒精灯火焰,松开拇指,观察现象.
【追问】 乙醇能否与钠反应,你观察到了哪些实验现象?产生这些现象的原因是什么?
【学生活动】 交流讨论,描述现象并分析原因.
现象: 1) 钠沉在试管底部,缓慢放出气体;
2) 听到尖锐的爆鸣声或噗的声音.
【学生分析】 钠的密度比乙醇大,产生的气体为氢气.
【思考】 1) 你还知道哪种物质能与钠反应产生氢气?它的分子内存在什么化学键?
2) 与这种物质对比,你能否确定乙醇的结构?
3) 还有什么事实依据能支持你的推测?
【学生回答】 钠可以与水反应,水分子中存在羟基,推知乙醇分子中应含有羟基.
【点拨】 钠保存在哪里?这种物质中存在什么化学键?
【学生分析】 钠保存在煤油中,煤油中含有碳与氢之间的化学键,煤油与钠不反应,说明钠不能使乙醇中的碳氢键断裂,所以乙醇中应该含有氧氢键即羟基.因此,可以确定乙醇的结构.
【思考】 1) 根据钠和水反应原理,类比书写钠与乙醇反应的化学方程式.
2) 对比钠与水反应的现象,分析比较哪种物质中的羟基氢原子更活泼?
环节5 实验探究乙醇的化学性质.
1) 与活泼金属反应.
【思考】 乙醇还有什么样的化学性质?写出相应的化学反应方程式.
【过渡】 人饮酒后,酒精在人体也被氧化,酒精是否也完全被氧化为二氧化碳和水?
【点拨】 人醉酒后会出现什么症状?如果氧化产物完全是二氧化碳和水,还会出现这种症状吗?我们一起来探究一下乙醇的催化氧化.
【实验探究】 乙醇的催化氧化.
实验步骤: 1) 在试管里加入约2 mL无水乙醇,先将铜丝在酒精灯上灼烧,观察铜丝灼烧后的颜色.
2) 迅速将铜丝插入试管里的乙醇中,观察铜丝颜色的变化.
3) 重复3~5次,闻一闻试管里液体的气味.
【学生活动】 交流讨论,描述现象并分析原因.
现象: 1) 铜丝在酒精灯上灼烧后,铜丝变黑;
2) 趁热伸入乙醇中发现铜丝变红;
3) 有刺激性气味的物质生成.
【知识支持】 乙醛,是一种无色、有刺激性气味、易挥发的液体,其结构简式为CH3CHO.
【学生讨论】 分析铜丝2次颜色变化的原因?铜的作用是什么?试写出相应的化学方程式.
环节6 解决问题:好酒喝多了也会“上头”.
【展示】 酒在人体内的变化过程.
【设疑】 酒后驾车非常危险,极易发生交通事故,交通警察如何检查驾驶员是否酒后驾车呢?
【迁移应用】 学生通过了解交警检查司机是否酒驾的过程,了解到驾驶员呼出的气体中如果含有乙醇可以被经过硫酸处理的三氧化铬(CrO3)氧化成乙醛,同时橙红色的CrO3被还原成绿色的硫酸铬.
【小结】 乙醇不仅能被氧气氧化,还能被三氧化铬、酸性高锰酸钾等其他的强氧化剂氧化.
【归纳总结】 乙醇的结构及断键位置,结构与化学性质间的关系,体现结构决定性质.
【过渡】 性质决定了乙醇的用途,结合这节课的内容及对乙醇的了解,说说乙醇有哪些用途?
【学生活动】 举例说明乙醇的用途.
【达标检测】
(1) 决定乙醇主要化学性质的原子或原子团是( ).
A 乙基; B 羟基;
C 氢氧根离子; D 氢离子
(2) 比较乙烷和乙醇的结构,下列说法错误的是( ).
A 2个碳原子都以单键相连;
B 分子里都含有6个完全相同的氢原子;
C 乙醇可以看成是乙烷分子中的1个氢原子被羟基取代后的产物;
D 乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
(作者单位:山东省东营市河口一中)
