可溶性klotho蛋白与慢性肾脏病患者体内氧化应激的关系研究
2016-05-04林书典潘楚瑛黄艳艳詹宇威
林书典,詹 锋,武 伟,潘楚瑛,张 延,刘 颖,杨 舟,黄艳艳,黄 玮,王 茹,詹宇威
570311海南省海口市,海南省人民医院肾病风湿科
·论著·
可溶性klotho蛋白与慢性肾脏病患者体内氧化应激的关系研究
林书典,詹 锋,武 伟,潘楚瑛,张 延,刘 颖,杨 舟,黄艳艳,黄 玮,王 茹,詹宇威
570311海南省海口市,海南省人民医院肾病风湿科
【摘要】目的探讨慢性肾脏病(CKD)患者体内氧化应激状态,初步明确可溶性klotho蛋白(s-kl)在CKD患者体内氧化应激中的作用和意义。方法选取2012年1月—2014年12月在海南省人民医院肾病风湿科门诊或住院诊治的CKD患者共89例,均符合美国国家肾脏病基金会制定的肾脏病预后质量倡议(K/DOQI-CKD)诊断标准。根据CKD分期将入选患者分为CKD1~2组(27例)、CKD3~4组(35例)和CKD5组(27例)。清晨空腹采集患者静脉血,常规方法检测血常规和血生化指标。采用ELISA法检测s-kl,硫代巴比妥酸法检测丙二醛(MDA),羟胺法检测总超氧化物歧化酶(T-SOD)活性,比色法检测总抗氧化力(T-AOC),分光光度法检测还原型谷胱甘肽(GSH)。用核素肾动态显像((99)Tcm-DTPA)检测肾小球滤过率(GFR)。比较组间差异,部分指标间的依存关系采用Pearson相关分析和直线回归分析。结果3组CKD患者s-kl、MDA、T-SOD、T-AOC及GSH水平比较,差异均有统计学意义(P<0.001)。其中,CKD3~4组和CKD5组s-kl、T-SOD、T-AOC和GSH水平较CKD1~2组下降,而MDA水平升高,差异均有统计学意义(P<0.05);CKD5组s-kl、T-SOD、T-AOC和GSH水平较CKD3~4组降低,MDA水平升高,差异均有统计学意义(P<0.05)。相关分析显示,s-kl与T-SOD、T-AOC及GSH呈正相关关系(r=0.428、0.502、0.531,P<0.05),与MDA呈负相关关系(r=-0.434,P<0.05)。线性回归分析显示,s-kl与MDA、T-SOD、T-AOC间存在线性依存关系(P<0.05),而s-kl与GSH无线性回归关系(P>0.05)。结论CKD患者体内存在氧化应激,s-kl降低与肾脏氧化损伤密切相关。
【关键词】肾疾病;氧化性应激;Klotho蛋白
林书典,詹锋,武伟,等.可溶性klotho蛋白与慢性肾脏病患者体内氧化应激的关系研究[J].中国全科医学,2016,19(11):1297-1300.[www.chinagp.net]
Lin SD,Zhan F,Wu W,et al.Correlation between soluble klotho protein and oxidative stress in patients with chronic kidney diseases[J].Chinese General Practice,2016,19(11):1297-1300.
氧化应激是慢性肾脏病(CKD)进展及恶化的重要影响因素之一[1],抗氧化应激治疗日益成为临床关注的热点[2]。klotho蛋白是一种与肾脏疾病密切相关的调控因子,主要表达于大脑脉络膜和肾小管组织中,其表达上调可延缓CKD和肾脏纤维化的进展[3-4]。研究发现,klotho蛋白可作为一种抗氧化调节因子参与CKD的抗氧化应激损伤[5],因此,本研究拟在CKD患者中检测可溶性klotho蛋白(s-kl)水平,探讨其与CKD患者体内氧化应激的关系。
1资料与方法
1.1临床资料选取2012年1月—2014年12月海南省人民医院肾病风湿科门诊或住院的CKD患者共89例,均符合美国国家肾脏病基金会制定的肾脏病预后质量倡议(Kidney Disease Outcome Quality Initiative,K/DOQI-CKD)诊断标准[6]。根据CKD分期将入选患者分为CKD1~2组(27例)、CKD3~4组(35例)和CKD5组(27例)。病例纳入标准:年龄≥18岁,入选前2周内未服用具有抗氧化作用的药物、心肺功能稳定及肝功能基本正常者。病例排除标准:有透析(腹膜透析或血液透析)史、有肿瘤及自身免疫性疾病史、1个月内患有感染性疾病、输血、创伤和手术史、半年内服用中等量以上激素(相当于泼尼松 0.5 mg·kg-1·d-1以上)超过30 d、C反应蛋白水平升高者。本研究获得海南省人民医院医学伦理委员会批准,患者均知情同意。
1.2常规血清学指标检测患者清晨空腹采集静脉血(2×10 ml),提取血清置-80 ℃低温冰箱中保存备检测。采用全自动血液细胞学分析仪检测血常规,全自动生化分析仪检测血生化指标等。采用核素肾动态显像(99Tcm-DTPA)检测肾小球滤过率(GFR)。
1.3s-kl、丙二醛(MDA)、总超氧化物歧化酶(T-SOD)、总抗氧化力(T-AOC)和还原型谷胱甘肽(GSH)检测采用ELISA法检测s-kl(Immune-Biological Laboratories Co.Ltd,Gunma,Japan)。采用硫代巴比妥酸(TBA)法检测MDA,羟胺法检测T-SOD活性,比色法检测T-AOC,分光光度法检测GSH;试剂盒均购自南京建成生物工程研究所,按照产品试剂盒说明书操作。

2结果
2.1临床资料比较3组患者原发疾病构成比比较,差异无统计学意义(χ2=1.088,P=0.581,见表1)。
3组CKD患者的平均动脉压(MAP)、血红蛋白(Hb)、丙氨酸氨基转移酶(ALT)、血钙(Ca2+)、血磷(P)、碱性磷酸酶(ALP)、低密度脂蛋白胆固醇(LDL-C)、尿素氮(BUN)、血肌酐(Scr)水平、GFR比较,差异均有统计学意义(P<0.05);余指标间比较,差异无统计学意义(P>0.05,见表2)。
表13组CKD患者原发疾病构成比比较〔n(%)〕
Table1Comparisonofprimarydiseaseconstitutionamongthethreegroups
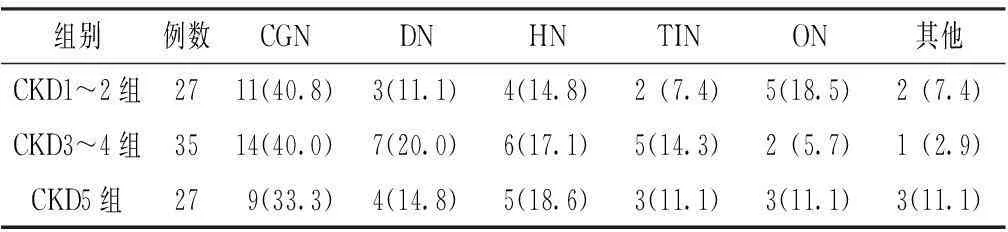
组别例数CGNDNHNTINON其他CKD1~2组2711(40.8)3(11.1)4(14.8)2(7.4)5(18.5)2(7.4)CKD3~4组3514(40.0)7(20.0)6(17.1)5(14.3)2(5.7)1(2.9)CKD5组279(33.3)4(14.8)5(18.6)3(11.1)3(11.1)3(11.1)
注:CKD=慢性肾脏病,CGN=慢性肾小球肾炎,DN=糖尿病肾病,HN=高血压肾小动脉硬化症,TIN=肾小管间质性肾病,ON=梗阻性肾病
2.23组s-kl、MDA、T-SOD、T-AOC和GSH水平比较3组CKD患者s-kl、MDA、T-SOD、T-AOC及GSH水平比较,差异均有统计学意义(P<0.001)。其中,CKD3~4组和CKD5组s-kl、T-SOD、T-AOC和GSH水平较CKD1~2组降低,而MDA水平升高,差异均有统计学意义(P<0.05);CKD5组中s-kl、T-SOD、T-AOC和GSH水平较CKD3~4组降低,MDA水平升高,差异均有统计学意义(P<0.05,见表3)。
2.3s-kl与MDA、T-SOD、T-AOC及GSH相关性分析相关性分析显示,s-kl与MDA呈负相关,与T-SOD、T-AOC及GSH呈正相关(P<0.05,见表4)。

表2 3组CKD患者基本临床资料比较
注:与CKD1~2组比较,aP<0.05;与CKD3~4组比较,bP<0.05;c为χ2值;MAP=平均动脉压,Hb=血红蛋白,ALT=丙氨酸氨基转移酶,AST=天冬氨酸氨基转移酶,Alb=清蛋白,Ca2+=血钙,P=血磷,ALP=碱性磷酸酶,TC=总胆固醇,TG=三酰甘油,LDL-C=低密度脂蛋白胆固醇,BUN=尿素氮,Scr=血肌酐,GFR=肾小球滤过率
2.4s-kl与MDA、T-SOD、T-AOC及GSH线性回归分析以s-kl为自变量,以MDA、T-SOD、T-AOC和GSH为因变量,分别进行线性回归分析,结果显示s-kl与MDA、T-SOD、T-AOC间存在线性依存关系(P<0.05),而s-kl与GSH无线性回归关系(P>0.05,见表5)。

Table 3Comparison of the levels of s-kl,MDA,T-SOD,T-AOC and GSH among the three groups

组别例数s-kl(ng/L)MDA(nmol/ml)T-SOD(U/ml)T-AOC(U/ml)GSH(mg/L)CKD1~2组27717.7±144.93.66±0.9891.2±20.912.7±3.238.9±8.5CKD3~4组35521.7±135.7a7.02±2.01a76.6±16.2a8.2±1.2a29.1±7.2aCKD5组27401.7±90.5ab7.33±2.07ab66.0±15.2ab7.0±2.0ab25.2±5.9abF值43.02035.64014.19050.02025.630P值<0.001<0.001<0.001<0.001<0.001
注:与CKD1~2组比较,aP<0.05;与CKD3~4组比较,bP<0.05;s-kl=可溶性klotho蛋白,MDA=丙二醛,T-SOD=总超氧化物歧化酶,T-AOC=总抗氧化力,GSH=还原型谷胱甘肽

表4 s-kl与MDA、T-SOD、T-AOC及GSH的相关性分析
表5s-kl与MDA、T-SOD、T-AOC和GSH关系的线性回归分析
Table 5Linear regression analysis on correlation between s-kl and MDA,T-SOD,T-AOC and GSH

因变量bSEt值P值MDA-0.0230.0043.0440.012T-SOD0.6140.1123.2450.001T-AOC0.2590.0982.4900.016GSH0.2080.1320.8370.254
3讨论
氧化应激是由于机体内氧化物质增多,抗氧化防御能力下降或缺陷引起氧化/抗氧化失衡,导致细胞组织损伤的过程,其作为肾损害的非传统因素日益受到关注并逐渐成为研究的热点。氧化应激贯穿CKD的发生发展全过程,是多种病理损伤的共同途径。氧化物质可直接攻击肾组织细胞膜蛋白、脂质及核酸,抑制线粒体内呼吸链生物酶活性,影响细胞的正常功能。研究发现,CKD发展恶化与体内氧化物质活性氧(ROS)的增多,抗氧化物质的减少密切相关[7]。
3.1CKD患者体内氧化应激Vostalova等[8]在肾移植患者中发现,晚期氧化蛋白产物(AOPP)较肾移植前下降,而GSH水平升高,提示终末期肾病(ESRD)患者体内氧化/抗氧化失衡,存在氧化应激。在本研究中同样发现,随着GFR的下降,氧化物质MDA逐渐升高,而抗氧化物质T-SOD和GSH逐渐降低,氧化/抗氧化失衡与肾功能恶化呈并行趋势,表明氧化应激是CKD持续进展的可能性因素[9-10]。与其他研究[11]不同的是,在本研究中,T-AOC随着肾功能的恶化而下降,是否与整体抗氧化物质减少所致仍不明确,但T-AOC被认为是CKD患者氧化应激的关键标志物[12],其在CKD患者体内的变化仍有争议。有学者认为,T-AOC的升高可能与CKD患者高尿酸以及体外以过氧化氢(H2O2)为底物的T-AOC检测有关[13],而确切机制仍有待研究阐明。
3.2klotho蛋白及其抗氧化机制klotho蛋白是一种影响CKD发生发展的重要跨膜蛋白,肾脏是其表达的主要器官。klotho蛋白以两种形式存在,即膜结合性klotho(m-kl)和s-kl,s-kl以酶切裂解的方式从细胞膜表面与m-kl分离,直接释放至血液循环中。通过检测血液中s-kl水平,可反映出klotho蛋白的表达水平。目前已证实,klotho蛋白随着GFR的下降而表达减少,肾脏纤维化逐渐加重[14],在本研究中也再次证明了这一点。研究发现,Kl-/-小鼠出现严重的氧化应激损伤,而在H2O2干预下,转染klotho基因的IMCD3细胞凋亡明显减少,klotho蛋白预处理的HeLa细胞脂质过氧化受到抑制,这些实验结果均提示klotho具有抗氧化和抗凋亡的功能,其机制可能是激活FOXO转录信号途径和刺激SOD生成增多的结果[15]。Oh等[16]研究表明,ESRD患者循环血中s-kl水平的下降与氧化应激的增强密切相关。同样,本研究显示,s-kl与T-SOD、T-AOC及GSH呈正相关,而与MDA呈负相关,并且线性回归分析结果发现s-kl与MDA、T-SOD和T-AOC存在线性依存关系。有研究发现,klotho蛋白表达上调可抑制肾组织中MDA水平的增高,提高T-SOD、T-AOC及GSH活性水平[15],其机制可能是通过活性氧敏感性凋亡信号调节激酶信号复合物,调控p38-MAPK以及cAMP-PKA通路从而影响体内氧化应激状态[17-18],因此提示klotho蛋白在CKD患者体内水平的变化与氧化/抗氧化失衡有密切联系,其表达水平的下降可能是肾脏氧化损伤加重的原因之一。
本文创新点:
探讨可溶性klotho蛋白在CKD患者体内水平与氧化应激的关系,为今后进一步研究klotho蛋白对CKD进展的影响提供基础理论支撑。
本文不足:
本研究结果仅初步揭示了可溶性klotho蛋白在CKD患者氧化应激中可能存在的促进作用,但其确切机制仍有待进一步的研究以阐明。
作者贡献:林书典负责试验设计、撰写论文并对论文负责;詹锋负责试验质控、指导及论文审校;武伟、潘楚瑛、张延负责收集临床病例;刘颖、杨舟、黄艳艳、黄玮负责标本收集、临床资料收集和汇总;王茹、詹宇威负责临床标本检测。
本文无利益冲突。
参考文献
[1]Modaresi A,Nafar M,Sahraei Z.Oxidative stress in chronic kidney disease[J].Iran J Kidney Dis,2015,9(3):165-179.
[2]Small DM,Coombes JS,Bennett N,et al.Oxidative stress,anti-oxidant therapies and chronic kidney disease[J].Nephrology (Carlton),2012,17(4):311-321.
[3]Hu MC,Kuro-o M,Moe OW.Klotho and chronic kidney disease[J].Contrib Nephrol,2013,180:47-63.doi:10.1159/000346778.
[4]Hu MC,Kuro-o M,Moe OW.Klotho and kidney disease[J].J Nephrol,2010,23(Suppl 16):S136-144.
[5]Tang R,Zhou Q,Liu Z,et al.Effects of fosinopril and losartan on renal Klotho expression and oxidativestress in spontaneously hypertensive rats[J].Zhong Nan Da Xue Xue Bao Yi Xue Ban,2011,36(1):27-33.
[6]National Kidney Foundation.K/DOQI clinical practice guidelines for chronic kidney disease:evaluation,classification,and stratification[J].Am J Kidney Dis,2002,39(2 Suppl 1):S1-266.
[7]Gosmanova EO,Le NA.Cardiovascular complications in CKD patients:role of oxidative stress[J].Cardiol Res Pract,2011,2:156326.
[8]Vostalova J,Galandakova A,Svobodova AR,et al.Timecourse evaluation of oxidative stress-related biomarkers after renal transplantation[J].Ren Fail,2012,34(4):413-419.doi:10.3109/0886022X.2011.649658.
[9]Yilmaz MI,Saglam M,Caglar K,et al.The determinants of endothelial dysfunction in CKD:oxidative stress and asymmetric dimethylarginine[J].Am J Kidney Dis,2006,47(1):42-50.
[10]Ceballos-Picot I,Witko-Sarsat V,Merad-Boudia M,et al.Glutathione antioxidant system as a marker of oxidative stress in chronic renal failure[J].Free Radic Biol Med,1996,21(6):845-853.
[11]Dounousi E,Papavasiliou E,Makedou A,et al.Oxidative stress is progressively enhanced with advancing stages of CKD[J].Am J Kidney Dis,2006,48(5):752-760.
[12]Bergesio F,Monzani G,Ciuti R,et al.Total antioxidant capacity (TAC):is it an effective method to evaluate the oxidative stress in uraemia?[J].J Biolumin Chemilumin,1998,13(5):315-319.
[13]Sánchez-Lozada LG,Soto V,Tapia E,et al.Role of oxidative stress in the renal abnormalities induced by experimental hyperuricemia[J].Am J Physiol Renal Physiol,2008,295(4):F1134-1141.
[14]Vahed SZ,Nikasa P,Ardalan M.Klotho and renal fibrosis[J].Nephro Urol Mon,2013,5(5):946-949.
[15]Hu MC,Kuro-o M,Moe OW.Secreted klotho and chronic kidney disease[J].Adv Exp Med Biol,2012,728(9):126-157.
[16]Oh HJ,Nam BY,Lee MJ,et al.Decreased circulating klotho levels in patients undergoing dialysis and relationship to oxidative stress and inflammation[J].Perit Dial Int,2015,35(1):43-51.
[17]Brobey RK,Dheghani M,Foster PP,et al.Klotho regulates 14-3-3ζ-monomerization and binding to the ASK1 signaling complex in response to oxidative stress[J].PLoS One,2015,10(10):e0141968.
[18]Wang Y,Kuro-o M,Sun Z.Klotho gene delivery suppresses Nox2 expression and attenuates oxidative stress in rat aortic smooth musclecells via the cAMP-PKA pathway[J].Aging Cell,2012,11(3):410-417.
(本文编辑:赵跃翠)
Correlation Between Soluble Klotho Protein and Oxidative Stress in Patients With Chronic Kidney Diseases
LINShu-dian,ZHANFeng,WUWei,etal.
DepartmentofNephrology&Rheumatology,HainanGeneralHospital,Haikou570311,China
【Abstract】ObjectiveTo study the oxidative stress in patients with chronic kidney disease (CKD),and to clarify the role of soluble klotho(s-kl) protein in the oxidative stress of CKD patients.MethodsWe enrolled 89 CKD patients or inpatients from the Department of Nephrology & Rheumatology of Hainan General Hospital from January 2012 to December 2014.All patients were consistent with the K/DOQI-CKD criteria.According to CKD staging,the patients were divided into three groups:CKD1-2 group(n=27),CKD3-4 group(n=35)and CKD5 group(n=27).Morning fasting venous blood was sampled,and routine blood indexes and biochemical indexes were detected using conventional methods.S-kl was measured using ELISA;malondialdehyde (MDA) was detected by thiobarbituric acid method;total superoxide dismutase (T-SOD) activity;total antioxidant capacity (T-AOC) was measured by colorimetry and reduced glutathione (GSH) were determined by hydroxylamine method and spectrophotometry respectively.Glomerular filtration rate(GFR) was detected by radionuclide renal dynamic imaging ((99)Tcm-DTPA).Intergroup differences were analyzed and Pearson correlation analysis and linear regression were applied to reveal the correlation among the parameters.ResultsThe three groups were significantly different in the levels of s-kl,MDA,T-SOD,T-AOC and GSH (P<0.001).CKD3-4 group and CKD5 group were lower in the levels of s-kl,T-SOD,T-AOC and GSH but were higher in the level of MDA than CKD1-2 group (P<0.05).CKD5 group was lower in the levels of s-kl,T-SOD,T-AOC and GSH and higher in the level of MDA than CKD3-4 group (P<0.05).Correlation analysis showed that s-kl had positive correlation with T-SOD,T-AOC and GSH (r=0.428,0.502,0.531;P<0.05),and had negative correlation with MDA (r=-0.434,P<0.05).Linear regression analysis showed that s-kl had linear regression relationship with MDA,T-SOD and T-AOC(P<0.05),but had no linear regression relationship with GSH(P>0.05).ConclusionOxidative stress exists in CKD patients,and the reduction of s-kl protein level is closely correlated with kidney oxidative damage.
【Key words】Kidney diseases;Oxidative stress;Klotho protein
(收稿日期:2015-09-15;修回日期:2015-12-20)
【中图分类号】R 692
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.11.014
通信作者:詹锋,570311海南省海口市,海南省人民医院肾病风湿科;E-mail:renal@126.com
基金项目:国家自然科学基金资助项目(81360118);海南省自然科学基金资助项目(309087)
