水热合成二硫化钨/石墨烯复合材料及其氧还原性能
2016-05-03陈亚玲宋力郭虎薛海荣王涛何平何建平
陈亚玲宋 力郭 虎薛海荣王 涛何 平何建平*,
(1南京航空航天大学材料科学与技术学院,江苏省能量转换材料与技术重点实验室,南京 210016) (2南京大学现代工程与应用科学学院储能材料与技术中心,固体微结构国家实验室,南京 210093)
水热合成二硫化钨/石墨烯复合材料及其氧还原性能
陈亚玲1宋力1郭虎1薛海荣1王涛1何平2何建平*,1
(1南京航空航天大学材料科学与技术学院,江苏省能量转换材料与技术重点实验室,南京210016) (2南京大学现代工程与应用科学学院储能材料与技术中心,固体微结构国家实验室,南京210093)
摘要:以六氯化钨、硫代乙酰胺、氧化石墨烯为原料,采用一步水热法合成了二维的二硫化钨/石墨烯(WS2/RGO)复合材料。水热合成的WS2/RGO具有薄层的二维结构,且由于石墨烯的存在,WS2以较少的层数形成薄片状生长在石墨烯的表面。尝试将这种非Pt类材料用于电催化氧化原反应,测试结果表明,WS2在碱性条件下氧还原活性非常低,但是复合RGO形成WS2/RGO复合材料后,电催化氧化原性能有了极大的提高,其起始电位为-0.17 V(vs SCE),转移电子数为3.7,极限电流密度为2.5 mA·cm(-2),同时其具有较好的抗甲醇性能和循环稳定性。这是因为WS2/RGO复合材料的二维结构具有更高的电子传输速率,同时硫化钨和石墨烯可以发挥协同催化作用。这种新型的二硫化钨/石墨烯(WS2/RGO)复合材料作为非贵金属催化剂表现出良好的氧还原性能,在燃料电池上具有较好的应用前景。
关键词:水热法;二硫化钨;还原氧化石墨烯;燃料电池;氧还原反应
国家自然科学基金(No.51372115)和江苏高校优势学科建设工程(PAPD)资助项目。*通信联系人。E-mail:jianph@nuaa.edu.cn
0引 言
燃料电池具有原料易得、能量密度高、工作寿命长、操作简便、清洁等优点,作为一种新型的高效率[1]能源转换体系,很有潜力成为微型电子元器件的替代能源之一。在燃料电池反应过程中,阴极氧还原过程是决定燃料电池效率非常重要的一个因素[2-3]。目前,氧还原还面临很多问题,如高成本贵金属催化剂的使用、效率较低、稳定性差、可逆性小和中间产物强吸附等现象[4],因此寻找新型高效的氧还原电催化剂对发展燃料电池是至关重要的。我们知道,若要提高阴极反应的效率,电催化剂必须具备以下特点:电催化活性高、比表面积大、导电性能好、稳定性好以及适当的载体支撑。其中,载体的作用一方面是作为催化剂支撑物,将电催化剂固定并让其均匀分散在载体表面,避免催化剂由于团聚而降低催化活性[5-8];另一方面,由于载体和催化剂具有特殊的电子结构,它们之间往往会存在某种相互作用,使之发生协同催化效应[9],以此来提高电催化剂的催化性能。目前已经广泛商业化使用的是Pt催化剂,虽然Pt催化剂具有过电位小、起始电位很正、反应电流密度大等优点,但是其资源匮乏,价格高昂[10],在商业化的燃料电池中阳极易渗透到阴极,与Pt催化剂发生电氧化,产生毒性CO中间体使催化剂中毒,降低催化活性[11-12],因此降低了Pt作为电催化剂时燃料电池的效率。综上所述,我们需要寻找一种可以替代Pt基催化剂的非贵金属高活性电催化剂。
石墨烯作为典型的二维材料,比表面积大、柔韧性非常好,并且具有非常高的电子传导速率。自2004年发现以来,就引起了国内外科研工作者的极大关注。目前,对石墨烯进行掺杂或原位复合,制备功能化石墨烯是现在广泛关注的热点。随着石墨烯的发现和表征,同样作为典型层状结构的过渡金属硫族化合物(TMDCS),如WS2、MoS2,被剥离成单层或少层结构在润滑剂[13-14]、锂电池[15]、光电催化[16]、超级电容器[17]等方面的研究也取得了不错的进展。在TMDC中,两层硫族元素原子层在中间夹着金属原子层,是一个类似三明治S-M-S的结构。过渡金属硫族化合物具有半导体的特性以及非常明显的各向异性,并且每一单层都表现出二维材料的特性。虽然通过物理和化学的方法将MS2剥离成单层或少层的结构有很多报道[18-19],但是将这些类石墨稀材料与石墨烯复合用于电催化氧还原反应却鲜有研究。
我们知道,石墨烯及改性石墨烯不论是作为催化剂载体还是单独用于催化ORR过程,都表现出一定的氧还原催化活性[20-21]。在本文中,我们尝试合成过渡金属硫族化合物与石墨烯纳米复合材料作为燃料电池阴极催化剂。主要是以六氯化钨为钨源和硫代乙酰胺为硫源,在氧化石墨烯表面原位水热合成层状WS2/RGO复合物,并对其进行了结构和电化学性能的分析。结果显示,复合之后的催化剂起始电位和极限电流相比RGO更接近商业Pt/C,同时抗甲醇毒化和稳定性优于Pt/C,显示出较好的催化活性和ORR选择性,是未来非常有潜力替代贵金属催化剂的选择之一。不仅如此,我们旨在研究出复合物的氧还原协同催化机理,使过渡金属硫化钨/碳复合材料长效发挥协同效应[22],提升其氧还原活性。
1 实验部分
1.1主要实验试剂与仪器
硫代乙酰胺(C2H5NS,Mr=75.13,AR,国药集团化学试剂有限公司),六氯化钨(WCl6,Mr=396.558,AR,长沙京华粉体材料科技有限公司),天然石墨粉(AR,上海实意化学试剂公司),实验中均采用二次去离子水。
CHI760D电化学分析仪(工作站,上海辰华仪器有限公司),S-4800场发射扫描电子显微镜(日本Hitachi公司),JEM-2100透射电子显微镜(TEM,日本JEOL公司),D8 X射线衍射仪(XRD,德国Bruker公司,采用Cu靶,Kα射线源(λ=0.154 1 nm),扫描范围为10°~80°),程序升温氮气气氛电热炉(洛阳神佳窑业有限公司),DZF-6051型真空干燥箱(上海精宏实验设备有限公司),TG16-WS离心机(长沙高新开发区湘麓离心机有限公司),85-2恒温磁力搅拌器(国华电器有限公司)
1.2实验方法
1.2.1氧化石墨烯(GO)的制备
通过改性的Hummers法[23]制备氧化石墨烯。将2 g石墨和1.2 g无水硝酸钠在冰浴条件下缓缓倒入至35 mL浓硫酸中,搅拌并分批加入8 g高锰酸钾,20℃恒温搅拌30 min,随后升温至40℃继续搅拌1 h。在搅拌过程中加入50 mL蒸馏水并继续搅拌30 min,控制温度在98℃以下。搅拌结束后升温至98℃,加入20 mL 30%的过氧化氢至溶液变为亮黄色。将产物在去离子水中搅拌并超声剥离,并通过离心收集沉淀物,经稀盐酸和蒸馏水洗涤至溶液中无SO42-等离子即可制得氧化石墨烯。
1.2.2 RGO的制备
取100 mg GO溶于100 mL蒸馏水中,超声搅拌1 h,并在搅拌时逐滴加入1 mL水合肼(80%)。待分散均匀后,将溶液转移至100 mL聚四氟乙烯内衬的不锈钢高压反应釜中,在100℃时水热反应24 h。自然冷却到室温后,收集产物,并用去离子水和乙醇分别洗涤3次,最后在60℃真空烘箱中干燥,随后研细以供后续实验操作使用,样品命名为RGO。
1.2.3纯WS2的制备
称取1 mmol的WCl6和4 mmol的C2H5NS于烧杯中,加入80 mL蒸馏水,在25℃恒温水浴锅中搅拌1 h。分散均匀后,将溶液转移至100 mL聚四氟乙烯内衬的不锈钢高压反应釜中,在180℃时水热反应24 h。自然冷却至室温后,取得黑色沉淀物,并用去离子水和乙醇反复离心洗涤,然后在60℃的真空烘箱中干燥24 h。最后将干燥产物在充满N2的管式炉中800℃煅烧2 h,冷却后研细以供后续实验操作使用,样品命名为WS2。
1.2.4 WS2/RGO复合材料的制备
称取40 mg上述制得的GO,分散于80 mL蒸馏水中,超声搅拌24 h使其完全分散,然后加入1 mmol的WCl6和4 mmol的C2H5NS继续搅拌1 h,待分散均匀后,用0.1 mol·L-1的NaOH溶液调节pH值至6。最后将溶液转移至100 mL聚四氟乙烯内衬的不锈钢高压反应釜中,在180℃时水热反应24 h。后续对样品的处理和纯WS2一样,将得到的样品命名为WS2/RGO。
1.3电化学性能测试
制备工作电极:先用粒度为05#型号的金相砂纸将玻碳电极表面打磨,然后再用氧化铝抛光粉抛光1 h,至镜面光滑后,再超声处理30 min,最后用蒸馏水洗涤。称取5 mg制得的样品,加入50 μL Nafion膜溶液、0.5 mL蒸馏水和0.5 mL乙醇,搅拌超声30 min使悬浮液均匀分散。然后再用微量进样器取2.5 μL悬浮液逐滴滴加到电极表面,室温下干燥后即可。
电化学测试均在温度为25℃、常压下的三电极体系下进行。其中,工作电极是涂覆所制备催化剂的玻碳(GC)电极(Φ=5 mm),对电极为Pt片电极(Φ=0.5 mm),参比电极为饱和甘汞电极(SCE),电解液为0.1 mol·L-1的KOH溶液。进行所有电化学测试之前都先向溶液中通氧气0.5 h,使氧气在溶液中达到饱和以进行后续的电化学测试。
2 结果与讨论
2.1材料的组成与结构分析
2.1.1 XRD分析
图1是WS2、RGO和WS2/RGO复合物的XRD图。从图1 WS2的XRD图中主要的衍射峰分别出现的位置(2θ)为:14.2°、33.4°、39.5°以及59.1°,分别对应WS2的晶面为(002)、(101)、(103)和(110),这与WS2标准卡片[PDF#08-0237]的衍射峰出现的位置基本吻合,无其他杂峰出现,为六方晶系(P63/mmc),这证明水热过程后生成的产物为WS2。XRD图中(002)面衍射峰强度高且尖锐,说明WS2是沿着(002)晶面生长的,根据布拉格方程算出的晶面间距d002= 0.618 nm。水热合成RGO的衍射图中,在2θ=24.1°的位置出现了RGO的(002)峰,说明水热过程中氧化石墨烯已被还原。同时从复合材料的XRD图中可以看到,其主要衍射峰位置变化不大,强度几乎没有减弱,只有14.2°处的峰强度几乎减小一半,峰宽相对变宽。而复合物中RGO的(002)晶面衍射峰出现在20.5°处,与单独水热合成的RGO相比,往小角度偏移[24]。这说明水热过程中,GO的存在极大地抑制了WS2的堆叠,使其沿(002)方向生长的趋势变弱,趋向于形成薄层二维结构。
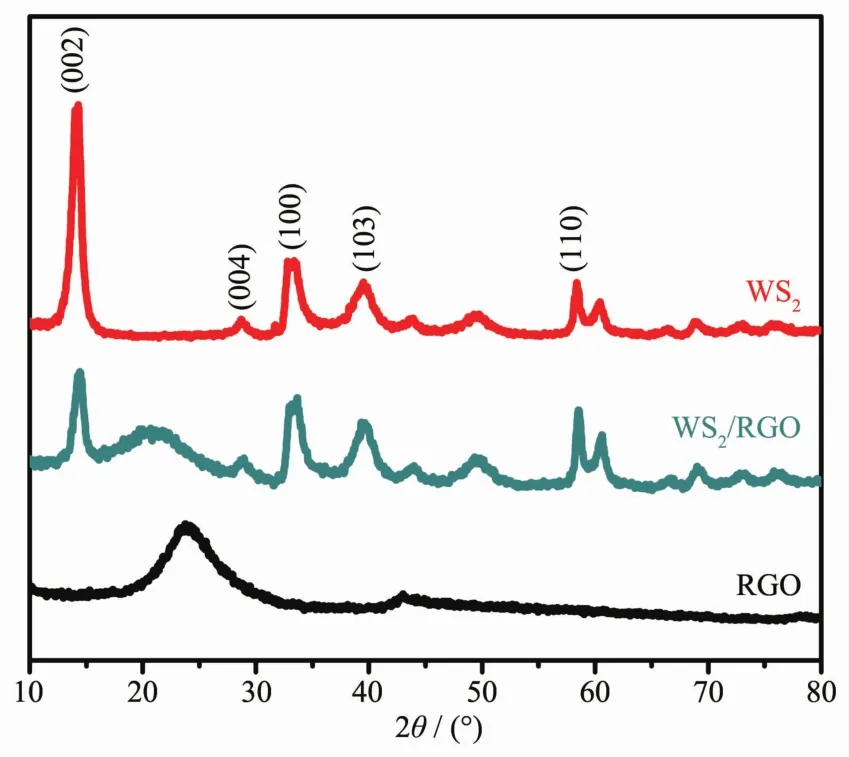
图1 RGO、WS2以及WS2/RGO复合材料的XRD图Fig.1 XRD patterns of RGO, WS2and WS2/RGO composite

图2 (a)、(b): WS2和WS2/RGO的SEM图; (c)、(d): WS2和WS2/RGO的TEM图; (e)WS2选区电子衍射图; (f) WS2/RGO的高倍透射图Fig.2 SEM spectra of WS2(a) and WS2/RGO (b); TEM spectra of WS2(c) and WS2/RGO (d); (c) Electron diffraction pattern of WS2; (e) HRTEM spectra of WS2/RGO
2.1.2 SEM和TEM图分析
图2是纯WS2和WS2/RGO复合物的SEM和TEM图。从图2a中可以看出,二硫化钨是由片层堆叠而成的二维结构,片层表面光滑,堆叠程度高,从图中的局部放大图可以看到更加清晰的片层结构,这与图1中的XRD是相吻合的。从图2c的TEM图可以看到,WS2在(002)晶向的生长没有受到抑制,因此其表现出典型的块状形貌。此时,WS2是由多层花瓣状片层堆积而形成的层状结构,沿垂直方向延伸,并存在自身的折叠和卷曲。从区域电子衍射(图2e)图中可以进一步观察到WS2属于六方晶系,最里面的环对应的晶面是(002)晶面,其次是(004)、(100)晶面。在氧化石墨烯表面原位生长WS2,如图2b和2d所示,复合物结构中WS2依然保留了其典型的层状结构,并且层状结构的WS2在石墨烯的表面生长,这与图1中复合物的XRD图相对应。作为生长基底的氧化石墨烯呈现出透明、褶皱的薄纱结构,而从XRD(图1b)中发现其被还原为石墨烯。这是由于在水热合成中,六氯化钨和硫代乙酰胺反应生产二硫化钨的同时,还会产生H2S气体,而在高温高压的条件下这种气体使GO被还原成RGO[25]。从高倍透射图中(图2f)可以明显看到层数约为8层的WS2均匀附着在石墨烯上,层间距为0.618 nm。在前面我们讨论了这是由于水热过程中石墨烯的存在抑制了WS2的重新堆叠,使得WS2在石墨烯上以较薄的片状生长。
2.2电化学性能测试
样品的ORR性能测试均在三电极体系下完成,其循环伏安性能测试在扫描速率为20 mV·s-1时的O2饱和的0.1 mol·L-1KOH溶液中进行。我们在同样的充氧条件下测试了纯WS2、RGO以及WS2/ RGO复合物的ORR性能,并和商业Pt/C进行对比。从图3中可以看出,纯WS2在0.2~-1.0 V电压范围之间没有特征CV曲线出现,即没有O2的还原峰,说明纯的二硫化钨在碱性条件下不具备催化氧还原性能。RGO由于自身的结构存在很多缺陷和活性位点,所以具备一定的氧还原性能,从图中的红色曲线我们可以看到,RGO在-0.28 V处有一个O2的还原峰,对应的电流密度是0.51 mA·cm-2。相比与前面两种材料,水热合成的WS2/RGO复合材料的催化氧还原性能大大增加。其氧气的还原峰出现在-0.24 V电位处,对应的电流密度是-1.75 mA· cm-2,相比于RGO,峰电流密度增加至3倍,峰电位正移了约40 mV,体现了良好的催化性能。WS2/ RGO的峰电位为-0.26 V,与商业Pt/C(-0.18 V)相比负移了60 mV,但是峰电位相比Pt/C略有增加。这可能是由于在水热过程中,石墨烯的晶格结构中引入了S原子,在边缘和缺陷位点处形成了C-S键,而C-S键的形成促进了氧分子的活化解离,降低了氧还原过程中的势能,使氧还原反应更加趋近于四电子反应[26]。同时,复合物的二维结构,有利于电子的传输,使得氧还原速率大大增加。

图3 WS2、RGO、WS2/RGO和Pt/C在扫速为20 mV·s-1 的0.1 mol·L-1KOH氧饱和溶液中的CV曲线Fig.3 Cyclic voltammograms for WS2, RGO, WS2/RGO and Pt/C in an O2-saturated 0.1 mol·L-1KOH aqueous solution at a scan rate of 20 mV·s-1
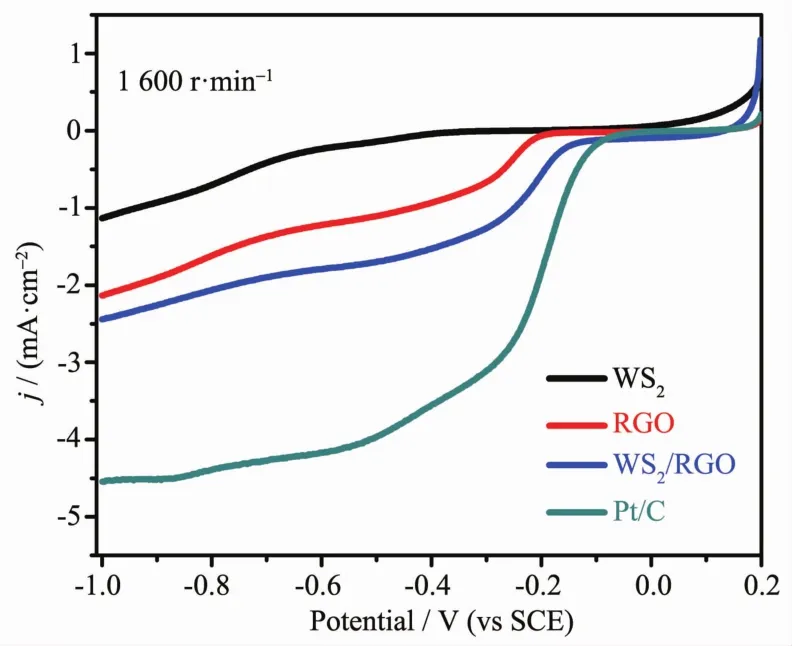
图4 WS2、RGO、WS2/RGO和Pt/C在O2饱和的0.1 mol·L-1KOH溶液中扫速为5 mV·s-1的LSV曲线(1 600 r·min-1)Fig.4 Linear sweep curves of WS2, RGO, WS2/RGO composite and Pt/C in an O2-saturated 0.1 mol· L-1KOH solution at a scan rate of 5 mV·s-1(1 600 r·min-1)
为了进一步研究材料的电催化氧还原性能,我们通过旋转圆盘电极(RDE)技术对WS2、RGO和WS2/RGO测定了线性扫描伏安曲线(LSV),并和商业Pt/C对比。LSV测试在氧气饱和的0.1 mol·L-1KOH溶液中以1 600 r·min-1的转速和5 mV·s-1的扫描速率进行的,如图4所示。从图4中可以看出,纯WS2的氧还原性能非常差,在氧还原电位范围内没有达到扩散控制,是一个明显的两电子转移反应。RGO的起始电位是-0.22 V,而WS2/RGO复合物的起始电位-0.17 V,相比于RGO正移了约50 mV;并且在氧还原电位区间内,复合物的电流密度比RGO增加了0.59 mA·cm-2。相比Pt/C,WS2/RGO 和RGO的极限电流密度均低于Pt/C,但是起始电位却比RGO更接近Pt/C (-0.18 V)。该图进一步表明,水热反应原位形成的复合结构催化氧还原反应的性能显著增强,二硫化钨负载在薄层石墨烯上,通过静电力和相关的官能团稳定结合在一起,有利于电子的快速迁移,长效发挥协同效应[27],提高电催化氧还原性能,在替代商业Pt/C催化剂方面有很大的潜能。
为了更深入地探究WS2/RGO的ORR过程,我们又在旋转圆盘电极上对其进行了转速从400 r· min-1到1 600 r·min-1的线性扫描伏安测试(LSV)。从图5a中的LSV曲线上可以看到,复合物的起始电位是-0.17 V,随着转速从400 r·min-1增加到1 600 r·min-1,电流密度也随之增大。这主要是由于氧还原反应过程受氧气的扩散速率控制,转速越高对氧气的扩散越有利。图5c是WS2/RGO复合材料根据Koutecky-Levich方程在不同的转速下取电位分别为-0.3、-0.4、-0.9 V时对应的电流值作出的拟合曲线图,样品的j-1对ω-1/2曲线相互平行,基本呈线性分布,表明在电极电位范围内是一阶反应。氧还原反应中每个氧分子的电子转移数由下列Koutecky-Levich方程可以计算得到:


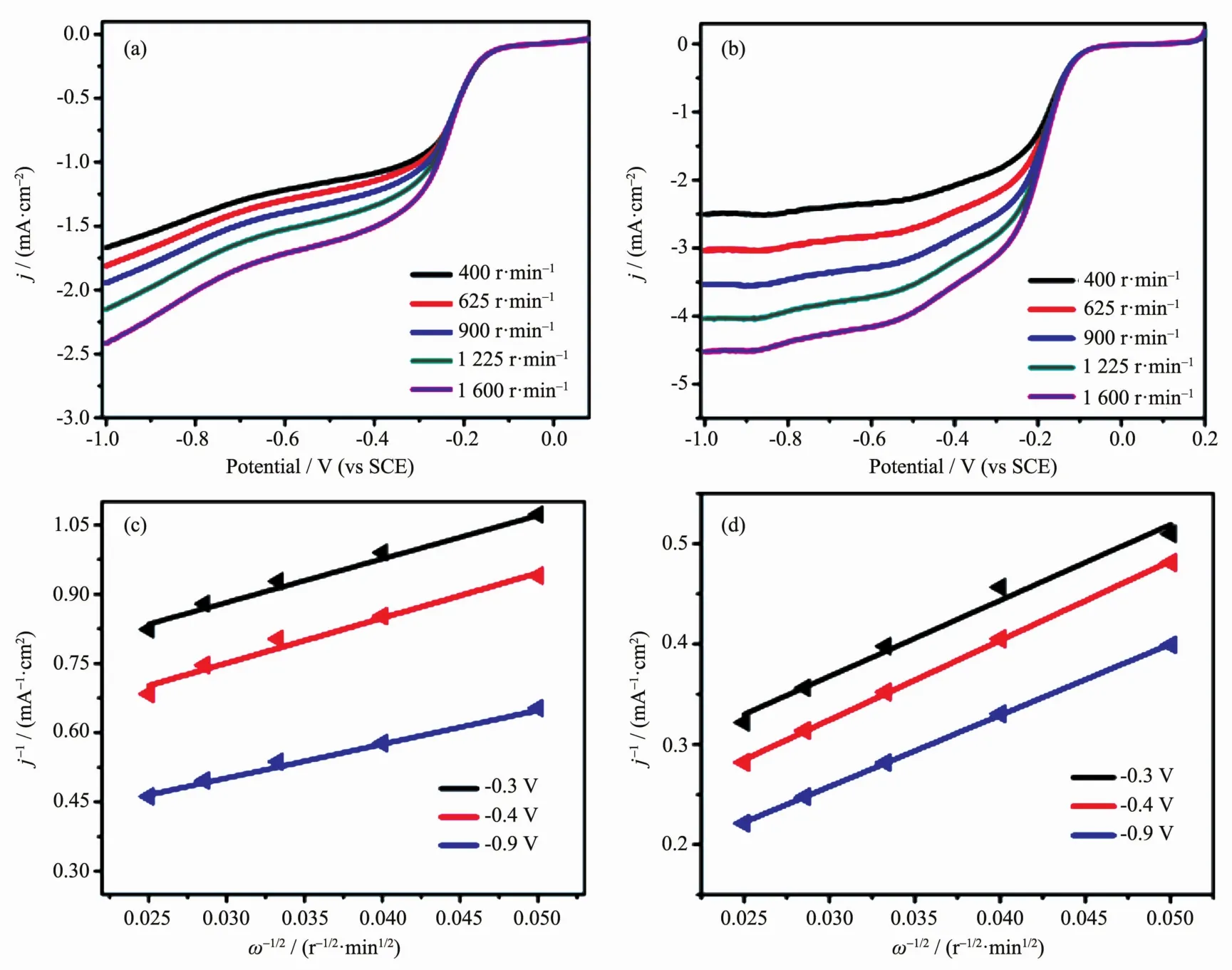
图5 WS2/RGO (a), Pt/C (b)在O2饱和的0.1 mol·L-1KOH溶液中不同转速下的LSV曲线;WS2/RGO (c),Pt/C (d)在-0.3、-0.4、-0.9 V下的K-L曲线Fig.5 Linear scanning curves recorded of WS2/RGO composite (a), Pt/C (b) with different rotation rates in an O2-saturated 0.1 mol·L-1KOH solution; Koutecky-Levich plot of j-1vs ω-1/2at different electrode potentials: WS2/RGO (c) composite, Pt/C (d); the lines represent linear reression
方程(1)中,j为阴极极化条件下的极限扩散电流(mA ·cm-2),jk为动力学电流密度(mA·cm-2),1/B是计算得到的拟合曲线的斜率,ω为旋转圆盘电极的转速(r·min-1)。方程(2)中,我们取常数的值为0.2(转速的单位为r·min-1)[28],n代表氧还原过程中每个氧分子的电子转移数,F是法拉第常数(F=96 485 C·mol-1),DO2是O2在0.1 mol·L-1溶液中的扩散系数(DO2=1.9× 10-5cm2·s-1)[29],ν是0.1 mol L-1KOH电解质溶液的动力学粘度(ν=1.0×10-2cm2·s-1)[29],CO2是0.1 mol·L-1KOH溶液中氧气的本体浓度(CO2=1.2×10-6mol· cm-3)[29]。将上述电化学常数代入Koutecky-Levich方程中计算得到WS2/RGO电极电催化ORR过程中平均每个氧分子的电子转移数为3.7。为了同商业Pt/C电极对比,我们同样也对其进行了不同转速下LSV测试,如图5b、5d所示。根据Koutecky-Levich方程,可以计算得出Pt/C电极电催化氧还原过程中平均每个氧分子的得失电子数为3.9。由此可以看出,WS2/RGO催化氧还原反应的电子数非常接近Pt/C电极的电子转移数值,这说明ORR反应更趋近于四电子反应过程。
为了测试WS2/RGO作为氧还原催化剂的稳定性,我们进行了复合物和Pt/C在O2饱和的0.1 mol·L-1KOH溶液中循环扫描1 000圈前后的CV曲线,如图6所示。从图6a中可以看出,在经过1 000圈电化学扫描后,WS2/RGO复合物的峰电位和峰电流没有明显变化,峰形保持稳定;而从图6b中可以看出,Pt/C电极在经过1 000圈循环扫描后,峰电位负移,峰电流有大幅减小,说明WS2/RGO作为氧还原催化剂比Pt/C具有更优异的稳定性和循环性能。
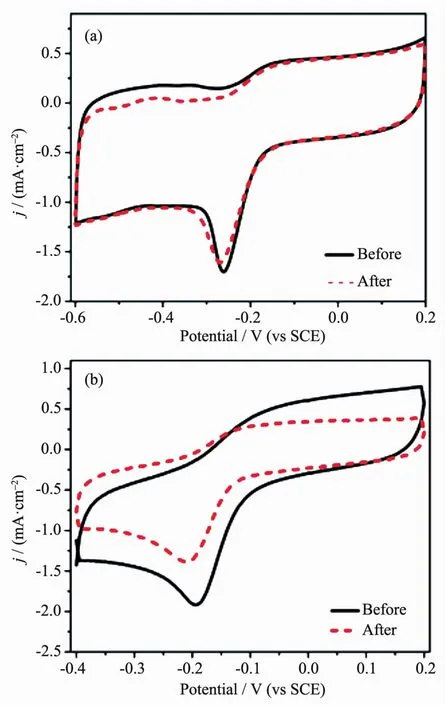
图6 WS2/RGO (a)和Pt/C (b)在O2饱和的0.1 mol·L-1 KOH溶液中循环扫描1 000圈前后的CV曲线Fig.6 CV curves of WS2/RGO (a) and Pt/C (b) before and after 1 000 cycles in an O2-saturated 0.1 mol·L-1KOH solution at a scan rate of 20 mV·s-1
为了进一步考察WS2/RGO电极在0.1 mol·L-1KOH溶液中的抗甲醇能力,我们测试电催化性能时在电解质溶液中加入了3 mol·L-1的CH3OH溶液。图7是WS2/RGO和商业Pt/C电极在加入3 mol·L-1CH3OH溶液后的CV曲线。从图7a中可以看出,在加入甲醇溶液后,WS2/RGO的CV曲线保持恒定,峰电位几乎没有负移,峰电流略有减小。而在图7b中,商业Pt/C电极在加入甲醇溶液后,原来出现在-0.36 V左右的峰完全消失,在-0.15 V处出现了新的甲醇氧化峰。这说明在混合电解质溶液中,Pt/C电极会催化甲醇氧化,产生混合电位,降低ORR活性。由此可以得出,WS2/RGO比商业Pt/C具有更强的ORR选择性和抗甲醇中毒能力。
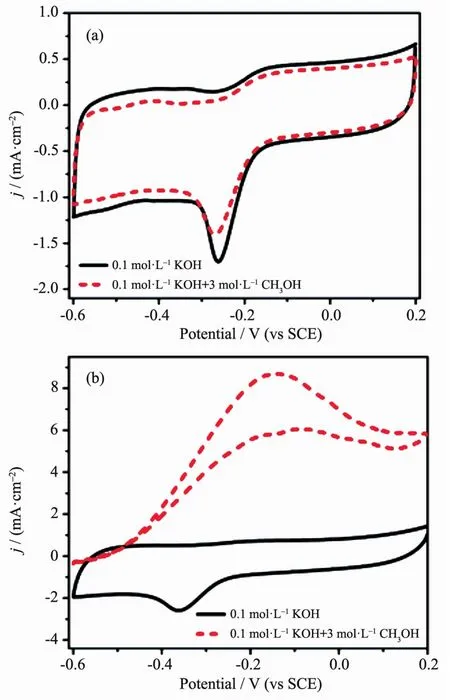
图7 在O2饱和的0.1 mol·L-1KOH溶液中加入3 mol·L-1甲醇溶液后WS2/RGO (a)和Pt/C (b) 的CV曲线Fig.7 CV curves for WS2/RGO (a) and Pt/C (b) in an O2-saturated 0.1 mol·L-1KOH solutionwith and without 3 mol·L-1CH3OH at a scan rate of 20 mV·s-1
3结 论
以六氯化钨、硫代乙酰胺、氧化石墨烯为原料水热合成了WS2/RGO复合材料,经过高温热处理后,WS2形成少层结构,均匀附着在石墨烯上形成稳定的二维复合材料。与纯WS2和RGO相比,复合材料的催化氧还原活性有很大程度的提升,这是因为WS2和RGO之间存在协同效应,原位合成过程中RGO的缺陷和活性位点增多[24],使得在氧还原过程中,利于O2分子的解离,降低体系的活化能,更有利于氧还原过程以四电子的途径进行。测试结果表明,复合之后WS2/RGO具有更正的起始电位(-0.17 V vs SCE)和极限电流密度(2.5 mA·cm-2),而且比Pt/C具有更优异的循环稳定性和抗甲醇毒化性能。由于水热法合成该复合物的工艺简单,成本低廉,而且具有不俗的电催化性能,在燃料电池领域具有良好的应用前景。
参考文献:
[1] PAN Xu-Chen(潘旭晨), TANG Jing(汤静), XUE Hai-Rong(薛海荣), et al. Chinese J. Inorg. Chem.(无机化学学报), 2015,31(2):282-290
[2] Ma W, Chen F, Zhang N, et al. J. Mol. Model., 2014,20(10): 2454-2454
[3] Stamenkovic V R, Fowler B, Mun B S, et al. Science, 2007, 315(5811):493-497
[4] Li Y, Wu Z, Wang H, et al. Nat. Nanotechnol., 2012,7(6): 394-400
[5] Jiang S, Sun Y, Dai H, et al. Nanoscale, 2015,7:10584-10589
[6] Zhu C, Dong S. Nanoscale, 2013,5(5):1753-1767
[7] Ji-Eun P, Jin J Y, Yeo J K, et al. Phys. Chem. Chem. Phys., 2014,16(1):103-109
[8] Bian W, Yang Z, Strasser P, et al. J. Power Sources, 2014, 250(3):196-203
[9] Yang S Y, Lin W N, Huang Y L, et al. Carbon, 2011,49(3): 793-803
[10]Liew K B, Wan R W D, Ghasemi M, et al. Int. J. Hydrogen Energy, 2014,39(10):4870-4883
[11]Xu J, Zhao Y, Shen C, et al. ACS Appl. Mater. Interfaces, 2013,5(23):12594-12601
[12]Roche I, Scott K. J. Appl. Electrochem., 2009,39(2):197-204
[13]Niste V B, Tanaka H, Ratoi M, et al. RSC Adv., 2015,5: 40678-40687
[14]Xu S, Gao X, Hu M, et al. Appl. Surf. Sci., 2014,288(2):15-25
[15]Bhandavat R, David L, Singh G. J. Phys. Chem. Lett., 2012, 3(11):1523-1530
[16]Jana S, Bera P, Chakraborty B, et al. Appl. Surf. Sci., 2014, 317:154-159
[17]Ratha S, Rout C S. ACS Appl. Mater. Interfaces, 2013,5 (21):11427-11433
[18]Jeffery A A, Nethravathi C, Rajamathi M. J. Phys. Chem. C, 2013,118(2):1386-1396
[19]Liu Y, Wang W, Huang H B, et al. Chem. Commun., 2014, 50(34):4485-4488
[20]Xu L, Zhang G, Chen J, et al. J. Power Sources, 2013,240 (1):101-108
[21]Xiao J, Bian X, Lei L, et al. ACS. Appl. Mater. Interfaces, 2014,6(20):17654-17660
[22]Xiang Q, Yu J, Jaroniec M. J. Am. Chem. Soc., 2012,134 (15):6575-6578
[23]Hummers W S, Offeman R E. J. Am. Chem. Soc., 1958,80 (6):1339
[24]LI Yun-Xia(李云霞), WEI Zi-Dong(魏子栋), ZHAO Qiao-Ling(赵巧玲), et al. Acta Phys. Sin.(物理学报), 2011,60(4): 858-862
[25]Cao S, Liu T, Hussain S, et al. Mater. Lett., 2014,129(32): 205-208
[26]Sha Y, Yu T H, Merinov B V, et al. J. Phys. Chem. C, 2012,116(40):21334-21342
[27]Ehsan P, Enamul H, Weimin Z, et al. Chem. Commun., 2013,49(94):11068-11070
[28]Liu R, Li S, Yu X, et al. J. Mater. Chem., 2011,21(38): 14917-14924
[29]Peng H, Liu F, Liu X, et al. ACS Catal., 2014,4:3797-3805
Hydrothermal Synthesis and ORR Performance of Tungsten Disulfide/Reduced Graphene Oxide Composite
CHEN Ya-Ling1SONG Li1GUO Hu1XUE Hai-Rong1WANG Tao1HE Ping2HE Jian-Ping*,1
(1Jiangsu Key Laboratory of Materials and Technology for Energy Conversion, College of Materials Science and Technology, Nanjing University of Aeronautics and Astronautics, Nanjing 210016, China)
(2Center of Energy Storage Materials & Technology, College of Engineering and Applied Sciences, National Laboratory of Solid State Microstructures, Nanjing University, Nanjing 210093, China)
Abstract:Two-dimensional tungsten disulfide/reduced graphene oxide (WS2/RGO) composite was synthesized by one-step hydrothermal method using tungsten hexachlorid, thioacetamide and graphene oxide (GO) as precursors. Due to the presence of graphene, WS2with few layers is uniformly grown on the surface of RGO. We attempted to employ this non-Pt material as an electrocatalyst for oxygen reduction reaction (ORR). Test results indicate that the ORR activity of WS2in alkaline electrolyte is actually very low. However, after the formation of WS2/ RGO composite, the electrocatalytic performance has been greatly improved. The composite shows an initial potential of -0.17 V (vs SCE) and the limiting current density is 2.5 mA·cm(-2). Besides, the number of transfer electrons in ORR is 3.7, which is nearly comparable to that of commercial Pt/C (20%). Moreover, it shows remarkable durability and better resistance toward methanol crossover in ORR. It is thought that WS2/RGO has better electronic conductivity and WS2can play a synergistic catalytic effect with RGO. As a result, the novel WS2/RGO material as a non noble metal catalyst in fuel cells is considerably promising.
Keywords:hydrothermal method; tungsten disulfide; reduced graphene oxide; fuel cell; oxygen reduction reaction
收稿日期:2015-12-07。收修改稿日期:2016-01-22。
DOI:10.11862/CJIC.2016.073
中图分类号:TB333
文献标识码:A
文章编号:1001-4861(2016)04-0633-08
