AlCl3(ZnCl2, MgCl2)对Sm2O3的氯化效果及电化学行为
2016-05-03颜永得张密林纪德彬李恩雨
薛 云 杨 雪 颜永得 张密林 纪德彬 韩 伟 李恩雨
(哈尔滨工程大学,哈尔滨 150001)
AlCl3(ZnCl2, MgCl2)对Sm2O3的氯化效果及电化学行为
薛云杨雪颜永得*张密林纪德彬韩伟李恩雨
(哈尔滨工程大学,哈尔滨150001)
摘要:研究了AlCl3(ZnCl2、MgCl2)对Sm2O3的氯化效果以及Sm2O3在LiCl-KCl-AlCl3(ZnCl2、MgCl2)熔盐体系中的电化学行为。在LiCl-KCl-Sm2O3熔盐中加入AlCl3(ZnCl2、MgCl2)后,ICP测量结果表明,AlCl3体系中Sm离子的浓度最高,并且在923 K时达到最大值;固相反应表明,AlCl3氯化Sm2O3生成SmCl3,而Sm2O3和ZnCl2(MgCl2)反应生成SmOCl。电化学行为表明,AlCl3体系中观察到了两种Al-Sm的合金峰,而ZnCl2体系中只观察到Zn-Sm金属间化合物的形成峰,MgCl2体系中没有形成合金。在-6.25 A· cm(-2)下,W电极上恒电流电解2 h获得了Al-Li-Sm合金,经XRD分析,合金为Al2Sm相。
关键词:LiCl-KCl-Sm2O3熔盐;电化学行为;氯化效果;铝钐合金
国家自然科学基金(No.91226201,91326113,51574097),中国和黑龙江博士后科研启动及特别资助科学基金(No.LBH-Q15019,LBH-Q15020, LBH-TZ0411),中央高校基本科研业务经费(No.HEUCFD1415)和黑龙江省普通高等学校和哈尔滨工程大学青年学术骨干支持计划项目(No.1253G016, HEUCFQ1415)资助。
*通信联系人。E-mail:y5d2006@hrbeu.edu.cn
0前 言
随着核能的广泛应用,核燃料的后处理已成为制约核能可持续发展的关键问题之一。核燃料后处理过程中既要最大限度地回收利用铀和钚,又要从裂变产物中分离出长寿命高放射性核素。分离和嬗变是处置长寿命高放废物的重要方法[1]。然而在核燃料中,稀土元素钐、铕和钆等的热中子俘获截面非常高,被称作中子毒剂,在裂变和嬗变过程中大量地消耗中子,进而降低了锕系元素俘获中子的效率,认为是有害的裂变产物。因此,在重新制造铀、钚核燃料和嬗变次锕系元素之前,必须将稀土元素从锕系元素中分离出来。
由于钐是最丰富的裂变产物且对中子有较强毒性作用,故引起了学者们的广泛关注,因此稀土钐的电化学性能得到了广泛的研究。例如Cordoba等[2]研究了不同温度下Sm在共晶LiCl-KCl熔盐中的电化学性质。他们发现,Sm(II)/Sm的反应在惰性电极上是不可能实现的,因为Sm2+离子还原为稀土金属的析出电位比Li+离子的析出电位更负。Kushkhov[3]等人研究了在823 K时Sm离子在不同电极上KCl-NaCl-CsCl熔盐中的电化学还原,并计算了Sm离子扩散系数。Chamelot[4]等研究了SmF3在Mo和Ni电极上熔融LiF-CaF2介质中的电化学行为。结果表明,Sm在Mo电极上在氟化物熔盐中不可能还原为金属钐。然而,SmF3可以在镍电极上还原形成Sm-Ni合金(Sm3Ni、SmNi3和SmNi2),这是由于Sm在Ni阴极上的欠电位沉积(under potential deposition,UPD)造成的。Sm属于变价稀土,在熔盐体系中存在两种稳定的氧化态,即Sm和Sm。由于这种变价特性,工业上无法通过熔盐电解在惰性电极上直接提取金属Sm。所以一些研究学者尝试通过活性阴极使Sm的析出电位正移来达到提取Sm的目的。Castrillejo等[5]证明了在共晶LiCl-KCl熔盐中Al阴极上提取Sm的可行性。Shi等[6-7]在LiCl-KCl-SmCl3熔盐中,研究了用液态Zn和固态Al阴极提取Sm,在Al阴极上恒电位和恒电流电解提取效率分别为88.7%和94.0%。Yan等[8]在LiCl-KCl-ZnCl2体系中恒电位电解提取Sm,其提取效率达到99.87%。
俄罗斯很早就开始研究以氧化物乏燃料为处理对象的熔盐电解法后处理技术。该流程采用氯化物熔盐体系,具有较高还原性的金属可被锕系氯化物氧化,形成金属氯化物,通过电沉积锕系元素氧化物,实现回收锕系元素[9]。这种传统的处理是要先进行氯化然后再电解,而如果在不引入杂质的情况下,有一种氯化剂直接可以处理MOX燃料就简化了过程。关于氯化剂,通常使用Cl2或HCl气体[10],也可以采用ZrCl4[11],近几年有些研究者利用AlCl3、ZnCl2和MgCl2作为氯化剂,这是因为氯化铝、氯化锌和氯化镁具有特殊的晶体结构,在高温熔融中可以与氧化稀土作用生成氯化稀土,而Al、Zn和Mg离子直接和稀土离子共还原达到提取稀土元素的目的,不引入杂质。我们小组在LiCl-KCl熔盐中,借助AlCl3的氯化作用成功从氧化稀土中的提取Yb[12]、Pr[13]、Sm[14]和Tm[15]等镧系元素,并评估了Yb的提取效率(98.0%)。Shi等[16]同样用AlCl3氯化ThO2生成可溶的ThCl4,在Al电极上通过共还原法实现对锕系元素Th的提取。Shi等[17]在LiCl-KCl-ZnCl2-Nd2O3体系研究了氯化锌氯化氧化钕使其以氯化钕的形式出现,并且Nd在锌上通过欠电位沉积形成了Zn-Nd合金。Wei等[18]在制备Mg-Li-Gd合金的研究中表明,在LiCl-KCl熔盐体系中Gd2O3几乎不溶,而在熔盐中加入MgCl2后却有一定的溶解度,并且Gd2O3的溶解度随着温度的升高而增大。Zhang等[19]通过热力学数据库计算了不同温度下MgCl2和Dy2O3反应的标准吉布斯能,证明了MgCl2的氯化作用,然后在LiCl-KCl-MgCl2-Dy2O3熔盐中借助MgCl2的氯化作用达到提取Dy的目的。而没有系统比较这三种氯化剂对同一种稀土氧化物的氯化效果的文献,因此,本文研究了AlCl3(ZnCl2、MgCl2)对Sm2O3的氯化效果及Sm2O3在LiCl-KCl-AlCl3(ZnCl2、MgCl2)熔盐体系中的电化学行为,并采用恒电流电解提取Sm。
1 实验部分
1.1实验仪器
实验采用WP-C80型热电偶测量熔融盐的温度,且在Ar气保护下进行。循环伏安法、方波伏安法和开路计时电位法等电化学性能测试均采用Autolab 302N电化学工作站,采用TTR-III Rigaku 型X射线衍射仪(XRD)测试合金相的组成,测试用Cu Kα辐射(λ=0.154 18 nm),管电压为40 kV,电流为40 mA。采用IS Intrep-id II XSP型电感耦合等离子体发射光谱仪(ICP)对熔盐样品成分进行分析。
1.2实验过程
在523 K下,将混合的LiCl-KCl盐(质量比1∶1)置于马弗炉中真空干燥48 h,目的是除去熔盐中水分。实验采用三电极体系,以Mo丝(直径1.0 mm,纯度99.99%)为工作电极,对电极采用光谱纯石墨棒(直径6.0 mm,纯度为99.99%),电极电势的测量均是以Ag/AgCl(1%AgCl,质量分数)为参比电极。实验前将参比电极用SiC砂纸打磨光亮,之后置于稀盐酸溶液中浸泡5 min,再将其放置在丙酮中超声清洗。石墨棒使用前经5%的稀盐酸煮沸1 h后,再用去离子水进行清洗后置于鼓风干燥箱中干燥备用。
首先测量Sm2O3在LiCl-KCl-AlCl3(ZnCl2、MgCl2)熔盐体系中的溶解度。在不同熔盐的坩埚中加入等量Sm2O3,反应1 h后,取少量配置成溶液,然后进行ICP分析。为了验证其氯化效果,又对其固相产物进行XRD分析。在空白LiCl-KCl熔盐中恒电位(-2.1 V)电解3 h,除去其中可能存在的金属杂质,然后向LiCl-KCl-Sm2O3熔盐中分别加入AlCl3、ZnCl2和MgCl2测其电化学行为。最后,采用恒电流法电解提取Sm。
2结果与讨论
2.1 Sm2O3在LiCl-KCl-AlCl3(ZnCl2、MgCl2)熔盐
体系中的溶解度
图1是不同温度下Sm2O3在LiCl-KCl-AlCl3(ZnCl2、MgCl2) 3种熔盐体系中的溶解度对比曲线图。分别在723、773、823、873、923和973 K温度下,等量的Sm2O3在3种熔盐体系中反应1 h后,取上清液进行ICP分析,分析结果如图1所示。从图中可以看出MgCl2和ZnCl2对Sm2O3的氯化效果十分微小,而AlCl3对Sm2O3的氯化效果比较明显,且随着温度的升高Sm2O3在LiCl-KCl-AlCl3熔盐体系中的溶解度增大,在923 K时达到最大。这一实验结果证实了AlCl3对Sm2O3的氯化效果远比ZnCl2和MgCl2要好。

图1 不同温度下Sm2O3在LiCl-KCl-AlCl3(MgCl2、ZnCl2)熔盐体系中的溶解度Fig.1 Concentrations of dissolved samarium in LiCl-KCl-Sm2O3-AlCl3(MgCl2、ZnCl2) melts at various temperatures
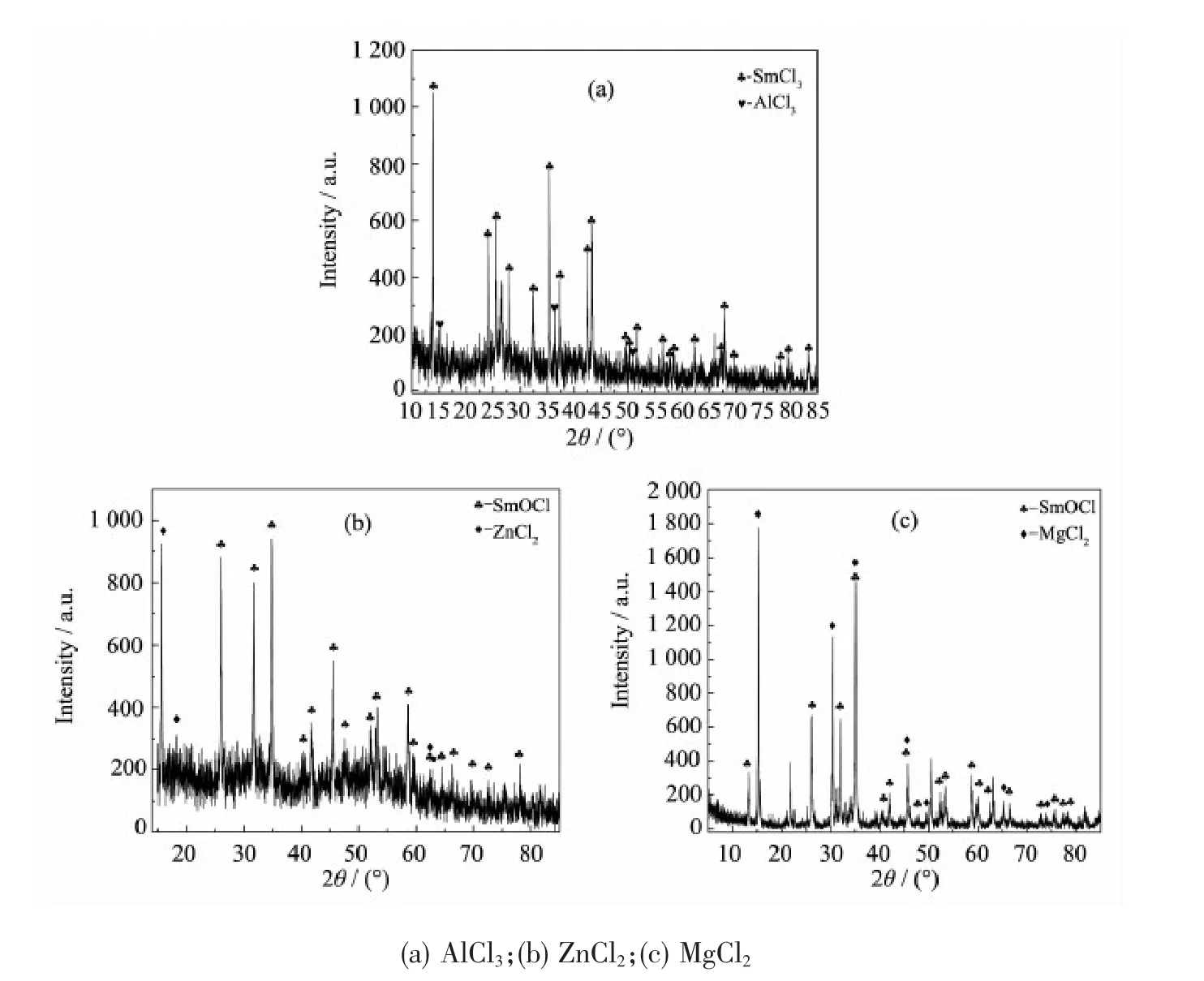
图2 85.71% AlCl3(ZnCl2、MgCl2)和14.29% Sm2O3混合物在773 K反应2.5 h后的XRD图Fig.2 XRD patterns of 85.71% AlCl3(ZnCl2、MgCl2) and 14.29% Sm2O3mixture after reaction 2.5 h at 773 K
2.2 AlCl3、ZnCl2、MgCl2对Sm2O3氯化机理

Papatheodorou等[20]已经报道了反应因此,AlCl3能将Sm2O3氯化成SmCl3。不同的温度下溶解Sm离子的浓度(见图1)也证明这一结论。从热力学数据计算可得到,在773 K的实验温度下,该反应的吉布斯自由能是-431.78 kJ·mol-1,这意味着这个反应在实验的温度下能自发进行。为了验证AlCl3对Sm2O3氯化效果,取85.71 % AlCl3和14.29 % Sm2O3(质量分数)的混合物在773 K下反应2.5 h后冷却到室温,再对其进行XRD表征,结果如图2a所示。图2a除了含有大量的SmCl3的特征衍射峰,还有少量的AlCl3的特征衍射峰,这说明AlCl3过量,AlCl3与Sm2O3充分反应。
对于下列反应

根据热力学分析软件HSC5.0,在773 K时计算其吉布斯自由能是15.53 kJ·mol-1,故此反应不能发生。为了验证ZnCl2对Sm2O3氯化效果,我们采取同样的方法再对其进行XRD表征分析。结果表明,图2b除含有SmOCl的特征衍射峰外,还发现少量的ZnCl2的特征衍射峰,这表明混合物中ZnCl2是过量的。由此可以看出发生如下反应
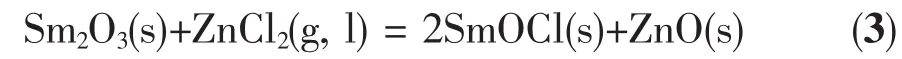
根据热力学分析软件HSC5.0,可以计算在773 K时,上述反应的吉布斯自由能为-93.61 kJ·mol-1,这就说明此反应是可以实现的。图2c中除了有大量的SmOCl的特征衍射峰外,也有少量的MgCl2的特征衍射峰,这同样表明MgCl2与Sm2O3作用生成SmOCl。
XRD分析结果表明,AlCl3(ZnCl2、MgCl2)和Sm2O3混合物加热到773 K后,有新的化合物SmCl3(SmOCl)生成,证明AlCl3、ZnCl2和MgCl2对Sm2O3有氯化作用,且AlCl3的氯化作用比较强,而ZnCl2和MgCl2的氯化作用较弱,对Sm2O3氯化不完全,生成SmOCl化合物。

图3 773 K下,Sm2O3(1.0%)在不同的氯化物熔盐体系在钼电极(S=0.322 cm2)上的循环伏安曲线: (a) LiCl-KCl-AlCl3(2.0%);(b) LiCl-KCl-ZnCl2(2.0%); (c) LiCl-KCl-MgCl2(2.0%)Fig.3 Cyclic voltammograms obtained on a Mo electrode (S=0.322 cm2) in the different molten salt system: (a) LiCl-KCl-AlCl3(2.0%); (b) LiCl-KCl-ZnCl2(2.0%); (c)LiCl-KCl-MgCl2(2.0%) after the addition of Sm2O3(1.0%) at 773 K, scan rate: 0.1 V·s-1
2.3 Sm2O3在不同LiCl-KCl熔盐体系的电化学行为的研究
2.3.1循环伏安法
图3是773 K下,Mo电极(S=0.322 cm2)上LiCl-KCl-Sm2O3(1.0%)熔盐体系中加入2.0% AlCl3(ZnCl2、MgCl2)后的循环伏安曲线对比图,从图3a中可以看出,在熔盐体系中添加了2.0% AlCl3之后,检测到了4对还原/氧化峰A/A′、B/B′、C/C′和E/E′。峰电位位于-0.98 V的还原峰A,对应Al还原为金属Al的过程,相应的氧化峰A′对应于金属Al的氧化过程。峰电位位于-1.71和-1.96 V的还原峰B和C,对应于Al-Sm两种金属间化合物的析出,相应的氧化峰B′和C′对应于金属间化合物的溶解。还原峰E对应于Li的还原过程,相应的氧化峰E′对应于金属Li的氧化过程,图中没有观察到Sm的还原氧化峰,这是因为Sm还原为Sm的过程是分步进行的,其第二步的还原电位比锂的还原电位还要负,锂的还原电流将其遮盖,所以观察不到,而第一步还原的还原电位为-0.9 V左右,和Al的还原电位接近,被Al的还原电流所遮盖。
从图3b可知,在LiCl-KCl-Sm2O3中添加了2.0% ZnCl2之后,曲线中除了出现Li的还原/氧化峰E/E'和Zn的还原/氧化峰A/A′之外,还出现了3个很微小的还原峰B、C、D,这对应于Zn-Sm的金属间化合物的形成,但没有观察到相对应的氧化峰,这是由于ZnCl2对Sm2O3的氯化作用较小,熔盐体系中的Sm离子的浓度较低导致的。
从图3c可知,在LiCl-KCl-Sm2O3中添加了2.0% MgCl2之后,曲线中除了出现Li的还原/氧化峰E/E′和Mg的还原/氧化峰B/B′之外,还可以观察到还原/氧化峰A/A′和还原峰C,还原峰C对应于Mg-Li合金的形成峰[21-22],A/A′对应着Sm/Sm还原氧化过程[23],说明MgCl2对Sm2O3有氯化作用,但没有观察到Mg-Sm金属间化合物的形成峰,这是由于MgCl2对Sm2O3的氯化作用很小,熔盐体系中可以自由移动Sm离子很少。
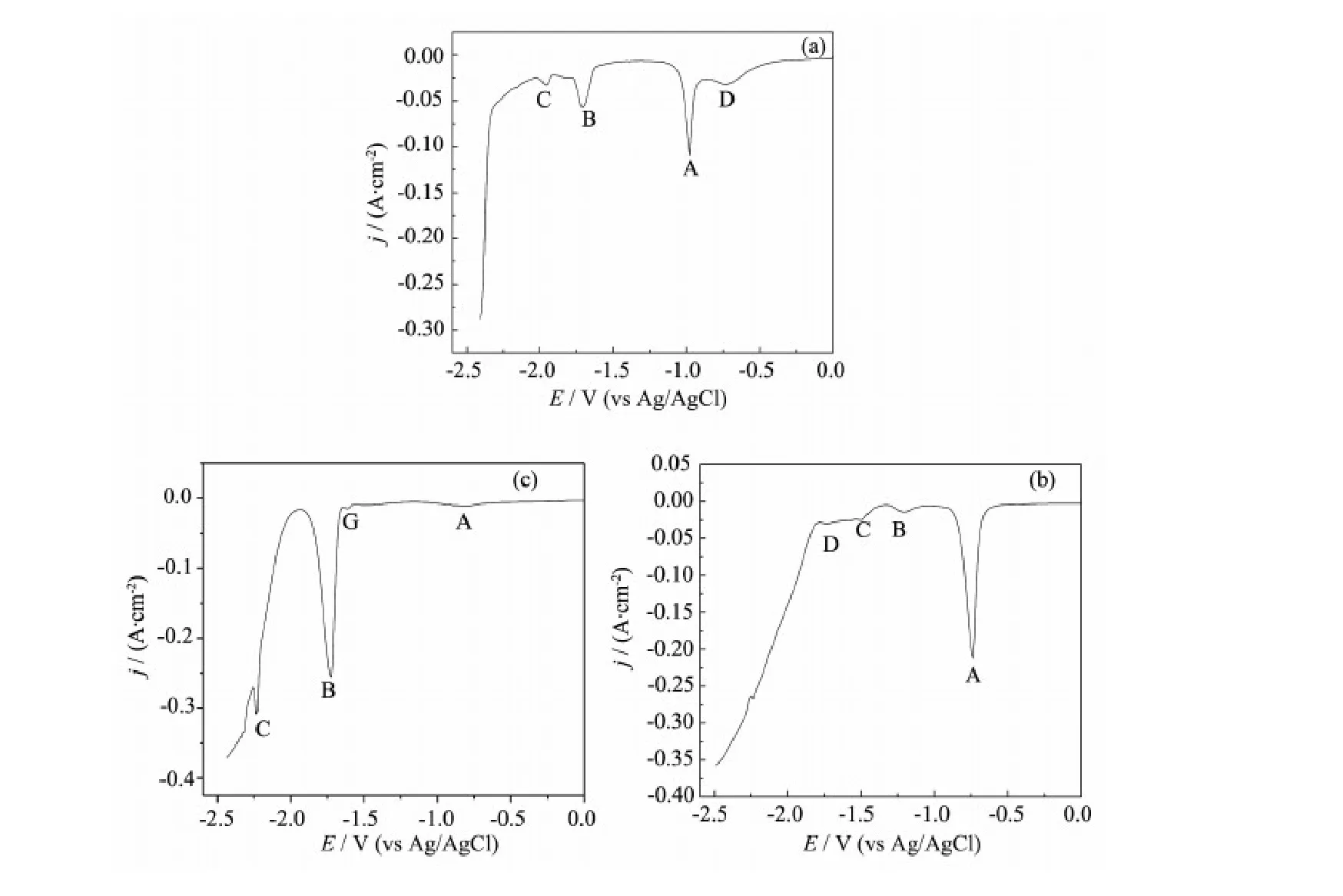
图4 773 K下,Sm2O3(1.%)不同LiCl-KCl熔盐体系在钼电极(S=0.322 cm2)上的方波伏安曲线,脉冲高度: 100 mV;电位阶跃: 5 mV;频率:10 Hz; (a) AlCl3(2.0%); (b) ZnCl2(2.0%); (c) MgCl2(2.0%)Fig.4 Square wave voltammogram obtained on a Mo electrode (S=0.322 cm2) in the different molten salt systems: (a) LiCl-KCl-AlCl3(2.0%); (b) LiCl-KCl-ZnCl2(2.0%); (c) LiCl-KCl-MgCl2(2.0%), after the addition of Sm2O3(1.0%) at 773 K, pulse height: 100 mV; potential step: 5 mV; frequency: 10 Hz
通过循环伏安曲线的对比,我们发现Al-Sm合金形成峰电流密度稍大一些,这证明AlCl3对Sm2O3有氯化作用,Sm2O3被氯化为SmCl3并在熔盐中与Al离子发生共沉积生成金属间化合物,图3b中只有Zn-Sm合金形成峰且不明显,而Mg-Sm合金形成峰并未观察到,这就说明AlCl3对Sm2O3的氯化效果比ZnCl2和MgCl2对Sm2O3的氯化效果要好,我们将进一步采用方波伏安法和开路计时电位法对循环伏安法得到的实验结果进行验证。
2.3.2方波伏安法
与循环伏安法相比,方波伏安法有更高的灵敏度和分辨率,图4为Sm2O3在不同LiCl-KCl-AlCl3(ZnCl2、MgCl2)熔盐体系中的方波伏安曲线。由图4a可见,方波伏安曲线中观察到4个峰A、B、C和D,A的峰电位位于-0.98 V,对应于Al还原为Al的过程;B和C的峰电位分别位于-1.71和-1.96 V,分别对应着Al-Sm两种金属间化合物的析出;当电位为-2.32 V时电流密度急剧增加,这是由于Li的沉积引起的。对比图3a可以发现,在Al的还原峰A之前还有一个还原峰D,峰电位为-0.73 V,这对应的是Sm还原为Sm的过程,这个还原峰在循环伏安曲线中并没有检测到,这是因为方波伏安法的灵敏度高,电极反应的信号更容易被检测到。
在图4b中,峰B、C和D分别对应着3种Zn-Sm金属间化合物的形成峰。图4c可以观察到一个微弱的电流信号A和3个峰B、C、G,信号A对应于Sm还原Sm的过程,峰B对应于Mg还原Mg的过程,峰C对应于Mg-Li合金的形成。观察到方波伏安曲线比循环伏安曲线中多了一个峰G,这是由于镁在钼电极上的欠电位沉积引起的,在文献[24]中也观察到了类似的现象。方波伏安曲线中也没有观察到Mg-Sm金属间化合物的形成峰,这是由于MgCl2对Sm2O3的氯化作用较弱,熔盐体系中的Sm离子的浓度非常低导致的。方波伏安曲线观察到的结果与循环伏安曲线观察到的结果相同。
2.3.3开路计时电位法
图5是773 K下,Mo电极(S=0.322 cm2)上,LiCl-KCl-Sm2O3(1.0%)熔盐体系加入AlCl3(ZnCl2、MgCl2)后,恒电位(-2.5 V)电解一定时间(10、5和10 s)后测得的开路电位随时间的变化关系曲线。图5a中,可以观测到5个电位平台。电位平台1位于-0.76 V,对应于Sm/Sm的平衡电极电位;电位平台2位于-0.96 V,对应于Al/Al的平衡电极电位;电位平台3和4分别位于-1.57和-1.78 V,对应着Al-Sm两种金属间化合物的形成;电位平台5位于-2.35 V,对应于Li/Li的平衡电位。
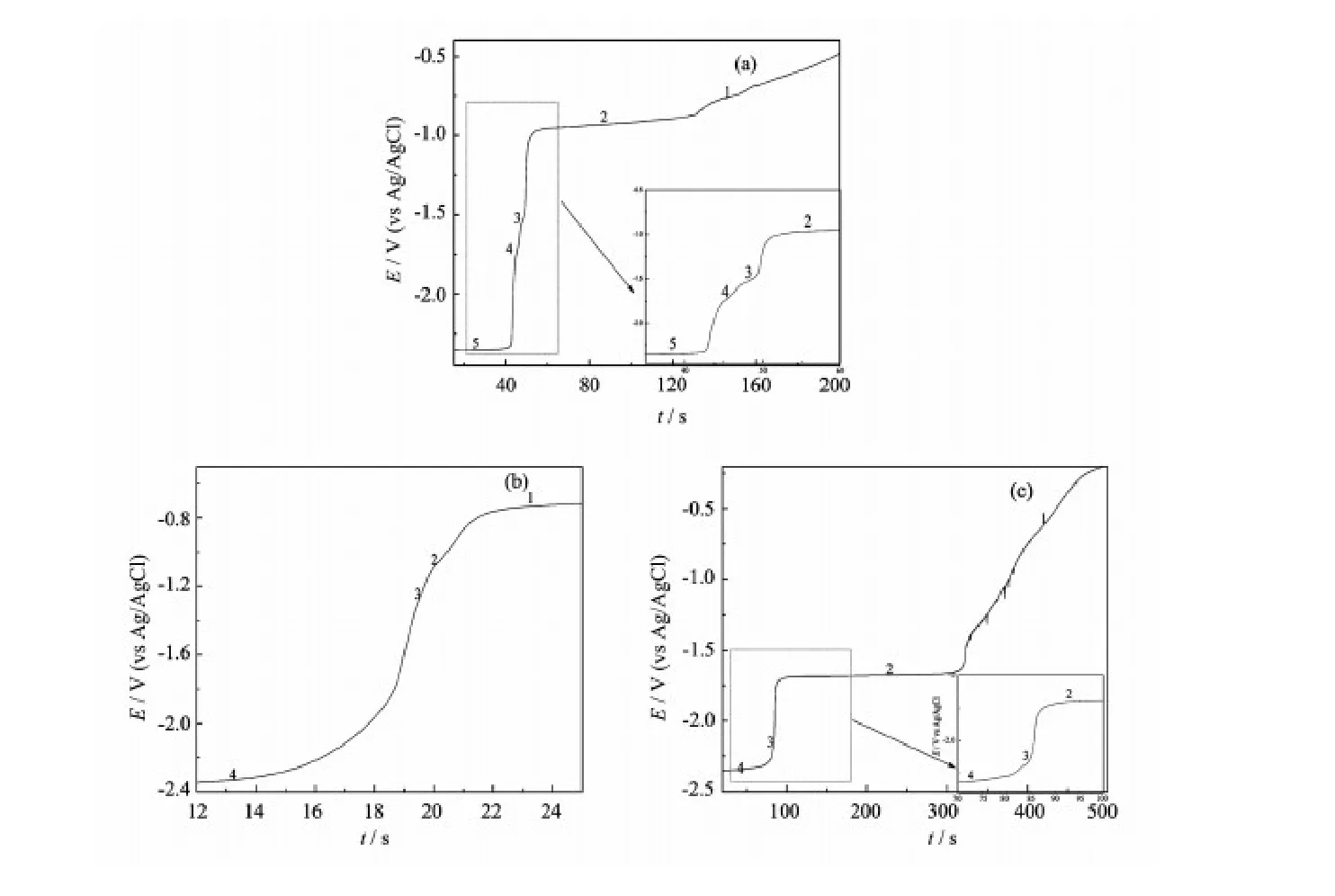
图5 773 K下,Sm2O3(1.0%)不同LiCl-KCl熔盐体系在钼电极(S=0.322 cm2)上的开路计时电位曲线,沉积电位: -2.5 V;(a) AlCl3(2.0%); (b) ZnCl2(2.0 %); (c) MgCl2(2.0%)Fig.5 Open-circuit chronopotentiogram for a Mo electrode (S=0.322 cm2) in the different molten salt systems: (a) LiCl-KCl-AlCl3(2.0%); (b) LiCl-KCl-ZnCl2(2.0%); (c) LiCl-KCl-MgCl2(2.0%), after the addition of Sm2O3(1.0%) at 773 K, deposition potential: -2.5 V
2.4恒电流电解提取Sm
由于在低温下制备的合金通常呈渣状,高温有利于合金的聚集,本文在973 K下,在钼电极(S=0.322 cm2)上LiCl-KCl-AlCl3(15%)-Sm2O3(2%)熔盐体系中进行恒电流电解来制备Al-Sm合金,电解电流为-1.95 A,电解时间为2 h。为了研究合金的相组成,对所得合金样品进行了X射线衍射测试,由图6可以看出,合金是由Al2Sm相组成。这说明采用Sm2O3作为原材料同样可以达到提取Sm的目的。
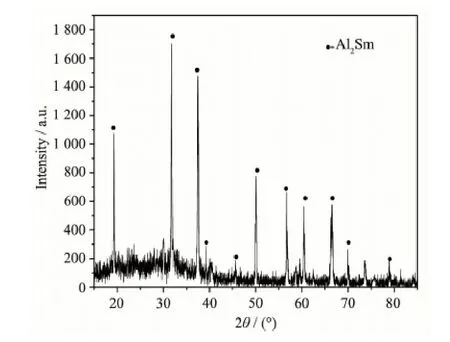
图6 在W电极上,LiCl-KCl-AlCl3(15%)-Sm2O3(1.5%)熔盐体系中恒流电解得到样品的XRD图,其中实验温度973 K,电流密度-6.25 A·cm-2,电解时间2 hFig.6 XRD pattern of the deposits obtained under galvanostatic electrolysis at a W (S=0.322 cm2) electrode in LiCl-KCl-AlCl3(15%)-Sm2O3(1.5%) melts at 973 K at -6.25 A·cm-2for 2 h
3结 论
通过液相反应、固相反应和熔盐中电化学反应研究了AlCl3、ZnCl2和MgCl2对Sm2O3的氯化效果。在含有LiCl-KCl-AlCl3-Sm2O3熔盐的液相反应中Sm离子的浓度最高且随温度的升高而增加,在923 K时达到最大。固相反应结果表明, AlCl3和Sm2O3反应生成SmCl3,而ZnCl2、MgCl2和Sm2O3反应生成SmOCl,这证明AlCl3对Sm2O3的氯化效果最好。773 K下,通过循环伏安法、方波伏安法和开路计时电位法研究了Sm2O3在LiCl-KCl-AlCl3(ZnCl2、MgCl2)熔盐体系中的电化学行为及其氯化效果。结果表明在LiCl-KCl-AlCl3-Sm2O3熔盐体系中,能够观察到2 种Al-Sm金属间化合物的电化学信号。而在LiCl-KCl-ZnCl2/MgCl2-Sm2O3熔盐体系中,则观察不到明显的Zn/Mg-Sm金属间化合物的电化学信号。由此可以证明,在液相反应中,AlCl3对Sm2O3的氯化作用明显好于ZnCl2和MgCl2。最后在LiCl-KCl-AlCl3-Sm2O3熔盐体系中恒电流电解提取Sm,并采用XRD对得到的沉积物进行表征,结果表明沉积物中主要包含Al2Sm相。
参考文献:
[1] ZHANG Yu-San(张玉山). Nucl. Phys. Rev.(原子核物理评论), 1997,14(4):251-258
[2] Cordoba G, Caravaca C. J. Electroanal. Chem., 2004,572(1): 145-151
[3] Kushkhov K B, Vindizheva M K, Karashaeva R A, et al. Russ. J. Electrochem., 2010,46(6):691-701
[4] Massot L, Chamelot P, Taxil P. Electrochim. Acta, 2005,50 (28):5510-5517
[5] Castrillejo Y, Fernández P, Medina J, et al. Electrochim. Acta, 2011,56(24):8638-8644
[6] Liu Y L, Yuan L Y, Ye G A, et al. Electrochim. Acta, 2014, 120:369-378
[7] Liu K, Liu Y L, Yuan L Y, et al. Electrochim. Acta, 2014, 129:401-409
[8] Xue Y, Zhou Z P, Yan Y D, et al. RSC Adv., 2015,5(29):23114-23121
[9] LIU Li-Jun(刘丽君). Radiat. Prot.(辐射防护), 2008,28(3): 184-188
[10]OUYANG Ying-Gen(欧阳应根). China Nuclear Science and Technology Report(中国核科技报告),2001(00):367-381
[11]Sakamura Y, Kurata M, Usami T, et al. Actinide and Fission Product Partitioning & Transmutation Eighth Information Exchange Meeting, Las Vegas, 2004:229-230
[12]Li X, Yan Y D, Zhang M L, et al. J. Radioanal. Nucl. Chem., 2014,299(1):657-664
[13]Tang H, Yan Y D, Zhang M L, et al. Electrochim. Acta, 2013,88:457-462
[14]XUE Yun (薛云), WANG Qian (王倩), Yan Yong-De(颜永得), et al. Chinese J. Inorg. Chem. (无机化学学报), 2013,29(9):1947-1951
[15]Li X, Yan Y D, Zhang M L, et al. J. Nucl. Mater., 2014,452 (1):197-204
[16]Liu Y L, Yan Y D, Han W, et al. RSC Adv., 2013,3(45): 23539-23547
[17]SHI Xiao-Wei(石晓微). Thesis for the Masterate of Harbin Engineering University (哈尔滨工程大学硕士论文). 2012.
[18]WEI Su-Qu(魏树权), ZHANG Mi-Lin(张密林), HAN Wei(韩伟), et al. Acta Metall. Sinica(金属学报), 2011,47(2): 173-178
[19]Zhang M, Yang Y, Han W, et al. J. Solid State Electrochem., 2013,17(10):2671-2678
[20]Papatheodorou G N, Kucera G H. Inorg. Chem., 1979,18(2): 385-389
[21]Martnez A M, Bφrresen B, Haarberg G M, et al. J. Electrochem. Soc., 2004,151(7):C508-C513
[22]Martínez A M, Bφrresen B, Haarberg G M, et al. J. Appl. Electrochem., 2004,34(12):1271-1278
[23]Han W, Wang F, Tian Y, et al. Metall. Mater. Trans. B, 2011,42(6):1376-1382
[24]Bφrresen B, Haarberg G M, Tunold R. Electrochim. Acta, 1997,42(10):1613-1622
Chlorination Effects of Sm2O3by AlCl3(ZnCl2, MgCl2) and Electrochemical Behavior
XUE Yun YANG Xue YAN Yong-De*ZHANG Mi-Lin JI De-Bin HAN Wei LI En-Yu
(Harbin Engineering University, Harbin 150001)
Abstract:The chlorination effects of Sm2O3by AlCl3(ZnCl2、MgCl2) and the electrochemical behavior of Sm2O3were studied in LiCl-KCl-AlCl3(ZnCl2、MgCl2) melts. After the addition of AlCl3(ZnCl2, MgCl2) in LiCl-KCl-Sm2O3melt, the ICP measurements showed that the concentration of Smwas the highest in AlCl3system, and reached a maximum at 923 K. The solid phase reaction showed that Sm2O3was chloridized by AlCl3to SmCl3, while the reaction product between Sm2O3and ZnCl2(MgCl2) was SmOCl. The electrochemical behaviors indicated that two kinds of Al-Sm alloy peaks were observed in the AlCl3system, and only the reduction peak of Zn-Sm intermetallic compound was observed in ZnCl2melt, and there is no alloy formed in the MgCl2system. The X-ray diffraction (XRD) results showed that the deposits obtained by galvanostatic electrolysis at -6.25 A·cm(-2)on W electrodes was Al2Sm phase.
Keywords:LiCl-KCl-Sm2O3melt; electrochemical behavior; chlorination; Al-Sm alloy
收稿日期:2015-08-29。收修改稿日期:2015-12-02。
DOI:10.11862/CJIC.2016.087
中图分类号:O614.111; O614.22; O614.3+1
文献标识码:A
文章编号:2001-4861(2016)04-0575-08
