VZV糖蛋白 E基因胞外域的原核表达及其兔抗血清的制备
2016-04-27伊兴旭陈敬贤王明丽
伊兴旭,陈敬贤,甘 霖,王明丽
◇基础医学研究◇
VZV糖蛋白 E基因胞外域的原核表达及其兔抗血清的制备
伊兴旭1,陈敬贤2,甘 霖2,王明丽2
目的采用原核表达系统表达水痘-带状疱疹病毒(VZV)糖蛋白 E(gE)基因的胞外域,将纯化后的目的蛋白免疫新西兰家兔,制备该蛋白特异性抗血清。方法构建原核表 达 质 粒 gE-pET-32a(+),测 序 后 将 其 转 化 至 E.coli BL21,以异丙基硫代 β-D-半乳糖苷(IPTG)诱导,获得 VZV gE融合蛋白。采 用 SDS-PAGE电泳、Western blot法鉴定其特异性,利用 Ni2+-NTA柱对 gE蛋白进行纯化,复性后免疫新西兰家兔,获得兔抗 VZV gE血清;采用间接免疫荧光、Western blot法和 ELISA法检测该血清的特异性和效价。结果成功诱导表达出 VZV gE融合蛋白,SDS-PAGE鉴定提示其主 要 为 包 涵体表达,浓 度 约 为 3.01 mg/m l。蛋 白 经Ni2+-NTA柱 纯化后,纯度约 为 90%。Western blot法 显 示,经变性、复性后的该融合蛋白有良好的免疫反应性。用该蛋白免疫新西兰家兔后获得兔抗 VZV gE血清。ELISA分析显示,该兔抗血清的效价为 1∶6 400。结论成功构建了高效表达 VZV gE蛋白的原核表达系统,获得较高纯度的 gE蛋白,可以作为 VZV亚单位疫苗的候选抗原,制备了特异性及效价均较高的兔抗 VZV gE多克隆抗体,为 VZV感染的临床诊断及治疗提供了重要的实验工具。
水痘 -带状疱疹病毒;原核表达;融合蛋白;兔抗血清
水 痘 -带 状 疱 疹 病 毒 (varicella-zoster virus,VZV)即人类疱疹病毒 3型,属于疱疹病毒 α亚科,为 DNA病毒。病毒主要通过呼吸道分泌物和密切接触传播,可引发两种不同临床症状的疾病,水痘和带状疱疹[1-2]。VZV糖蛋白 E(glycoprotein E,gE)是一种晚期结构蛋白,由 ORF68基因编码,含有623个氨基酸(amino acid,AA),其 N端为 544 AA的亲水胞外区,C端是 17 AA的跨膜疏水区和 62AA的胞内区[3-4]。在 VZV颗粒的表面和宿主细胞的细胞膜和胞质内均含有大量的 gE,其在病毒的不同成熟阶段以不同的含糖多肽形式存在,是体液免疫和细胞免疫应答的重要靶点[5-7]。该实验获得较高纯度的 gE蛋白,可以作为 VZV亚单位疫苗的候选抗原,获得了特异性及效价均较高的兔抗 VZV gE多克隆抗体,为 VZV的临床诊断和治疗提供了重要的实验工具。
1 材料与方法
1.1 材料
1.1.1 试剂和菌株 参考抗体:鼠抗 VZV gE单克隆抗体(美国 Abcam公司);异硫氰酸荧光素(fluorescein isothiocyanate,FITC)和 辣 根 过 氧 化 物 酶(horseradish peroxidase,HRP)标记的羊抗鼠 IgG抗体(北京中杉金桥生物技术有限公司);弗氏完全佐剂和弗氏不完全佐剂(美国 Sigma公司);Alexa Fluor488标记的山羊抗兔 IgG(H+L)抗体(美国 Invitrogen公司);E.coli BL21、pET-32a(+)菌株由本教研室保存(菌种库)。
1.1.2 细胞、病毒和新西兰家兔 人胚胎成纤维细胞(human embryo fibroblast,HF)为本教研室制备;Vero细胞购自美国 ATCC机构;VZV临床分离株为安徽医科大学第一附属医院皮肤科带状疱疹患者的皮肤水疱液中分离,经间接免疫荧光染色排除其他疱疹病毒,并经 DNA测序鉴定。HCMV(AD169株)、HSV-1(F株)、HSV-2(Sav株)均为本教研室保存(病毒库)。新西兰家兔购自安徽医科大学实验动物中心。
1.1.3 引物 参照文献[8]设计引物,上游引物(含Hind III酶切位点):5′-AGGCAGAAGCTTCCATGGGGACAGTTAATAAACCTGT-3′;下游引物(含 XholⅠ酶 切 位 点 ): 5′-AATAATCTCGAGGGCATATCGTAGAAGTGGTGACG-3′,由上海生工生物技术服务有限公司合成。
1.2 方法
1.2.1 重组质粒的的构建 以 VZV临床分离株的DNA为 模 板,PCR扩 增 VZV gE基 因 胞 外 域 (1 617bp),反应条件为 94℃预变性 5 min;94℃变性50 s;60℃退火 45 s;72℃ 延伸 2 min;共 35个循环,最后 72℃延伸 10min。将 PCR产物与 pET-32a(+)载体分别用 Hind III、Xhol I进行酶切,凝胶回收 DNA以后,由 T4 DNA连接酶连接 gE基因片段与 pET-32a(+)载体(5 900 bp),并转化至 E.coli BL21感受态细胞,涂 AMP抗性 LB板。挑取单个菌落,扩增培养后提取质粒,经酶切和测序鉴定。
1.2.2 融合蛋白的表达及鉴定 挑取单个重组表达菌落先于 LB/AMP培养基中少量培养,然后扩增培养,当光密度(optical density,OD)值约为 1.0时,加人 0.1%的异丙基硫代 β-D-半乳糖苷(isopropyl β-D-Thiogalactoside,IPTG),32℃ 诱导表达 5 h后,收集菌体,按常规方法超声裂解。分别收集上清液和菌体沉淀,通过 SDS-PAGE电泳分析菌体上清液和沉淀中 gE蛋白的表达情况,应用 Western blot对目的蛋白的特异性进行鉴定(设置空菌对照和空载体对照)。
1.2.3 融合蛋白的复性及纯化 以尿素终浓度为1 mol/L的包涵体洗涤液 (20 mmol/L Tris-HCl、100 mmol/L NaCl、5 mmol/L EDTA、1%Triton),4℃洗涤超声裂解的菌体沉淀 3次,1 h/次。12 000 r/min离心 15 min,收集包涵体于 I液(8 mol/L尿素、0.5 mol/L NaCl、20 mmol/L咪唑、20 mol/L PBS)中,4℃磁力搅拌下低速溶解。3 000 r/min离心 15 min,收集上清液,经 0.45μm滤膜滤过后进行柱上复性和纯化:① 样品上经 5个柱床体积 I液平衡的 Ni2+-NTA柱;② 用 Ⅱ 液 (20 mmol/L咪唑、0.5 mol/L NaCl、20 mol/L PBS)按线性梯度稀释尿素浓度至零,进行蛋白柱上复性;③ 以 500 mmol/L的咪唑缓冲液线性梯度洗脱目的蛋白;④ SDS-PAGE分析蛋白纯度,Lowry法测定蛋白浓度。
1.2.4 VZV gE兔抗血清的制备 取体重约为 3 kg的雄性新西兰家兔,免疫前 3 d耳缘静脉取血作为阴性对照。初次免疫时,每只家兔颈部和皮下多点注射 2 m l弗氏完全佐剂乳化的纯化抗原(蛋白浓度为 1.0 mg/ml)。第 3周以弗氏不完全佐剂乳化的纯化抗原进行免疫,方法同前。以后每隔1周均以耳缘静脉注射抗原纯品 1.0 mg,此法免疫 3次。免疫 5次后,耳缘静脉采血少许,采用 ELISA法分析其多克隆抗体效价。继后按常规方法心脏取血,分离血清,加入 50%甘油分装,-80℃保存备用。
1.2.5 VZV gE抗原制备的多克隆抗体效价测定
采用棋盘滴定确定的 gE抗原的最佳包被浓度 1.0 μg/ml包被 ELISA板,以系列稀释的兔抗血清(1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800、1∶51 200)作为一抗,设置 3个复孔,阴性对照组(免疫前兔血清)和空白对照组。ELISA法测定各组的 OD值,计算其 OD的平均值(¯x)和标准差(s),OD值 <¯x+3S判断为阴性;OD值 >¯x+3S判断为阳性。
1.2.6 间接免疫荧光和 Western blot法鉴定多克隆抗体的特异性 分别取 VZV临床分离株、HCMV AD169株感染实验室培养的单层 HF细胞,取 HSV-1(F株)、HSV-2(Sav株)接种至单层 Vero细胞,进行细胞爬片处理,置37℃、5%CO2温箱培养。待出现特征性细胞病变效应(cytopathic effect,CPE)后,以 1∶500稀释的兔抗血清作为一抗,1∶4 000稀释的 Alexa Fluor488标记山羊抗兔 IgG(H+L)作为二抗,采用间接免疫荧光法观察结果。
收集上述各病毒感染的细胞,加入蛋白上样缓冲液沸水浴 5 min,SDS-PAGE电泳分离目的蛋白,并转移至 PVDF膜上。用本研究制备的 VZV gE家兔免疫血清(1∶6 000)作为一抗,HRP标记的羊抗兔 IgG(1∶5 000)作为二抗,检测免疫血清中 gE多克隆抗体的特异性。
1.2.7 Protein A亲和层析纯化兔抗 VZV gE多克隆抗体 将兔抗血清,依次用 50%和 33%浓度的饱和硫酸铵进行粗纯。然后用 PBS缓冲液充分透析,收集上清液,经 Protein A亲和层析柱纯化兔抗VZV gE-IgG。Lowry法测定蛋白浓度,用 SDS-PAGE分析抗体纯度。
1.3 统计学处理采用 SPSS 18.0软件进行分析,定性数据以%表示,定量数据以 ¯x±s表示,采用配对t检验。
2 结果
2.1 重组质粒的鉴定琼脂糖凝胶电泳显示,PCR扩增及双酶切均获得预期的 1 617 bp VZV gE基因胞外域片段。见图1。目的基因片段经测序后,用BLAST法与 GenBank数据库比对,其序列与 VZV Dumas标准株基因组 DNA的 gE基因相应序列符合率为100%。
2.2 VZVgE融合蛋白的表达及鉴定SDS-PAGE
鉴定显示,重组菌体的沉淀样品在约 73 ku处出现清晰的特异性目的条带,与预测的蛋白相对分子质量一致,表明融合蛋白主要以包涵体形式存在。见图2A。
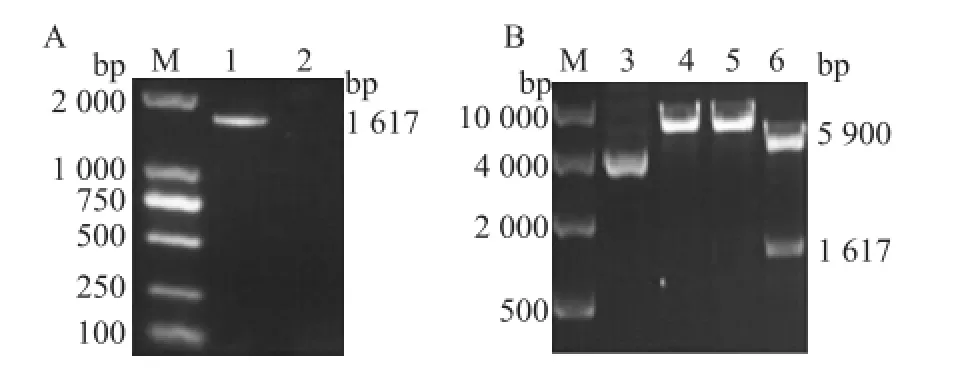
图1 VZV gE基因胞外域 PCR扩增和 gE-pET-32a(+)酶切鉴定A:VZV gE基因胞外域 PCR扩增图;B:重组质粒单、双酶切鉴定图;M:Marker;1:目的基因片段;2:阴性对照;3:重组质粒;4:重组质粒经 Xhol I酶切;5:重组质粒经 HandⅢ酶切;6:重组质粒经双酶切
2.3 VZVgE融合蛋白的复性、纯化及鉴定取纯化后的融合蛋白进行 SDS-PAGE鉴定,软件分析显示,其纯度约为 90%,见图2B。Lowry法测定融合蛋白的浓度为 3.01 mg/ml。应用鼠抗 VZV gE单克隆抗体进行 Western blot鉴定,结果可见约 73 ku的特异性目的条带。见图2C。
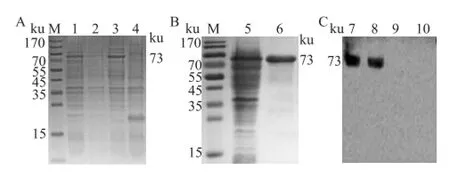
图2 VZV gE融合蛋白经 SDS-PAGE和 W estern blot特异性鉴定A:融合蛋白的可溶性 SDS-PAGE鉴定图;B:纯化后的融合蛋白 SDSPAGE鉴定图;C:融合蛋白的 Western blot分析;M:Marker;1:重组菌体破碎前总蛋白;2:重组菌体破碎后上清液;3:重组菌体破碎后包涵体;4:pET-32空载体对照;5:纯化前 gE融合蛋白;6:纯化后 gE融合蛋白;7:纯化前 gE融合蛋白;8:纯化后 gE融合蛋白;9:pET-32空载体对照;10:BL21空菌对照
2.4 兔抗 VZVgE多克隆抗体 ELISA法效价检测结果采用 ELISA法检测,结果显示,免疫前兔阴性血清 OD值为(0.253±0.037),当免疫后血清最大稀释度 达 1∶6 400时,其 OD值 为 0.382>¯x+ 3S,采用配对 t检验分析,与免疫前兔阴性血清组相比,差异有统计学意义(P<0.01),即多克隆抗体效价为1∶6 400。见图3。
2.5 兔抗 VZVgE多克隆抗体特异性鉴定采用间接免疫荧光法和 Western blot分析兔抗 VZV gE多克隆抗体的特异性。结果显示,gE蛋白免疫血清仅在感染 VZV的 HF细胞上呈现典型的绿色荧光,在其他疱疹病毒感染的细胞中都不出现荧光。见图4。感染了 VZV的 HF细胞蛋白所在的泳道,出现特异性目的条带,而其它疱疹病毒感染的细胞组均为阴性,表明所用 VZV gE重组蛋白制备的兔抗VZV gE多抗具有较高的特异性。见图5。

图3 ELISA法分析兔血清中 VZV gE抗体效价1:血清 1∶200稀释度;2:血清 1∶400稀释度;3:血清1∶800稀释度;4:血清 1∶1 600稀释度;5:血清 1∶3 200稀释度;6:血清 1∶6 400稀释度;7:血清 1∶12 800稀释度;8:血清 1∶25 600稀释度;与阴性血清组比较:**P<0.01
2.6 ProteinA亲和层析柱纯化兔抗 VZVgE多克隆抗体纯化的兔抗 VZV gE多克隆抗体经 SDSPAGE鉴定,结果显示两条目的条带,分别为 IgG抗体的轻链(25 ku)、重链(55 ku)。见图6。Lowry法测定抗体浓度为 5.51 mg/m l。
3 讨论
VZV基因组为约 124 884 bp的线性双链 DNA分子,包含一个约105 000 bp的独特长片段(UL)和5 400 bp的独特短片段(US),被约为 6 800 bp的末端和内部重复序列隔开。基因组共含有 72个开放读码框,除了编码与病毒复制、转录、包装、释放等生物活性相关的蛋白分子以及与宿主细胞相互作用的蛋白以外,还编码 gB、gC、gE、gH、gI、gK、gL和 gM共8种病毒糖蛋白,这些糖蛋白在病毒的成熟与包装方面发挥着极为重要的作用[9-10]。在处于恢复期的水痘和带状疱疹患者的血清中,VZV抗体主要是针对 gB、gH和 gE病毒的糖蛋白,尤其是以 gE为主要靶点诱导的体液免疫和细胞免疫,能够保护机体免受病毒攻击[11-12]。
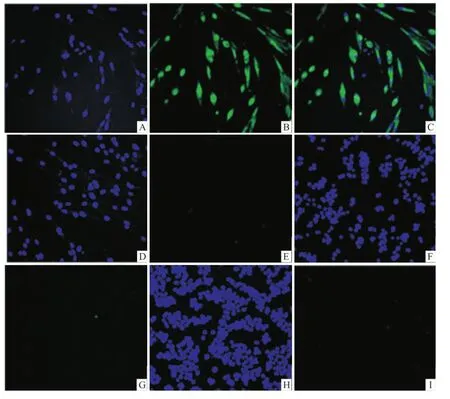
图4 间接免疫荧光鉴定多克隆抗体的特异性 ×400A:DAPI染色 VZV感染的 HF细胞核;B:VZV gE膜荧光染色;C:蓝绿荧光信号的叠加;D:DAPI染色 HCMV感染的 HF细胞核;E:HCMV荧光染色;F:DAPI染色 HSV-1感染 Vero细胞核;G:HSV-1荧光染色;H:DAPI染色 HSV-2感染 Vero细胞核;I:HSV-2荧光染色

图5 W estern blot分析多克隆抗体的特异性1:VZV感染的 HF细胞;2:HCMV感染的 HF细胞;3:HSV-1感染的 Vero细胞;4:HSV-2感染的 Vero细胞;5:正常 HF细胞;6:正常Vero细胞
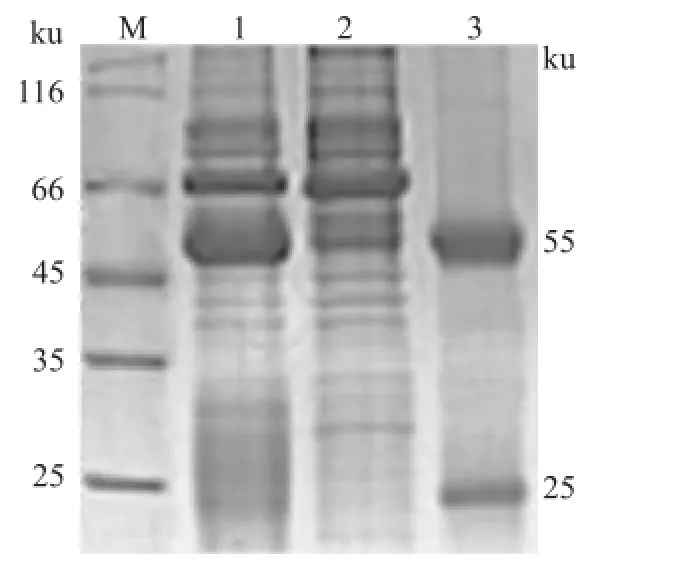
图6 Protein A亲和层析柱纯化兔抗 VZV gE的 IgG抗体经 SDS-PAGE鉴定M:Marker;1:纯化前兔抗 VZV gE的 IgG抗体;2:纯化过程中的流穿液;3:纯化后兔抗 VZV gE的 IgG抗体
融合蛋白经原核表达系统表达时,往往因缺乏二硫键的形成、糖基化和磷酸化等加工、修饰过程,最后表达的蛋白会以无活性或活性较低的包涵体形式存在。本实验中获得的融合蛋白并不是完整的成熟蛋白,因此实验中首先对包涵体进行了变性和复性处理,并通过镍柱对融合蛋白进行了亲和纯化。Western blot表明经变性和复性后的融合蛋白具有较好的免疫反应性。研究[13]表明,VZV gE单克隆抗体可以介导抗体依赖的细胞毒性,在有外源性补体的情况下能中和病毒的感染性。本实验中以纯化的融合蛋白为抗原,免疫新西兰家兔制备了特异性和效价较高的多克隆抗体,其是否具有中和病毒效应,还有待进一步采用中和试验来验证。
本研究成功构建了高效表达 VZV gE蛋白的原核表达系统,为今后构建 VZV gE蛋白的真核表达系统奠定了基础。目前,国内尚无商品化的 VZV抗体供应,而国外的 VZV抗体价格昂贵。制备的兔抗VZV gE多克隆抗体有很高的特异性而且效价高,这不仅为进一步制备 VZV gE单克隆抗体奠定了基础,也为 VZV感染的临床治疗和病毒感染的早期诊断提供了重要的实验工具。
[1]Gershon A A,Gershon M D,Breuer J,et al.Advances in the understanding of the pathogenesis and epidemiology of herpes zoster[J].JClin Virol,2010,48(Suppl1):S2-7.
[2]Fusco D,Krawitz P,LaRussa P,et al.VZV meningitis following varicella vaccine[J].JClin Virol,2010,48(4):275-7.
[3]Arvin A M,Oliver S,Reichelt M,et al.Analysis of the functions of glycoproteins E and Iand their promoters during VZV replication in vitro and in skin and T-cell xenografts in the SCIDmousemodel of VZV pathogenesis[J].Curr Top Microbiol Immunol,2010,342:129-46.
[4]伊兴旭,陈敬贤,甘 霖,等.水痘 -带状疱疹病毒糖蛋白 E胞外域基因的真核细胞稳定表达及其免疫反应性的初步研究[J].安徽医科大学学报,2015,50(3):259-61.
[5]Cole N L,Grose C.Membrane fusionmediated by herpesvirus glycoproteins:the paradigm of varicella-zoster virus[J].Rev Med Virol,2003,13(4):207-22.
[6]Mo C,Lee J,Sommer M,et al.The requirement of varicella zoster virus glycoprotein E (gE)for viral replication and effects of glycoprotein Ion gE in melanoma cells[J].Virology,2002,304(2):176-86.
[7]Grahn A,Studahl M,Nilsson S,et al.Varicella-zoster virus(VZV)glycoprotein E is a serological antigen for detection of intrathecal antibodies to VZV in central nervous system infections,without cross-reaction to herpes simplex virus 1[J].Clin Vaccine Immunol,2011,18(8):1336-42.
[8]Thomsson E,Persson L,Grahn A,et al.Recombinant glycoprotein E produced in mammalian cells in large-scale as an antigen for varicella-zoster-virus serology[J].J Virol Methods,2011,175(1):53-9.
[9]Rahaus M,Wolff M H.Analyses of the transcriptional pattern of glycoproteins E and I of Varicella-zoster virus and evidence for a monocistronic transcription[J].JMed Virol,2003,70(Suppl 1):S51-5.
[10]Malavige G N,Jones L,Black A P,et al.Varicella zoster virus glycoprotein E-specific CD4+T cells show evidence of recent activation and effector differentiation,consistent with frequent exposure to replicative cycle antigens in healthy immune donors[J]. Clin Exp Immunol,2008,152(3):522-31.
[11]Dendouga N,Fochesato M,Lockman L,et al.Cell-mediated immune responses to a varicella-zoster virus glycoprotein E vaccine using both a TLR agonist and QS21 in mice[J].Vaccine,2012,30(20):3126-35.
[12]Wang Z H,Gershon M D,Lungu O,et al.Essential role p layed by the C-terminal domain of glycoprotein I in envelopment of varicella-zoster virus in the trans-Golgi network:interactions of glycoproteinswith tegument[J].JVirol,2001,75(1):323-40.
[13]伊兴旭,甘 霖,陈敬贤,等.水痘 -带状疱疹病毒疫苗的评价与研究进展[J].微生物与感染,2014,9(4):256-60.
Prokaryotic expression of varicella zoster virus glycoprotein E extracellular domain and preparation of antiserum
Yi Xingxu1,Chen Jingxian2,Gan Lin2,et al
(1Chaohu Hospital of AnhuiMedical University,Hefei 238000;2Deptof Microbiology,AnhuiMedical University,Hefei 230032)
Objective Varicella-zoster virus(VZV)glycoprotein E(gE)extracellular domain was cloned and expressed in E.coli.New Zealand rabbitwas immunized with the recombinant proteins to produce anti-VZV gE polyclonal antibody.Methods Prokaryotic expression plasmid gE-pET-32a(+),which contained the coding sequence for the extracellular domain of VZV gE.The authenticity of the insert was confirmed by DNA sequencing before itwas transformated into E.coli BL21 strain.The fusion proteinswere analyzed byWestern blot and purified with Ni2+-NTA column.The New Zealand rabbitwas immunized with the recombinant gE protein.Antibody titers were determined by ELISA.Resu lts Using prokaryotic expression system,wewere able to successfully induce the expression of VZV gE fusion proteins in E.coli.The fusion proteins reached 3.01 mg/ml in cell lysate and the purity was nearly 90%.The titer of the rabbit anti-VZV gE polyclonal antibody was1∶6 400.Conclusion The extracellular domain of VZV gE proteins are successfully expressed in E.coli,and could be a candidate for VZV vaccine.Highly specific polyclonal anti-VZV gE antibodies are obtained by immunization in New Zealand rabbit,which could be used to develop amethod for VZV laboratory diagnosis.
varicella-zoster virus;prokaryotic expression;fusion protein;polyclonal antibody
R 373.1;R 392.7
A
1000-1492(2016)02-0151-05
时间:2016-1-20 10:32:25
http://www.cnki.net/kcms/detail/34.1065.R.20160120.1032.002.htm l
2015-11-17接收
国家自然科学基金(编号:30872253);安徽省科技厅科技攻关项目(编号:08010302179);校企合作实践教育基地(编号:2012sjjd014)
1安徽医科大学附属巢湖医院检验科,合肥 238000
2安徽医科大学微生物学教研室,合肥 230032
伊兴旭,男,硕士;
王 明 丽,女,教 授,硕 士 生 导 师,责 任 作 者,E-mail:1952987441@qq.com
