荔枝核总黄酮抑制人肝星状细胞增殖作用机制的研究
2016-04-27林丽馨肖绪华刘燕秀成秋宸覃桂金赵永忠
李 彩,林丽馨,肖绪华,刘燕秀,成秋宸,董 勇,覃桂金,霍 群,卢 青,赵永忠
荔枝核总黄酮抑制人肝星状细胞增殖作用机制的研究
李 彩1,林丽馨2,肖绪华1,刘燕秀1,成秋宸1,董 勇1,覃桂金1,霍 群3,卢 青1,赵永忠1
目的研究荔枝核总黄酮(TFL)对转化生长因子-β1(TGF-β1)诱导的人肝星状细胞(HSC-LX2)增殖与核因子-kB(NF-кB)、α-平滑肌肌动蛋白(α-SMA)表达的影响。方法体外 培 养 HSC-LX2,TGF-β1刺激 24 h后 给 予 不 同 浓 度 的TFL(80、160、320、640、800μg/ml)干预;给药后 24、48、72 h,用 MTT法分别检测 TFL对 HSC-LX2增殖的影响;采用半定量 PCR检测 各组 NF-кB、α-SMA mRNA的 表达;Western blot检测 NF-кB、α-SMA蛋白的表达情况。结果MTT检测结果显示 TFL呈时间依赖性抑制 TGF-β1诱导 HSC-LX2增殖,以作用 48 h最为 明 显 ,其 半 数 抑 制 浓 度 (IC50)为 302μg/m l。TFL各剂 量 组 作 用 48 h后,HSC-LX2细 胞 中 NF-кB和 α-SMA基因和蛋 白 的表达水 平 都降 低 ,尤以 300μg/m l和 600 μg/m l药物浓度组较明显,与对照组比较,有显著 性差异 (P<0.05)。结论TFL在体外对 TGF-β1诱导的 HSC-LX2的增殖有抑制作用,其作用机制可能是通过抑制细胞中 NF-кB的表达,从而起到抗肝纤维化的作用。
荔枝核总黄酮;人肝星状细胞;细胞增殖;NF-кB
肝纤维化是指以胶原为主的细胞外基质(extracellularmatrix,ECM)在肝脏内过度沉积,是多种慢性肝病共有的、渐进性的病理阶段[1]。核转录因子-кB(nuclear factor B,NF-кB)是 一 种 有 多 向 调 节功能的蛋白质因子,有转录激活功能;在肝纤维化的发生发展中,NF-κB不仅可以促进肝脏的炎症反应,还能够促进肝星状细胞的活化,对肝纤维化的发生发展起着重要的调控作用[2-3]。广西盛产荔枝,荔枝核作为传统中药,在体外能够显著抑制 HepG2细胞、Colo320DM细胞和 SW 480细胞的增殖[4-5]。荔枝核总黄 酮 (total flavone of semen litchi,TFL)对 大鼠 肝 纤 维 化 有 较 好 的 疗 效[6-7],该 实 验 旨 在 探 讨TFL在不同剂量和不同作用时间下对人肝星状细胞(human hepatic stellate cell,HSC-LX2)的 增 殖 抑 制作用,以及对 NF-кB、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)基因和蛋白表达的影响。
1 材料与方法
1.1 材料和仪器HSC-LX2购自中美合资博慧斯生物医药科技有限公司;TFL购自南京泽朗医药科技有限公司,纯度 80%;培养基 DMEM购自美国Gibco公司;胎牛血清(FBS)购自美国 Gemini公司;胰蛋白酶、青链霉素、四甲基偶氮唑蓝(MTT)购自中国 Solarbio公司;TGF-β1购自美国 PeproTech公司;总 RNA提取试剂盒购自北京天根公司;逆转录试剂盒、2×PCR Master Mix购自日本 TaKaRa公司;引物由上海生工生物工程公司合成;总蛋白提取试剂盒购自北京博奥森公司;BCA蛋白定量试剂盒购自北京碧云天公司;抗 NF-кB单克隆抗体购自美国BD公司;抗 α-SMA单克隆抗体购自英国 ABcam公司;抗 GAPDH单克隆抗体、辣根过氧化物酶标记的山羊抗兔二抗及山羊抗小鼠二抗购自北京中杉金桥生物技术有限公司;Western blot化学发光试剂盒购自美国 Thermo公司;梯度 PCR仪购自德国 Sigma公司;倒置相差显微镜购自日本奥林巴斯;酶标仪购自美国伯乐公司;电泳仪购自北京六一仪器厂;凝胶成像分析仪购自上海培清公司。
1.2 方法
1.2.1转化生长因子-β1(transforming growth factor-β1,TGF-β1)、TFL母液的配制 10μg TGF-β1溶解于 50μl浓度为 10 mM的柠檬酸(pH 3.0),配成 0.2 mg/ml的 TGF-β1母液。TFL用 5 ml/L的DMSO溶解,配成 800μg/m l的 TFL母液,0.22μm微孔滤器过滤除菌备用,然后根据需要再稀释成所需要的浓度。
1.2.2细胞培养 培养 HSC-LX2,用含有 10% FBS、100 U/ml的青霉素和链霉素的 DMEM高糖培养基,在 5%CO2、37℃恒温箱内培养,待细胞长至80% ~90%时按1∶2~1∶4的密度传代,每隔2~3 d传代1次,取对数生长期的细胞用于实验。
1.2.3细胞分组及处理 共分为 5组:空白对照组(第1组)、实验对照组(第2组)、低浓度 TFL组(第3组)、中浓度 TFL组(第4组)、高浓度 TFL组(第5组)。第 1组:在 DMEM培养基中加入终浓度为 5 ng/m l[8]的人重组 TGF-β1;第 2、3、4、5组:在第 1组的基础上加入 5‰的 DMSO,再分别加入 TFL,使其终浓度为 0、150、300、600μg/ml。
1.2.4MTT法检测 TFL对细胞增殖的影响 将对数生长期的细胞按 2×103个/孔,接种于 96孔细胞培养板,每孔加入培养基 150μl,置 5%CO2、37℃恒温箱培养 24 h。待细胞贴壁后换液加药,将不同浓度的 TFL(终浓度为 80、160、320、640、800μg/ml)分5个组作用于细胞,并设立空白对照组和实验对照组(对照组),每组设 8个复孔,置于 5%CO2、37℃恒温箱再培养 24、48、72 h后吸去上清液。每孔加入培养基 100μl及浓度为 5 mg/ml的 MTT 20 μl,置 5%CO2、37℃恒温箱培养 4 h,弃去各孔中的液体;每孔加入 DMSO 150μl,在 37℃恒温振荡器上震荡 10 min,于酶标仪单波长为 490 nm条件下测其吸光度(absorbance value,A)值。抑制率(inhibition rate,IR)(%)=(1-药 物组 /实验对照 组)× 100%。根据 IR计算 TFL对细胞增殖的半数抑制浓度(50%inhibition concentration,IC50)。
1.2.5半 定 量 PCR检测 HSC-LX2中 NF-кB、α-SMA mRNA的表达 ① 将对数生长期的细胞以3.5×105个/皿种于10 cm的细胞培养皿,24 h贴壁后,分为:空白对照组、实验对照组、低浓度 TFL组、中浓度 TFL组、高浓度 TFL组,继续培养 48 h。②用试剂盒提取细胞的总 RNA,通过分光光度计来检测 RNA的浓度和纯度,A260/A280均在 1.8~2.0,用1%琼脂糖凝胶电泳来检测 RNA的完整性。③ 各取总 RNA 1μg,将其逆转录成 cDNA。④ 引物设计,以 β-actin为内参,引物序列 NF-кB:F:5′-AACAGAGAGGATTTCGTTTCCG-3′,R:5′-TTTGACCTGAG GGTAAGACTTCT-3′,产物长度为 104 bp;α-SMA:F:5′-CTATGAGGGCTATGCCTTGCC-3′,R:5′-GCTCAGCAGTAGTAACGAAGGA-3′,产物长度为 122 bp;βactin F:5′-AAAGACCTGTACGCCAACAC-3′,R:5′-GTCATACTCCTGCTTGCTGAT-3′,产 物 长 度 为 219 bp。⑤ PCR扩增反应条件:β-actin 94℃预变性 2 min,94℃ 30 s,56℃ 30 s,72℃ 30 s,共反应 30个循环,72℃延伸 2 min;α-SMA 94℃预变性 2 min,94℃ 30 s,53℃ 30 s,72℃ 30 s,共反应 35个循环,72℃延伸 2 min;NF-кB 94℃预变性 2 min,94℃ 30 s,53℃ 30 s,72℃ 30 s,共反应 35个循环,72℃延伸 2 min。⑥ 产物以 2%的琼脂糖凝胶电泳检测,用培清 JS-780全自动凝胶成像分析系统进行分析,以待测样品与内参的比值做半定量分析。
1.2.6Western blot检 测 HSC-LX2中 NF-кB、α-SMA蛋白的表达 细胞培养及分组同上 1.2.5①,每组样品用预冷的 PBS洗涤 3次,加入 WIP裂解液,裂解 30 min后,4℃ 12 000 r/min离心 20 min,取上清提取总蛋白,BCA法进行蛋白定量,SDSPAGE凝胶电泳,湿转法转膜,BSA封闭 1 h,一抗(GAPDH、NF-кB和 α-SMA)4℃ 孵 育 摇 床 过 夜,TBST洗涤三遍后加相应的二抗,室温孵育1.5 h,洗涤,ECL显影,Bio-Rad ChemiDoc XRS+化学发光成像系统曝光,以内参为标准,计算出每组蛋白的相对表达量。
1.3 统计学处理采用 SPSS 18.0统计软件进行分析,实验数据计量资料以 ¯x±s表示;组间实验数据进行单因素方差分析,组间多重比较采用 LSD-t检验。
2 结果
2.1 TFL对TGF-β1活化的HSC-LX2增殖的影响TFL对 TGF-β1活化的 HSC-LX2的增殖有抑制作用,药物作用 24 h,抑制作用不明显,IR为 0.9%~16.8%,此时低浓度的药物甚至还有促进作用,药效还没发挥出来;药物作用 48 h,IR为 5.0% ~85.5%,此时有明显的抑制作用,并且和实验对照组相比,药物浓度≥160μg/m l,差异有统计学意义(P<0.05);药物作用 72 h,IR为 40.8% ~88.9%,浓度≥80μg/ml,差异有统计学意义(P<0.05)。见表 1、图1。

图1 不同时间和浓度 TFL对 HSC-LX2的抑制曲线
2.2 TFL抑制TGF-β1活化的HSC-LX2中α-SMA和NF-кBmRNA表达TGF-β1活化的 HSCLX2中,α-SMA和 NF-кB mRNA在 各 组中均有 表达,其中空白对照组和实验对照组表达较多,条带较宽较亮,两组差异无统计学意义,低浓度 TFL组的表达量略低于实验对照组。中浓度 TFL组和高浓度 TFL组表达明显低于实验对照组,表达量较少,条带较暗,α-SMA/β-actin比值差异 有统计 学意义(F=137.258,P<0.05),NF-кB/β-actin比值差异有统计学意义(F=58.301,P<0.05)。见图2、3。
2.3 TFL抑制TGF-β1活化的HSC-LX2中α-SMA和NF-кB蛋白表达TGF-β1活 化 的 各 组HSC-LX2中,空白对照组和实验对照组中 α-SMA和 NF-кB蛋白表达量最多,两组差异无统计学意义;与实验对照组相比,低浓度 TFL组的表达量略低,而中浓度 TFL组和高浓度 TFL组的表达量明显减少,α-SMA/GAPDH和 NF-кB/GAPDH比值差异均有统计学意义(F=5.199、22.494,P<0.05)。见表 2、图4。
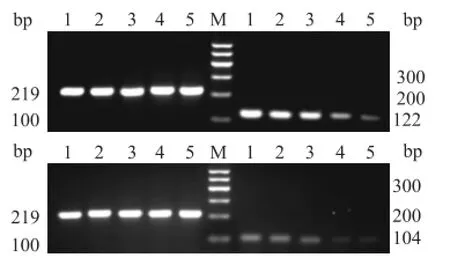
图2 逆转录 PCR检测 HSC-LX2中 α-SMA、NF-кB m RNA的表达M:DNA Marker;1:空白对照组;2:实验对照组;3:低浓度 TFL组;4:中浓度 TFL组;5:高浓度 TFL组
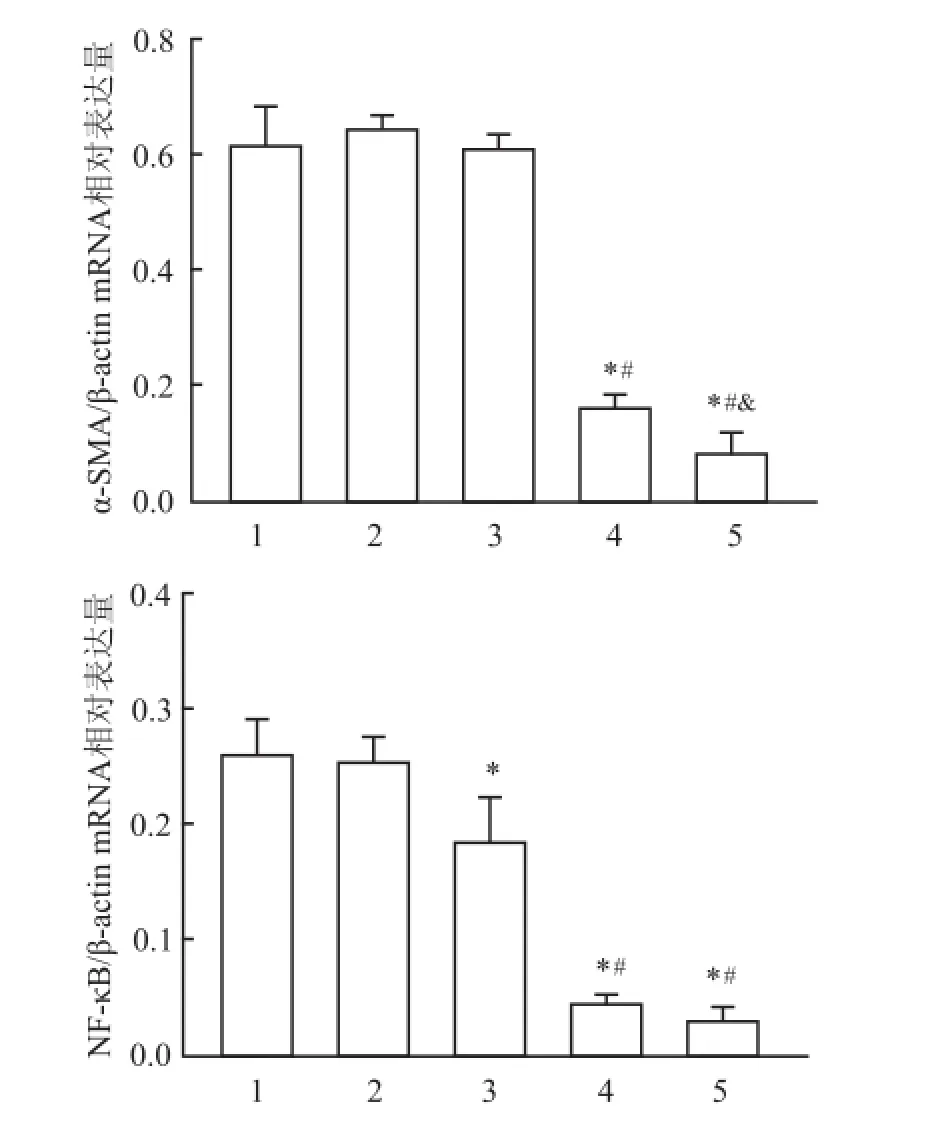
图3 各组 HSC-LX2中 α-SMA和 NF-кB mRNA的表达1:空白对照组;2:实验对照组;3:低浓度 TFL组;4:中浓度 TFL组;5:高浓度 TFL组;与实验对照组比较:*P<0.05;与低浓度 TFL组比较:#P<0.05;与中浓度 TFL组比较:&P<0.05

表1 TFL对 TGF-β1活 化的 HSC-LX2的抑 制作 用(n=8,¯x±s)

表2 各 组 HSC-LX2中 α-SMA和 NF-кB蛋 白的表 达(n=3,¯x±s)
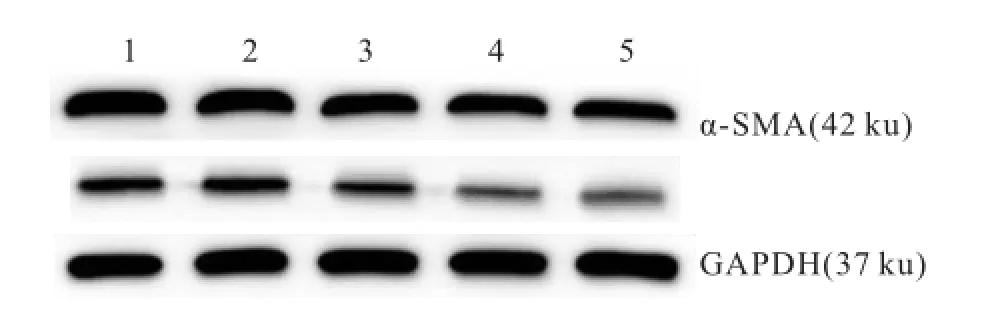
图4 Western blot检测 HSC-LX2中 α-SMA、NF-кB蛋白的表达1:空白对照组;2:实验对照组;3:低浓度 TFL组;4:中浓度 TFL组;5:高浓度 TFL组
3 讨论
TGF-β1是目前已发现的最强的致纤维化的细胞因子之一,研究[9]表明 TGF-β1在一定浓度范围内显著增强 α2(I)胶原基因启动子活性,并且有剂量依赖性。肝纤维化是多种慢性肝病向肝硬化转变必经的中间环节,其本质是 ECM合成与降解失衡,导致 ECM在肝脏中大量沉积。HSC是过量 ECM的主要来源,其活化和增殖是肝纤维化形成与发展的关键环节。当受到外界刺激时,HSC发生表型转化而被激活,活化的 HSC增殖,转变为表达 α-SMA的肌成纤维样细胞。现普遍认为 α-SMA是肝星状细胞活化的标志物[10]。目前抗肝纤维化治疗的策略有两种,一是逆转活化的 HSC,二是抑制活化的HSC增殖。但是将活化的 HSC逆转为静止的,几乎是不可能的[11],因此,抑制活化的 HSC增殖,减少HSC的数量,减少 ECM的沉积已成为肝纤维化治疗的主要策略。
研究[12]表明,NF-κB在胆汁淤积性肝纤维化大鼠模型中表达显著增强,而在正常组织的表达量却很少。NF-κB是介导炎症反应的关键介质,活化的HSC可以诱导 NF-κB表达增加,激活的 NF-κB可以使 HSC中多种炎性因子的表达增加,如细胞因子TNF-α、IL-6、ICAM-1、TGF-β等,从 而 引 起 更 多 的HSC活化,产生过量的 ECM,而这些因子的增加又可以反过来激活 NF-κB,如此形成一个正反馈调节[13],加重肝纤维化。NF-κB不仅对炎症因子的表达起着中枢性的调控作用,而且对 HSC的活化增殖也起着重要作用。NF-kB通过调控炎症因子的转录参与 HSC的激活[14],并且由于 NF-κB还有抗凋亡作用[15],能够维持 HSC保持持续激活的状态。这在一定程度上促进了肝纤维化的发生发展。因此,可以通过抑制 NF-κB的活性,从而来逆转肝纤维化。
本实验用 5 ng/ml TGF-β1活化 HSC-LX2,所有实验分组在 TGF-β1一致性的基础上展开。MTT实验表明 TFL作用 24 h,抑制作用不明显;作用 48 h和 72 h,IR分 别为 5.0% ~85.5% 和 40.8% ~88.9%,由此来看,TFL作用 48 h和 72 h都有抑制作用,但是延长药物作用时间,最大 IR并没有显著增加,由此见 IR并不是随作用时间的延长而呈线性增加的;当达约 85% ~89%时,基本已到平台期。并且作用 48 h和 72 h,药物的 IC50分别是 302μg/m l和 280μg/ml,在药物浓度方面也并没有很大差异。从时间和药物浓度两个方面来看,48 h为药物作用的最佳时间,故后续实验的药物作用时间设定为 48 h,药物浓度设定为中浓度 TFL为 300μg/ml,低浓度 TFL为 150μg/ml,高浓度 TFL为 600μg/m l。
本实验结果表明中、高浓度的 TFL有明显的抑制活化 HSC的增殖作用,和实验对照组相比,中、高浓度 TFL组的 NF-κB的基因和蛋白的表达水平显著降低。同时也检测到中、高浓度 TFL组的 α-SMA的表达水平较实验对照组也显著降低,正好验证了活化 HSC的数量减少。低浓度 TFL对 NF-кB的表达是有影响的,不管是从基因还是蛋白水平,和实验对照组比较,差异有统计学意义。低浓度 TFL对 α-SMA表达的影响很微弱,因为 α-SMA是肝星状细胞活化的标志物,低浓度 TFL只是抑制了活化肝星状细胞的增殖,但是活化了的肝星状细胞并没有凋亡,所以表达的 α-SMA还是很高的。中浓度和高浓度的 TFL,不仅可以抑制细胞的增殖,可能还起到了促进其凋亡的作用。TFL从基因和蛋白水平降低HSC-LX2中 NF-κB的表达,可能是 TFL抗肝纤维化的作用机制之一;但是对于 TFL是否通过 NF-κB通路来抗肝纤维化,尚未完全阐明,尤其是 NF-κB通路与其他信号转导通路之间的相互关系,亟需更进一步的动物实验来探索和研究。
[1]Friedman S L.Mechanisms of hepatic fibrogenesis[J].Gastroenterology,2008,134(6):1655-69.
[2]Friedman SL.Evolving challenges in hepatic fibrosis[J].NatRev Gastroenterol Hepatol,2010,7(8):425-36.
[3]Elsharkawy A M,Mann D A.Nuclear factor-kappaB and the hepatic inflammation-fibrosis-canceraxis[J].Hepatology,2007,46(2):590-7.
[4]熊爱华,沈文娟,肖柳英,等.荔枝核含药血清对人肝癌 HepG 2细胞增殖和凋亡的影响[J].中药材,2008,31(10):1533-6.
[5]Hsu C P,Lin C C,Huang C C,et al.Induction of apoptosis and cell cycle arrest in human colorectal carcinoma by Litchi seed extract[J].JBiomed Biotechnol,2012,2012:341479.
[6]董 勇,赵永忠,肖绪华,等.荔枝核总黄酮对活化大鼠肝星状细胞的增殖抑制作用及 TLR4表达的影响[J].安徽医科大学学报,2015,50(4):432-6.
[7]成秋宸,赵永忠,肖绪华,等.荔枝核总黄酮改善胆总管结扎大鼠胆汁淤积症状的研究[J].天津医药,2014,42(3):224-7.
[8]Zhang Z,Garron T M,Li X J,et al.Recombinant human decorin inhibits TGF-β1-induced contraction of collagen lattice by hypertrophic scar fibroblasts[J].Burns,2009,35(4):527-37.
[9]Kanamaru Y,Nakao A,Tanaka Y,et al.Involvement of p300 in TGF-beta/Smad-pathway-mediated alpha2(I)collagen expression in mousemesangial cells[J].Nephron Exp Nephrol,2003,95(1):e36-42.
[10]Venugopal SK,Jiang J,Kim TH,et al.Liver fibrosis causes downregulationofmiRNA-150 and miRNA-194 in hepatic stellate cells,and their overexpression causes decreased stellate cell activation[J].Am J Physiol Gastrointest Liver Physiol,2010,298(1):G101-6.
[11]Friedman S L,Rockey D C,Bissell D M.Hepatic fibrosis 2006:report of the Third AASLD Single Topic Conference[J].Hepatology,2007,45(1):242-9.
[12]赵永忠,成秋宸,卢 青,等.荔枝核总黄酮治疗胆汁淤积性肝纤维化大鼠的实验研究[J].中华肝脏病杂志,2015,23(2):137-9.
[13]Kulms D,Schwarz T.NF-κB and cytokines[J].Vitam Horm,2006,74:283-300.
[14]Hellerbrand C,Jobin C,limuro Y,etal.Inhibition of NF kappaB in activated rat hepatic stellate cells by proteasome inhibitors and an IkappaB super-repressor[J].Hepatology,1998,27(5):1285-95.
[15]Wang C Y,Mayo M W,Baldwin A S Jr.TNF-and cancer therapyinduced apoptosis:potentiation by inhibition of NF-kappaB[J]. Science,1996,274(5288):784-7.
M echanism for total flavone of semen litchi inhibiting human hepatic stellate cell proliferation
Li Cai1,Lin Lixin2,Xiao Xuhua1,et al
(1Dept of Digestive Medicine,The Affiliated Hospital of Guilin Medical University,Guilin 541001;2Dept of Pharmacy,Nanxishan Hospital of Guangxi Zhuang Autonomous Region,Guilin 541002)
Objective To study the effects of total flavone of semen litchi(TFL)on transforming growth factor-β1(TGF-β1)induced human hepatic stellate cell proliferation and the expressions of nuclear factor-kB(NF-кB),αsmoothmuscle actin(α-SMA).Methods HSC-LX2 cells were cultured in vitro,using TGF-β1stimulating 24 h,then gave different concentrations of TFL for different hours.MTTmethod was used to detect the effects of TFL on HSC-LX2 cell proliferation.RT-PCR was used to detect the expression levels of NF-кB andα-SMA mRNA.The levels of NF-кB andα-SMA proteins were detected by Western blot assay.Results MTTmethod showed that TFL could inhibit TGF-β1 induced HSC-LX2 cell proliferation in a time-dependentmanner.The effect of 48 h was the most obvious and its IC50was 302μg/ml.The expression levels of NF-кB,α-SMA mRNA and proteins were both decreased among the TFL group.Compared with Control group,the expression levelsof NF-кB,α-SMA were significantly lower in 300μg/ml and 600μg/ml drug concentration group(P<0.05).Conclusion In vitro,TFL may inhibit the proliferation of TGF-β1-induced HSC-LX2,so as to prevent the formation of hepatic fibrosis,whichmay be related with decreasing the expression of NF-кB.
total flavone of semen litchi;human-hepatic stellate cell;proliferation inhibition;NF-kappa B
R 575
A
1000-1492(2016)02-0171-05
时间:2016-1-20 10:32:26
http://www.cnki.net/kcms/detail/34.1065.R.20160120.1032.010.htm l
2015-11-06接收
国家自然科学基金(编号:81360659);广西自然科学基金(编号:2012GXNSFAA053105)
1桂林医学院附属医院消化内科,3桂林医学院生物技术
学院,桂林 541001
2广西壮族自治区南溪山医院药剂科,桂林 541002
李 彩,女,硕士研究生;
赵永忠,男,教授,主任医师,硕士生导师,责任作者,E-mail:13607736670@163.com
