磁共振弥散加权联合动态增强扫描诊断早期不典型乳腺癌
2016-04-27林华李敏邓德茂
林华 李敏 邓德茂
磁共振弥散加权联合动态增强扫描诊断早期不典型乳腺癌
林华李敏邓德茂
【摘要】目的探讨联合应用MRI弥散加权成像(DWI)与动态增强扫描序列对早期不典型乳腺癌的诊断价值。方法回顾性分析30例经手术及病理证实且BI-RADS分级为Ⅳ级及以下的乳腺病变患者的MR资料,其中不典型乳腺癌18例,良性病变12例,测量病变的DWI的表观扩散系数(B=1 000 s/mm2时ADC值)及描绘T1WI动态增强时间-信号强度曲线(TIC)。结果本组病例在DWI上,当B=1 000 s/mm2时,以ADC值1.4276×10(-3)mm2/s作为良恶性病变诊断阈值,以此值为标准可判定30例乳腺病变中分别有恶性病变20例及良性病变10例,乳腺良恶性病变在DWI中ADC值上差异有统计学意义(P<0.01)。应用T1WI动态增强TIC曲线区分乳腺良恶性病变,其中有恶性病变23例和良性病变7例,乳腺良恶性病变在T1WI动态增强TIC曲线分型上差异有统计学意义(P<0.01)。联合应用DWI及TlWI动态增强对乳腺病变的良恶性进行判定,其敏感性为94.44%、特异性为83.33%、准确性为90.00%、阳性预测值为89.47%、阴性预测值为90.91%。结论综合应用磁共振态增强扫描以及DWI对早期不典型乳腺癌诊断具有重要的参考意义,能提高其诊断的准确率。
【关键词】磁共振;弥散加权成像;动态增强;不典型;乳腺癌
E-mail:392397774@ qq.com
近年来,乳腺癌发病率和病死率逐年上升,目前在我国已排在女性最常见的恶性肿瘤第一位,对我国女性的生活质量产生严重困扰,甚至威胁她们的身体健康以及生命安全。随着乳腺癌认识和诊断水平的不断提高,其治疗也愈发规范化,通过制定并实施针对性的手术治疗以及放化疗,及早发现的乳腺癌患者己经基本得到治愈。然而部分早期乳腺癌病例往往不具备典型的症状和体征,不易被发现甚至被误诊,以致错过最佳治疗时间。当前,临床上对乳腺癌传统的检查手段包括乳房查体触诊、乳腺X线钼靶以及超声检查等。本世纪以来,磁共振逐渐应用于乳腺癌的检查,但是常规扫描很难鉴别早期不典型乳腺癌与乳腺良性病变,有研究表明单纯应用磁共振动态增强扫描对乳腺良恶性病变进行诊断的敏感性虽然很高[1],但特异性仍显不足[2,3]。随着技术的进步,磁共振功能成像技术逐渐开展和应用,特别是弥散加权成像(diffusion weighted imaging,DWI)在乳腺疾病诊断方面的作用逐渐被人们认识。本文回顾性分析了30例经病理证实的乳腺肿瘤病变MRI影像资料,分析其DWI及动态增强扫描特点,探讨其对早期不典型乳腺癌的诊断价值。
1 资料与方法
1.1一般资料回顾性分析我院2012年2月至2015年1月经术后病理证实的乳腺病变30例临床资料。入选标准: (1)年龄<60岁; (2)磁共振BI-RADS分级≤Ⅳ级; (3)无其他恶性肿瘤病史。排除标准: (1)于检查1周前已对乳腺病变进行穿刺或已行放化疗者; (2) MR图像产生较大伪影以致病变难以测量者。本组病例均为女性,年龄27~60岁,平均(45±11)岁。30例中恶性病变18例、良性病变12例;其中包括浸润性导管癌10例,浸润性小叶癌6例,黏液腺癌1例,乳腺梭形细胞鳞癌1例,纤维腺瘤8例,导管内乳头状瘤4例。
1.2MR扫描参数采用美国通用公司3.0T磁共振扫描仪,专用体部相控阵线圈,患者取俯卧位足先进,两侧乳房自然悬垂入线圈内孔位。常规矢状位平扫单侧乳房,采用FSE T1WI以及脂肪抑制、FSE T2WI序列,图像层厚5 mm,间隔1 mm,FOV 20 cm,矩阵256 ×320。双侧乳腺横轴位FSE T2WI扫描,图像层厚5 mm,间隔1 mm,FOV 32~40 cm,矩阵384×256。弥散加权使用自旋回波-回波平面成像(SE-EPI)序列B=0 s/mm2、B=1 000 s/mm2两次横轴位扫描,图像层厚5 mm,间隔1 mm,FOV 32~40 cm,矩阵384×256。动态增强采用3D FSPGR+脂肪抑制,图像层厚3 mm,FOV 28~34 cm,矩阵512×384,激发1次,静注对比剂Gd-DTPA后行横轴位扫描,动态采集平扫+注射造影剂后共9个回合。
1.3MR图像处理及分析方法所有MRI图像均由两名资深影像学医师共同讨论阅片,在后处理软件上对主要对感兴趣区域(ROI)进行选取及ADC值测量、TIC曲线分型。
1.3.1DWI:选取病灶较为清晰的3个感兴趣区域,出血、液化、坏死、囊变及钙化等区域需尽量避开,并于病变显示清晰的最大层面选取ROI最少包括50个像素,利用MRI自带工作站(ADW 4.2)的Functool 2软件,分别计算出B=1 000 s/mm2时的ADC值,再取3个数值的平均值作为该病灶的ADC值。
1.3.2T1WI动态增强扫描:所有病灶ROI均取非液化坏死且信号最高的区域,在不超过病灶范围的前提下,ROI面积尽量大。利用MRI自带工作站(ADW 4.2)的Functool 2软件绘制动态增强时间-信号强度曲线(TIC)。所有病灶的动态增强TIC曲线共分4 型: A型:廓清型(快进快出型) ; B型:双相型(平台型) ; C型:单相型(缓慢上升,无高峰) ; D型:无明显强化。
1.4统计学分析应用SPSS 15.0统计软件,计量资料以±s表示,采用t检验,病变的T1WI动态增强TIC分型对比采用Fisher’s确切概率法检验,P<0.05为差异有统计学意义。
2 结果
2.1单独用DWI的ADC值评价乳腺良恶性病变B=1 000 s/mm2时,18例乳腺恶性病灶感兴趣区ADC值范围在(1.186±0.338)×10-3mm2/s,而12例良性病变ADC值范围在(1.542±0.362)×10-3mm2/s。2组差异有统计学意义(P<0.01)。见表1。
表1 乳腺良恶性病变的ADC值比较 ×10-3mm2/s,±s

表1 乳腺良恶性病变的ADC值比较 ×10-3mm2/s,±s
注:与良性病变比较,*P<0.01
组别 95%可信区间乳腺恶性病变(n=18) 1.186±0.338*乳腺良性病变(n=12)1.542±0.362
2.2乳腺良恶性病变ADC值与病理诊断比较参照娄路馨[4]的乳腺病变组ADC值,B=1 000 s/mm2时,恶性病变为(1.0449±0.3827)×10-3mm2/s,良性病变为(1.6990±0.3408)×10-3mm2/s,当以恶性乳腺病变组平均ADC值95%区间上限界值1.4276× 10-3mm2/s作为判定良恶性病变的阈值,按照上述标准本组30例可判定有20例乳腺恶性病变及10例乳腺良性病变。以手术病理结果为金标准,应用ADC值鉴别乳腺良恶性病变的敏感性为88.89% (16/18)、特异性为66.67% (8/12)、准确性为80.00% (24/30)、阳性预测值为80.00% (16/20)、阴性预测值为80.00%(8/10)。乳腺良恶性病变在DWl影像ADC值上差异有统计学意义(P<0.01)。见表2。

表2 乳腺良恶性病变ADC值与病理诊断比较 例
2.3灌注成像TIC曲线参考王兰云等[5]认为乳腺恶性病变的T1Wl动态增强TIC曲线分型主要是A型与B型,而良性病变的TIC曲线主要是C型与D型,以此作为判断良、恶性病变的标准,本组病例按照T1Wl动态增强TIC曲线判定恶性病变23例,良性病变7例。手术病理结果显示,恶性病变中TIC A型有10例,B型有7例,C型有1例,D型0例,良性病变中A型1例,B型5例,C型6例,D型0例。经对照分析,依据T1Wl动态增强TIC曲线分型判定乳腺良恶性病变的敏感性为94.44% (17/18)、特异性为50.00%(6/12)、准确性为76.67% (23/30)、阳性预测值为73.91% (17/23)、阴性预测值为85.71% (6/7),乳腺良恶性病变在T1Wl动态增强TIC曲线分类上的差异有统计学意义(P<0.01)。见表3。

表3 乳腺良恶性病变T1WI动态增强TIC分型与病理诊断对照例
2.4ADC值联合灌注成像TIC曲线18个病理证实的恶性病变中,13例ADC值及T1Wl动态增强扫描TIC曲线均判定为恶性病灶,4个病灶ADC值判定为良性,联合TIC曲线判定为恶性,1个病灶TIC曲线判定为良性,ADC值判定也为良性,构成本组病例的假阴性。12个良性病变中,8例被两种方法联合判定为良性,2例TIC曲线诊断可疑恶性,联合ADC值判定为良性,2例TIC曲线为可疑恶性,联合ADC值为恶性,构成本组病例的假阳性。对照病理结果,T1WI动态增强TIC曲线、DWI及两者综合应用判定早期不典型乳腺癌的结果比较。单独使用DWI或动态增强的扫描方法判定乳腺良恶性病变各自拥有其优点,但同时测量ADC值以及描绘TIC曲线来判定乳腺的良恶性病变,其准确性要高于单独使用任一种方法,可达90.91%。见表4。
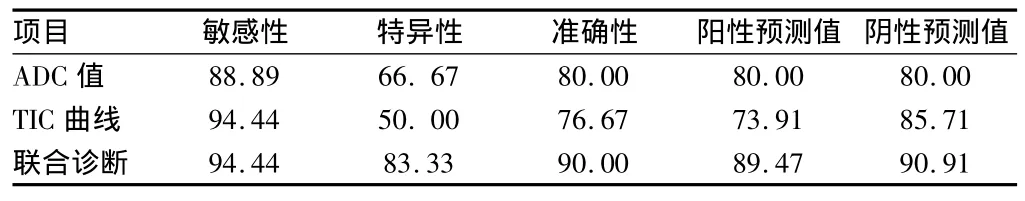
表4 DWI、动态增强及两者联合应用判定早期不典型乳腺癌的结果比较 %
2.5典型病例见图1~3。

图1 女,51岁,浸润性导管癌。T1序列病灶呈低信号,T2压脂序列呈高信号;动态增强扫描,动脉期明显强化,静脉器强化减退,其动态增强TIC曲线为A型(快进快出型) ; ADC值为1.056×10-3mm2/s
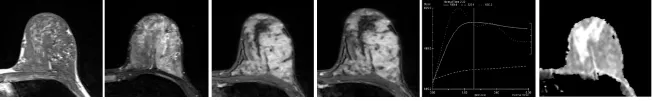
图2 女,48岁,浸润性小叶癌。T1序列病灶呈等信号,T2序列呈稍高信号;动态增强扫描,动脉期病灶不均匀强化,静脉期持续强化,动态增强TIC曲线为B型(平台型) ;病灶ADC值为1.362×10-3mm2/s

图3 女,43岁,乳腺纤维瘤。T1序列病灶呈低信号,T2压脂呈高信号;动态增强扫描,动脉期病灶均匀轻度强化,静脉期均匀明显强化,动态增强TIC曲线类型为C型(缓慢上升型) ;病灶ADC值为1.584×10-3mm2/s
3 讨论
全球乳腺癌发病率自20世纪70年代末开始一直呈上升趋势,我国乳腺癌发病率亦不乐观,近年我国乳腺癌发病率的增长速度已经超出传统的高发欧美国家,并且年轻女性的发病率呈逐年增加趋势,在我国乳腺癌已排在女性恶性肿瘤的第一位。虽然乳腺癌的发病率逐年上升,但得益于乳腺癌筛查工作以及乳腺癌综合治疗的开展,使得其病死率呈下降趋势。因此乳腺癌的及早发现、诊断并进行针对性治疗是提高其治愈率以及生存率的关键。目前临床上常用的乳腺检查方法主要有乳腺查体、超声、X线钼靶以及核磁共振成像。目前对乳腺病变进行筛查最常规的做法还是应用传统的X线钼靶、乳腺超声检查,但部分早期的乳腺癌病变不具有典型征象,与良性病变较难鉴别,因此容易造成漏诊和误诊。相对X线钼靶以及超声而言,MRI技术拥有无电离辐射、可使用非离子造影剂、高软组织分辨率、多参数重建等诸多优点,对临床查体及常规乳腺筛查难以发现的病变具有较高的发现率以及诊断准确率,因此在临床上已普遍应用MRI对乳腺病变进行诊断和鉴别[6]。其中,因为磁共振动态增强扫描检查可较好的显示乳腺病变形态学征象以及病变的血供情况,并可对图像用后处理工作站制作TIC曲线图呈现其血流变化情况,目前最新版的BI-RADS已使用其作为分类的重要参考依据[7]。但在临床实际工作中,单独使用磁共振动态增强扫描对乳腺疾病进行定性诊断尚有不足之处,即特异性比较低,从而增加了临床对乳腺磁共振检查对乳腺病变定性诊断的疑惑。因此有必要借助MRI其他技术手段来弥补其缺陷,近年来新开展的磁共振功能成像是值得注意的弥补手段,其中值得关注的DWI早期主要应用于脑部疾病的诊断,近年来随着磁共振技术的不断改进,这项无创性的检查技术逐渐应用于乳腺病变的诊断、鉴别诊断以及跟踪随访[8]。
DWI是利用水分子的弥散运动特性进行成像的。DWI使MRI对人体的研究深入到细胞水平的微观世界,反映着人体组织的微观几何结构以及细胞内外水分子的转运等变化,是目前唯一非侵入性检测活体组织内水分子运动的成像技术。恶性病变通常细胞含量丰富,水含量高,再加上部分微观特性也可影响组织内水分子的弥散,这为我们应用DWI技术对乳腺良恶性病变进行鉴别提供了病理基础。有国外学者应用DWI技术检查乳腺时发现,可以利用后处理软件测量乳腺病变感兴趣区的ADC值来进行数据化处理,并通过对比分析用来对疾病进行定性和鉴别诊断[9-11]。本研究中,当取B=1 000 s/mm2时,参照国内研究[4]的恶性病变ADC平均值95%区间上限界值1.4276× 10-3mm2/s作为区分良恶性病变阈值点,并以此值对本组乳腺病变性质进行判定,取得了比较高的准确率(80.00%),与文献研究结果[12]接近。
磁共振动态增强通过获得对比剂在毛细血管网和组织间隙内分布状况的动态信息,从而反映病变的微循环、灌注和毛细血管通透性的变化。对于肿瘤的检出、定性及判断预后可提供更多的信息。而动态增强TIC曲线非常直观的显示了造影剂在病变组织内不同时间的分布以及变化情况,并且一定程度上将病变组织的血流动力学情况间接展示出来。本组病例中,乳腺良恶性病变在T1WI动态增强TIC曲线分型上,差异有统计学意义(P<0.01)。参照相关研究[5]将乳腺病变T1Wl动态增强TIC的A型与B型曲线划分为恶性病变,而将C型与D型曲线归为良性病变,本研究以此诊断标准判定乳腺病变良恶性的敏感性较高(94.44%),但特异性较低(50%)。此外,本研究亦显示在B型曲线上良恶性病变部分可出现重叠。
因此,单独使用动态增强或DWI检查要准确判断早期乳腺病变的良恶性仍然比较困难,尤其部分乳腺病变的动态增强TIC曲线为B型或其ADC值处在重叠区域时。而动态增强TIC曲线以及DWI的联合应用一定程度上提供了上述问题的解决方案。本研究亦显示,态增强TIC曲线联合ADC值测量法诊断乳腺良恶性病变准确率高达90%,明显优于单独使用其中一种方法对病变进行诊断。假阳性病例考虑与病变伴有重度不典型增生相关,因不典型增生细胞拥有生长活跃、密度较高、细胞间隙减小的特点,另外病变细胞因其体积较大具有吸附作用及其生物膜的限制作用,不同程度地阻止病变内水分子的有效运动,即限制了弥散,造成了ADC值的降低。由于乳腺恶性病变内毛细血管内皮通透性明显高于正常组织内的毛细血管内皮,并且乳腺恶性病变组织内存在不同程度的动一静脉短路分流,因而使得造影剂在乳腺癌病变组织内向外流出时的快慢存在明显的不同,并且因观察者水平而致选取病变感兴趣区的不同,这些都可能是出现假阴性的原因。
综上所述,联合应用磁共振DWI及T1WI动态增强成像对早期不典型乳腺癌进行诊断,可以提高诊断的准确度。但本研究结果没有明显突破,而且由于本研究选取上过小的样本数量可能造成部分系统误差而导致最终得到的研究结论可信度较低,因此需要进一步增加后续研究中的试验样本数量,期待得到信任度更高的研究结论。
参考文献
1 沈镇亩,邵志敏主编.乳腺肿瘤学.第1版.上海:科学技术出版社,2005.98-102.
2 Worthington-Kirsch RL,Popky GL,Hutchins FL Jr.Uterine arterial embolization for the managem ent of leiom yom as quality-of-life assessment and clinical response.Radiology,1998,208:625-629.
3 Goodwin SC,Vedantham S,McLucas B,et al.Preliminary experience with uterine artery embolization for uterine fibroids.J VascInterv Radiol,1997,8:517-526.
4 娄路馨,彰俊杰,时高峰.MR扩散加权成像对乳腺良恶性疾病的应用研究.临床放射学杂志,2007,26:350-353.
5 王云兰,王文峰,魏冉,等.乳腺MR灌注时间-信号强度曲线表现及价值研究.临床放射学杂志,2011,30:197-201.
6 Lee SG,Orel SG,Woo IJ,et al.MR imaging screening of the contral ateral breast in patients with newly diagnosed breast cancer; preliminary results.Radiology,2003,226:773-778.
7 Kitagawa K,Sakuma H,Ishida N,et al.Contrast-enhanced high-resolution MRI of invasive breast cancer: correlation with histopathologie subtypes.AJR,2004,183:1805-1809.
8 刘伟,稽鸣.磁共振弥散加权成像在乳腺癌诊断中的应用.上海医学影像,2010,19:71-73.
9 Sinha S,Lucas-Quesada FA,Sinha U,et al.In vivo diffusionweighted MRIofthe breast: potential forlesion characterization.J Magn Reson Imaging,2002,15:693.
10 Sinha S,Sinha U.Functional magnetic resonance ofhuman breast tumors: diffusionand perfusionimaging.AnnNY Acad Sci,2002,980: 95.
11 Degani H,Gusis V,Weinstein D,et al.Mapping Pathophysiological features of breast tumors by MRI at high spatial resolution.Nat Med,1997,3:780.
12 陈欣,张毅力,张秋娟,等.MR扩散加权成像对乳腺病变良恶性鉴别的Meta分析报告.中华放射学杂志,2008,42:582-585.
·论著·
(收稿日期:2015-07-21)
通讯作者:邓德茂,530023南宁市,广西中医药大学附属第一医院放射科;
doi:10.3969/j.issn.1002-7386.2016.04.036
【中图分类号】R 737.9
【文献标识码】A
【文章编号】1002-7386(2016) 04-0582-04
作者单位: 530023南宁市,广西中医药大学附属第一医院放射科
