影响高粱饲用价值主要内在因素及其对策
2016-04-27张福耀吴树彪柳青山
张福耀 吴树彪 柳青山
(1.山西省农业科学院高粱研究所,高粱遗传与种质创新山西省重点实验室,晋中030600;
2.山西省农业科学院农业生物技术中心,太原030031;
3.新英格兰大学环境与农村科学学院,阿米德尔2351)
影响高粱饲用价值主要内在因素及其对策
张福耀1吴树彪2,3柳青山1
(1.山西省农业科学院高粱研究所,高粱遗传与种质创新山西省重点实验室,晋中030600;
2.山西省农业科学院农业生物技术中心,太原030031;
3.新英格兰大学环境与农村科学学院,阿米德尔2351)
摘要:大量研究结果显示,饲用高粱含有3种物质不利于高粱在动物体内的消化,一是酚类化合物,二是醇溶蛋白,三是植酸。本文从3类化合物的特征、对消化酶的抑制作用、醇溶蛋白与淀粉以及氨基酸的消化率、植酸和植酸磷以及酶制剂在高粱型畜禽饲粮中的应用等方面,就高粱在动物饲料应用的研究动态和进展进行了简要综述。
关键词:高粱;动物饲料;酚类化合物;醇溶蛋白;植酸
高粱[Sorghumbicolor(L.) Moench]是全球农业生态系统中重要的粮食和饲料作物。按每年的产量计算,高粱是世界上第5大重要的谷类作物,仅次于玉米、小麦、水稻和大麦。高粱抗旱、耐盐碱和瘠薄土壤,具有在恶劣的环境下生长的能力,被视为干旱和盐碱土壤农业区可持续农业发展的一种主要作物。高粱也是谷类作物中最具加工开发潜能的作物之一,它既可以食用,也可以饲用,还是白酒、啤酒、淀粉、工业饲料加工的重要原料。高粱在发达国家主要用作饲料,亚洲、非洲和部分中美洲地区还是重要的主要食粮,我国的高粱主要用于酿造业,大约85%的高粱用于酿酒和酿醋。饲用高粱含有3种物质对动物的消化利用具不利影响,一是酚类化合物,二是醇溶蛋白,三是植酸,这3种物质通过相似但不同的机制影响蛋白质的消化和利用率[1]。另一个重要成分是淀粉,它是饲料的主要能量来源,但高粱淀粉被蛋白质基质包裹,消化困难,因此,在我国工业配合饲料中很少利用。但从2013年开始,高粱在我国动物饲料中的使用量猛增,我国进口高粱数量随之大大增加。2014年我国饲料加工业进口高粱500万t,是国内高粱总产量的2倍,高粱一跃成为我国主要的饲料原料之一。然而,我国的饲料高粱研究很薄弱,高粱产业界也许需要重新认识饲料高粱,从其饲用价值、在饲料应用中应当采取的对策以及育种方面进行多方位研究。为此,本文综述了影响有效利用饲料高粱的几种物质及其特性研究进展,以期为中国饲料营养学研究者和高粱育种者提供参考。
1影响高粱消化利用的成分
1.1酚类化合物
酚类化合物是指芳香烃中苯环上的氢原子被羟基取代所生成的化合物,根据其分子所含的羟基数目可分为一元酚和多元酚。酚类化合物有很多羟基组,被分为多种类型,包括简单化合物、酚酸、水解单宁、缩合型单宁、木质素和木脂素[2]。在谷类作物中只有高粱含有缩合型单宁,一般高粱品种都含有酚类物质,大多数品种含有黄酮类,然而,只有含B1_B2基因、籽粒有带色种皮的高粱品种含缩合型单宁。国外新培育的饲料高粱品种中一般都不含缩合型单宁,有些品种甚至不含单宁。有关高粱单宁的研究早在60年前就已开始,有大量的研究证实饲喂高单宁高粱影响肉鸡的生长发育。Nyachoti等[3]用低单宁(1.12 g/kg)和高单宁(25.7 g/kg)高粱饲喂肉鸡试验表明,高单宁比低单宁增重减少大约19.6%,采食量减少10.1%,进而影响饲料转化率降低14.1%。有关高粱单宁问题,学术界存在不同的观点,一些研究者认为低单宁高粱育种非常成功,低单宁高粱对畜牧业生产没有任何影响,认为单宁不是高粱利用的限制因子[4],相反,有人认为即使是低单宁品种仍有缩合型单宁和酚类物质存留,以高粱为主料饲喂肉鸡仍然会影响饲料转化率和鸡肉产量[5]。最近一项研究认为,具3%单宁含量的饲料对蛋鸡含氮化合物、淀粉及矿质元素的消化率均具显著抑制作用,而对脂类的消化没有产生影响[6]。饲料中的单宁也会降低反刍动物碳水化合物、蛋白质等养分的消化率,抑制瘤胃微生物酶的活性[7-8]。但与单胃动物相比,单宁对反刍动物还有积极的一面。Rumbaugh[9]研究认为单宁能与植物性饲料中的蛋白质结合,降低蛋白质在瘤胃中的溶解度和表面活性,避免被瘤胃微生物迅速降解,增加过瘤胃蛋白数量,从而提高蛋白质利用效率。
最近的报道也表明,高粱替代玉米饲喂羔羊并未抑制营养成分的消化率,随着高粱含量增加,羔羊的含肉率、血红素含量及肉中单宁含量均有增加,从而提高了肉的品质[10]。此外,Jayanegara等[11]应用整合分析法(metal-analysis)分析了反刍动物饲粮中单宁含量与甲烷形成的关系,结果显示,由于含高单宁饲粮中有机物尤其是纤维消化率的降低,甲烷排放显著减少。因此,高单宁高粱作为反刍动物饲粮配料也具优点。
1.2高粱醇溶蛋白
高粱醇溶蛋白是高粱蛋白质的主要组分,Salinas等[12]对12个高粱品种的研究表明,醇溶蛋白占到总粗蛋白质的42.4%~57.6%,平均达48.2%(表1),从表1中可以看出蛋白质含量与醇溶蛋白含量呈负相关。高粱醇溶蛋白有3种类型,即α-醇溶蛋白、β-醇溶蛋白和γ-醇溶蛋白。α-醇溶蛋白是主要类型,占到总量的82.0%,β-醇溶蛋白和γ-醇溶蛋白分别占7.5%和10.5%[13]。γ-醇溶蛋白含量与高粱蛋白质含量呈负相关,醇溶蛋白不易消化,大量的报道表明,高粱的养分利用较差都与醇溶蛋白有关[14]。
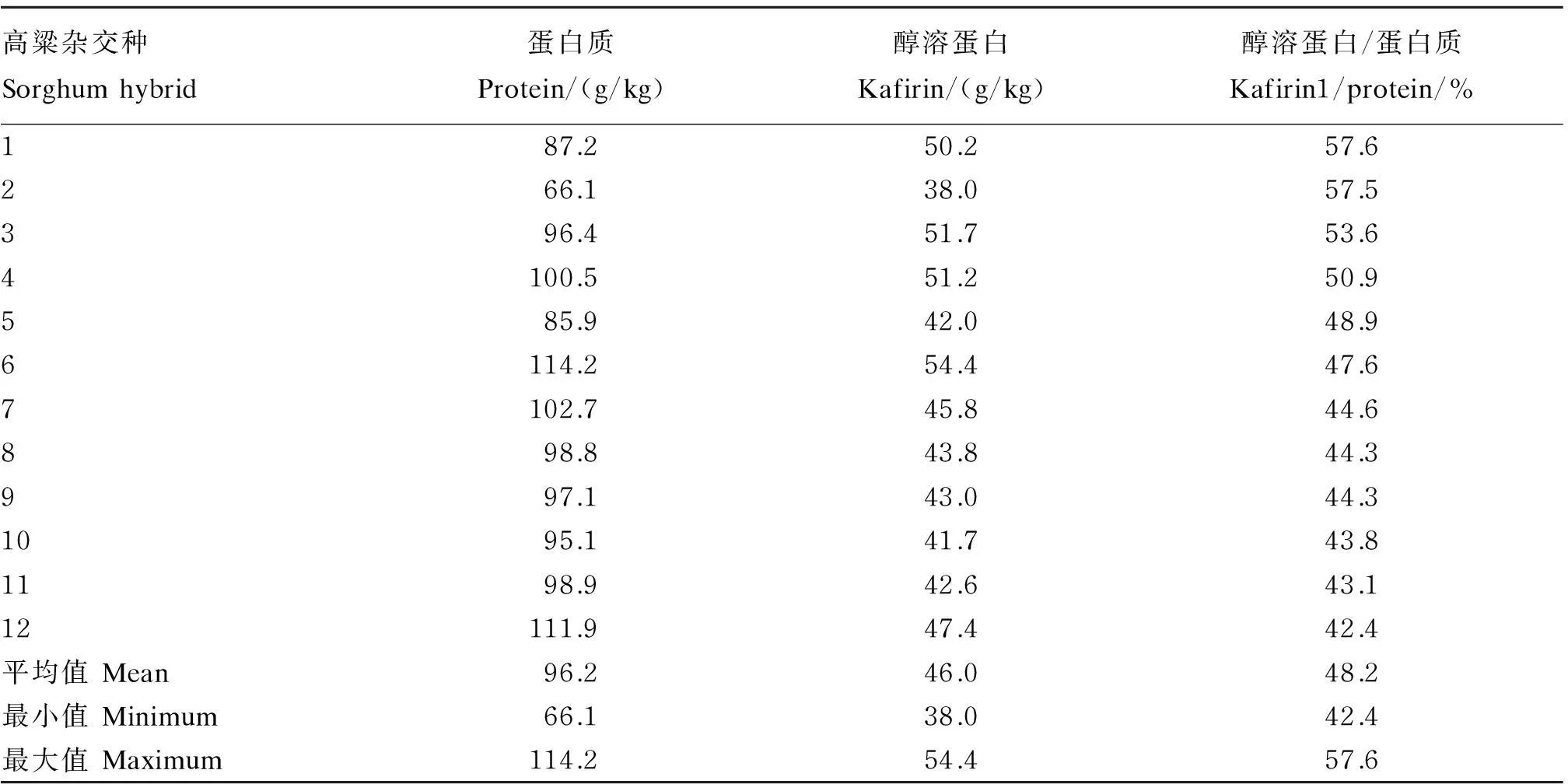
表1 12个高粱杂交种的蛋白质与醇溶蛋白含量
1.3植酸和植酸磷
植酸是高粱籽粒中的一种有机酸(6-肌醇磷酸),植酸磷为含6个磷酸基团的环状化合物。植酸是植物性饲料中磷的存在形式,能与金属离子形成稳定的络合物——植酸盐,植酸盐与蛋白质、淀粉及脂肪结合,使内源淀粉酶、蛋白酶、脂肪酶的活性降低,影响消化。高粱籽粒中所含植酸相对比其他谷类作物高,综合Selle等[15]及之前的报道,在54个高粱样本中,总磷含量为2.9 g/kg,植酸磷含量为2.41 g/kg,83%的磷以植酸磷形式存在(表2),而37个小麦品种平均总磷含量为2.20 g/kg,植酸磷含量占总磷含量的75%;大麦中的含量为1.86 g/kg,植酸磷含量占总磷含量的68%[15]。Doherty等[16]的研究表明,高粱籽粒中的植酸磷主要集中在种皮部位,麸皮中的植酸磷含量可达到5.7~16.9 g/kg,而高粱米的植酸磷含量只有0.6~1.9 g/kg。大量的研究结果表明,高粱比其他谷物含有更多的植酸磷,表2总结了54个高粱品种总磷和植酸磷的研究结果。
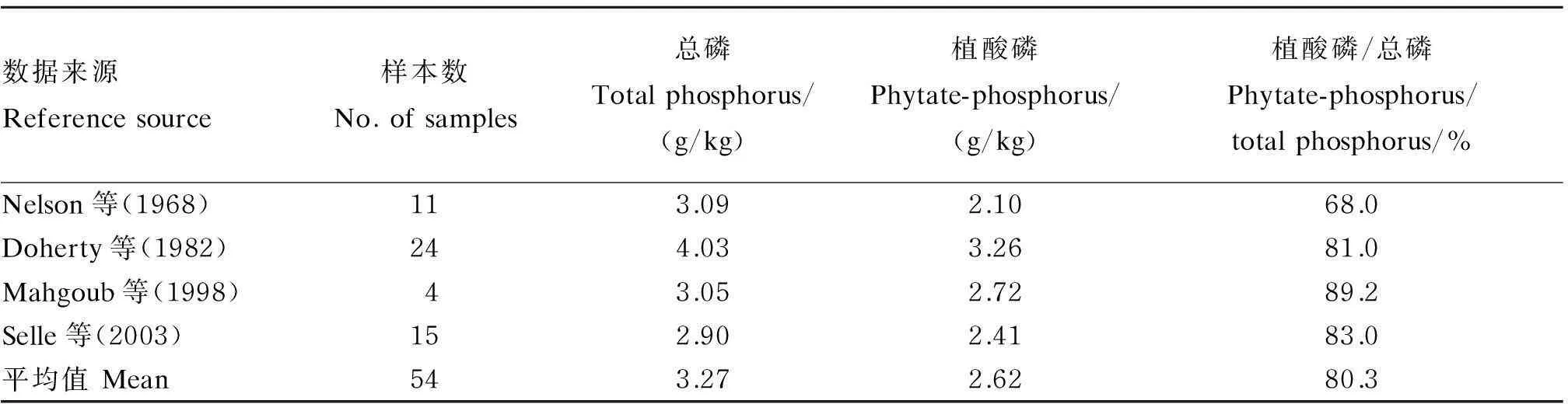
表2 54个高粱品种的总磷和植酸磷含量及其植酸磷占总磷的比率
2影响动物利用饲料高粱几种物质的特征及利用对策
2.1单宁
2.1.1单宁的凝固蛋白质特征
单宁有凝固蛋白质的功能,Ravindran等[17]的研究结果表明,高粱籽粒单宁含量从0.9 g/kg增加到1.9 g/kg,16种氨基酸的平均消化率降低9.8%。此外,单宁还影响矿物质的吸收,Hassan等[18]利用低单宁(0.28%)和高单宁(1.36%)高粱研究了单宁对鸡的生长以及钙(Ca)、磷(P)、镁(Mg)、呐(Na)、钾(K)、铁(Fe)和钴(Co)元素吸收的影响,结果表明高单宁高粱与低单宁高粱相比显著降低了肉鸡的采食量和生长量,而且高单宁高粱显著影响了肉鸡对Ca、P、Mg、Na、K、Fe和Co的吸收。
在高粱籽粒中单宁和醇溶蛋白关联紧密,Taylor等[19]证实高粱单宁更容易和γ-醇溶蛋白结合,从总醇溶蛋白和γ-醇溶蛋白的比较可看出,γ-醇溶蛋白含有更高的脯氨酸(18.7%,物质的量含量,下同),而在总醇溶蛋白中脯氨酸的含量只为11.1%,这也印证了Shull等[20]早期研究的结果,脯氨酸在γ-醇溶蛋白中含量最高,达到22.6%,而在α-醇溶蛋白和β-醇溶蛋白中含量分别为8.9%和9.7%,在总醇溶蛋白中的含量为10.4%。
2.1.2单宁对消化酶的抑制作用
据报道,单宁对动物肠道消化酶有凝结作用,因此,它能抑制酶的活性从而影响消化。Nyamambi等[21]研究了高粱单宁对胰蛋白酶和淀粉酶活性的影响,同时进行的体外试验和鸡肠道消化试验表明,在体外试验中,萃取的高粱花青素降解酶和胰蛋白酶的残余活性分别为70%~80%和35%~50%。高单宁高粱饲料与玉米饲料相比极大地降低了21~42 d小鸡的增重(42.6%)和采食量(24.2%),从而使饲料转化率变差(22.2%),玉米饲料在鸡十二指肠和回肠中残留的淀粉酶和胰蛋白酶活性要比高粱饲料高,但在体内消化中酶活性抑制不明显。Iji等[22]的研究认为25 g/kg单宁可导致鸡回肠能量消化降低10.7%,蛋白质消化率降低8.9%。然而,增加饲料中的单宁含量并不影响淀粉酶、脂肪酶的活性,也不影响空肠中麦芽糖酶、蔗糖酶、碱性磷酸酶的活性。
2.1.3利用单宁降解酶增加消化
多酚氧化酶可从梨、香蕉和鳄梨中提取得到,该酶被证明能降低高单宁含量的高粱面粉中酚类化合物的浓度[23]。Towo等[24]做了类似的研究,在高粱粥中加入蘑菇多酚氧化酶和植酸酶也取得降低高粱单宁含量的效果。研究认为,可以期待将来在以高粱为主料的饲料中开发出一种含有多酚氧化酶活性的饲料酶制剂。
2.2醇溶蛋白
2.2.1醇溶蛋白降低了氨基酸的消化率
Elkin等[25]进行了单宁、醇溶蛋白对高粱氨基酸消化方面的研究,在12个样品中,蛋白质平均含量为107.1 g/kg,单宁含量为2.0~38.8 g/kg,平均单宁含量为16.4 g/kg。试验结果显示单宁和醇溶蛋白与氨基酸消化率均为负相关,从相关系数看,醇溶蛋白对9种必需氨基酸的平均消化率比单宁影响更大。此外,醇溶蛋白还与代谢能呈显著的负相关,而单宁酸和代谢能的相关不显著(表3)。另外,9种氨基酸中有7种受醇溶蛋白的影响要比单宁的影响大,单宁只对赖氨酸的影响比醇溶蛋白高,对缬氨酸的影响两者基本相同。
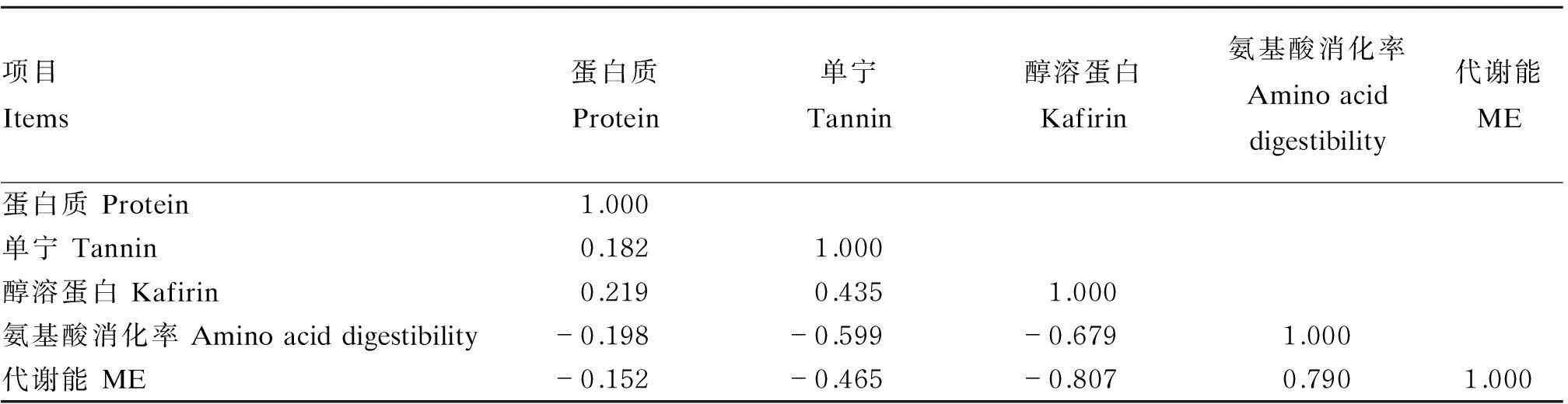
表3 十二个高粱品种蛋白质含量、单宁含量、醇溶蛋含量、氨基酸消化率及代谢能的相关性
2.2.2醇溶蛋白阻碍了淀粉的消化
Chandrashekar等[26]发现高粱淀粉的糊化温度与醇溶蛋白含量呈负相关,认为是由于与淀粉颗粒结合的蛋白质阻碍了淀粉的完全糊化。蛋白质影响了热处理后高粱淀粉的消化率,而且,高粱淀粉-蛋白质的交互作用可能影响糊化淀粉的消化率,醇溶蛋白的交互作用影响了蒸汽处理高粱淀粉消化率。Ezeogu等[27]的研究验证了上述假设,他们用三维立体荧光显微镜研究关于蒸煮对高粱胚乳淀粉蛋白基质的影响,该研究表明,玻璃质胚乳蜂窝状结构蛋白基质的萎陷是由于密集的二硫化合物与基质蛋白的交联导致蛋白膜构象的变化,这种萎陷阻止了淀粉颗粒的膨胀并阻断了淀粉酶进入基质,所以蒸煮的高粱面粉降低了淀粉的可消化性。Emmambux等[28]报道蒸煮高粱使醇溶蛋白的消化率降低了24%,蒸煮也使高粱的体外蛋白质消化率降低27%,认为蒸煮不仅仅是影响了醇溶蛋白的消化率,包括谷蛋白的消化率也受到了影响。
2.2.3通过遗传改良籽粒质地,降低高粱籽粒醇溶蛋白含量
Watterson等[29]报道,角质胚乳(90%玻璃质)高粱含59.6%的醇溶蛋白,而软质胚乳(54%玻璃质)高粱仅含47.5%的醇溶蛋白。在肉鸡饲养中用软质胚乳高粱饲喂比硬质胚乳饲喂具更好的生长表现,软质胚乳高粱饲料转化率为1.49,相比之下角质胚乳高粱为1.68。Ioerger等[30]研究显示,角质胚乳比软质胚乳含有更多的总蛋白、醇溶蛋白和二硫化合物,软质胚乳蛋白成分更易溶解。在澳大利亚的一些干旱区域,常常会收获一些小粒高粱,小粒高粱含有更多的坚硬、透明的淀粉粒(玻璃质)和不易消化的醇溶蛋白。大量研究显示醇溶蛋白尤其是γ-醇溶蛋白普遍存在于角质高粱,对高粱籽粒硬度起着重要作用,大粒软质高粱醇溶蛋白含量较低,所以比硬质高粱更易消化。因此,在高粱育种中可通过对籽粒胚乳质地的遗传改良,降低高粱籽粒醇溶蛋白含量。
2.3植酸
2.3.1植酸的抗营养特性
植酸及植酸盐不能被人和非反刍动物吸收利用,植酸摄入体内后还会和微量营养元素结合形成植酸盐,造成这些营养元素的生物有效性下降,从而造成微量元素缺乏症,因此将植酸列入抗营养因子。Knuckles等[31]通过体外消化试验研究表明,蛋白质消化率与植酸含量呈负相关,特别是蛋白质含量较高的植物性饲料,其蛋白质消化率随植酸含量降低而增高,此外,植酸阻碍多种消化酶的活性,包括淀粉水解酶、脂肪酶和蛋白水解酶,从而影响了淀粉、脂肪和维生素的消化与利用。植酸还与蛋白质发生反应,生成植酸-蛋白质二元复合物,降低蛋白质的利用率[32]。
2.3.2添加植酸酶提高高粱饲料利用价值
植酸酶,又称为肌醇六磷酸水解酶,是一种可使植酸磷复合物中的磷变成可利用磷的酸性磷酸酯酶。植酸酶对植物性饲料磷消化的促进作用被人们认识以后,畜禽养殖业就开始在饲料中添加外源性植酸酶来提高饲料磷的利用效率。最先使用植酸酶的是Nelson等[33],他们用无花果曲霉(Aspergillusficuum)产生的植酸酶来提高鸡对豆粕中磷的利用率。Selle等[34]在一个7~25 d的肉鸡饲喂试验中表明,冷制粒高粱饲料标准饲粮中加入黑曲霉(Aspergillusniger)植酸酶(600 FTU/kg)提高了鸡的增重(76%)及采食(25%),也改善了饲料转化率(47%)。据欧洲议会及欧盟理事会报道,在10 kg的育成猪的玉米-大豆饲粮中添加200 FTU/kg的植酸酶,磷和钙的利用率分别提高了32%和35%,其日增重较对照组提高了18%~28%,饲料转化率改善了18%~24%。Krasucki等[35]在母猪饲料中添加植酸酶,其粗蛋白质、氨基酸和有机物的消化率分别提高了25%、2%和7%,证明添加植酸酶到高粱饲粮中可以提高畜禽的日增重、氨基酸消化率、淀粉消化率和生长表现。Liu等[36]进行了植酸酶作为添加剂对肉鸡的生长势、养分利用、蛋白质和淀粉的消化等进行了研究,结果表明添加植酸酶显著改善了增重、采食量和饲料转化率。近年来,为了应对家禽养殖中添加无机磷酸盐对环境造成的磷污染,微生物植酸酶在家禽饲料中的利用显著增加,微生物植酸酶作为一种无机磷酸盐的替代品,在肉鸡的生长性能、饲料效率、蛋白质和氨基酸消化率、能量利用率、矿物保留、骨骼生长等方面都表现出良好效果[37]。同样,在反刍动物中,植酸的利用也是非常重要的一环,因为磷对于体内及瘤胃中微生物的生长具有关键作用。与禽类类似,人们主要通过在饲料中添加外源植酸酶降解植酸来达到利用其中磷的效果[38]。
3小结
经过数十年的研究,饲料高粱品质在不断改善,低单宁或无单宁高粱品种已在生产上广泛应用,在美国,用于动物饲料的高粱品种单宁含量已经很低,一些品种甚至不含单宁,其饲喂价值已有了明显提高。高粱型饲粮添加植酸酶等酶制剂提高了饲喂动物的日增重、氨基酸消化率、淀粉消化率和生长性能,高粱的消化性能得到了明显改善。然而,当前对高粱型饲粮的研究方面的探索和数据积累还远远落后于对小麦、大麦和玉米型饲粮的研究,如何克服高粱作为饲料的先天缺陷和发挥其抗旱、耐盐碱、耐瘠薄等先天优势值得深入研究。
参考文献:
[1]SELLE P H,CADOGAN D J,LI X,et al.Implications of sorghum in broiler chicken nutrition[J].Animal Feed Science and Technology,2010,156(3/4):57-74.
[2]CHEEKE P R.Natural toxicants in feeds,forages,and poisonous plants[M].2nd ed.Illinois:Interstate Publishers,1998.
[3]NYACHOTI C M,ATKINSON J L,LEESON S.Sorghum tannins:a review[J].World’s Poultry Science Journal,1997,53(1):5-21.
[4]FARRELL D J,PEREZ-MALDONADO RA.Tannins in feedstuffs used in the diets of pigs and poultry in Australia[C]//BROOKER J D.Tannins in livestock and human nutrition:proceedings of an international workshop.Canberra:Australian Centre for International Agricultural Research,1999:24-29.
[5]PEREZ-MALDONADO R A,TRAPPETT P,KEMSLEY M.Australian sorghums in broiler starterand finisher diets[C]//European Poultry Conference Verona.Italy,2006
[6]MAHMOOD S,ALI H,AHMAD F,et al.Estimation of tannins in different sorghum varieties and their effects on nutrient digestibility and absorption of some minerals in caged white leghorn layers[J].International Journal of Agriculture & Biology,2014,16:217-221.
[7]BUTLER L G,RIEDL D J,LEBRYK D G,et al.Interaction of proteins with sorghum tannin:mechanism,specificity and significance[J].Journal of the American Oil Chemists’ Society,1984,61(5):916-920.
[8]REDDY N R,PIERSON M D,SATHE S K,et al.Dry bean tannins:a review of nutritional implications[J].Journal of the American Oil Chemists Society,1985,62(3):541-549.
[9]RUMBAUGH M D.Breeding bloat-safe cultivars of bloat-causing legumes[C]//Proceeding of the Trilateral Workshop.Washington:Dept of Agriculture,1985,238-245.
[10]ZHONG R Z,FANG Y,WANG Y Q,et al.Effects of substituting finely ground sorghum for finely ground corn on feed digestion and meat quality in lambs infected withHaemonchuscontortus[J].Animal Feed Science and Technology,2015,doi:10.1016/j.anifeedsci.2015.08.007.
[11]JAYANEGARA A,LEIBER F,KREUZER M.Meta-analysis of the relationship between dietary tannin level and methane formation in ruminants frominvivoandinvitroexperiments[J].Journal of Animal Physiology and Animal Nutrition,2012,96(3):365-375.
[12]SALINAS I,PRA,SALINAS Y,et al.Compositional variation amongst sorghum hybrids:effect of kafirin concentration on metabolizable energy[J].Journal of Cereal Science,2006,44(3):342-346.
[13]CHAMBA E B,HALFORD N G,FORSYTH J,et al.Molecular cloning of β-kafirin,a methionine-rich protein of sorghum grain[J].Journal of Cereal Science,2005,41(3):381-383.
[14]HICKS C,BEAN S R,LOOKHART G L,et al.Genetic analysis of kafirins and their phenotypic correlations with feed quality traits,invitrodigestibility,and seed weight in grain sorghum[J].Cereal Chemistry,2001,78(4):412-416.
[15]SELLE P H,WALKER A R,BRYDEN W L.Total and phytate-phosphorus contents and phytase activity of Australian-sourced feed ingredients for pigs and poultry[J].Australian Journal of Experimental Agriculture,2003,43(5):475-479.
[16]DOHERTY C,FAUBION J M,ROONEY L W.Semiautomated determination of phytate in sorghum and sorghum products[J].Cereal Chemistry,1982,59:373-378.
[17]RAVINDRAN V,MOREL P C H,PARTRIDGE G G,et al.Influence of anEscherichiacoli-derived phytase on nutrient utilization in broiler starters fed diets containing varying concentrations of phytic acid[J].Poultry Science,2006,85(1):82-89.
[18]HASSAN I A G,ELZUBEIR E A,EI TINAY A H.Growth and apparent absorption of minerals in broiler chicks fed diets with low or high tannin contents[J].Tropical Animal Health and Production,2003,35(2):189-196.
[19]TAYLOR J,BEAN S R,IOERGER B P,et al.Preferential binding of sorghum tannins with γ-kafirin and the influence of tannin binding on kafirin digestibility and biodegradation[J].Journal of Cereal Science,2007,46(1):22-31.
[20]SHULL J M,WATTERSON J J,KIRLEIS A W.Purification and immunocytochemical localization of kafirins inSorghumbicolor(L.Moench) endosperm[J].Protoplasma,1992,171(1/2):64-74.
[21]NYAMAMBI B,NDLOVU L R,READ J S,et al.The effects of sorghum proanthocyanidins on digestive enzyme activityinvitroand in the digestive tract of chicken[J].Journal of the Science of Food and Agriculture,2000,80(15):2223-2231.
[22]IJI P A,KHUMALO K,SLIPPERS S,et al.Intestinal function and body growth of broiler chickens on maize-based diets supplemented with mimosa tannins and a microbial enzyme[J].Journal of the Science of Food and Agriculture,2004,84(12):1451-1458.
[23]MATUSCHEK E,SVANBERG U.The effect of fruit extracts with polyphenol oxidase (PPO) activity on theinvitroaccessibility of iron in high-tannin sorghum[J].Food Chemistry,2005,90(4):765-771.
[24]TOWO E,MATUSCHEK E,SVANBERG U.Fermentation and enzyme treatment of tannin sorghum gruels:effects on phenolic compounds,phytate andinvitroaccessible iron[J].Food Chemistry,2006,94(3):369-376.
[25]ELKIN R G,FREED M B,HAMAKER B R,et al.Condensed tannins are only partially responsible for variations in nutrient digestibilities of sorghum grain cultivars[J].Journal of Agricultural and Food Chemistry,1996,44(3):848-853.
[26]CHANDRASHEKAR A,KIRLEIS A W.Influence of protein on starch gelatinization in sorghum[J].Cereal Chemistry,1988,65:457-462.
[27]EZEOGU L I,DUODU K G,EMMAMBUX M N,et al.Influence of cooking conditions on the protein matrix of sorghum and maize endosperm flours[J].Cereal Chemistry,2008,85(3):397-402.
[28]EMMAMBUX M N,TAYLOR J R N.Properties of heat-treated sorghum and maize meal and their prolamin proteins[J].Journal of Agricultural and Food Chemistry,2009,57(3):1045-1050.
[29]WATTERSON J J,SHULL J M,KIRLEIS A W.Quantitation of α-,β-,and γ-kafirins in vitreous and opaque endosperm ofSorghumbicolor[J].Cereal Chemistry,1993,70:452-457.
[30]IOERGER B,BEAN S R,TUINSTRA M R,et al.Characterization of polymeric proteins from vitreous and floury sorghum endosperm[J].Journal of Agricultural and Food Chemistry,2007,55(25):10232-10239.
[31]KNUCKLES B E,KUZMICKY D D,BETSCHART A A.Effect of phytate and partially hydrolyzed phytate oninvitroprotein digestibility[J].Journal of Food Science,1985,50(4):1080-1082.
[32]SELLE P H,RAVINDRAN V.Phytate-degrading enzymes in pig nutrition[J].Livestock Science,2008,133(2/3):99-122.
[33]NELSON T S,SHIEH T R,WODZINSKI R J,et al.The availability of phytate phosphorus in soybean meal before and after treatment with a mold phytase[J].Poultry Science,1968,47(6):1842-1848.
[34]SELLE P H,RAVINDRAN V,PITTOLO P H,et al.An evaluation of microbial phytase in sorghum-based broiler diets[J].Proceedings-Australian Poultry Science Symposium,1999,11:97-100.
[35]KRASUCKI W,MATRAS J,GRELA E R.Total and ileal digestibility of protein and amino acids of the sows’ diets supplemented with microbial phytase and citric acid[J].Acta Scientiarum Polonorum Zootechnica,2004,3(2):79-90.
[36]LIU S Y,CADOGAN D J,RÉRON A,et al.Effects of phytase supplementation on growth performance,nutrient utilization and digestive dynamics of starch and protein in broiler chickens offered maize-,sorghum- and wheat-based diets[J].Animal Feed Science and Technology,2014,197:164-175.
[37]KHAN S A,CHAUDHRY H R,BUTT Y S,et al.The effect of phytase enzyme on the performance of broiler flock (a-review)[J].Poultry Science Journal,2013,1(2):117-125.
[38]HUMER E,ZEBELI Q.Phytate in feed ingredients and potentials for improving the utilization of phosphorus in ruminant nutrition[J].Animal Feed Science and Technology,2015,209:1-15.
Author, ZHANG Fuyao, professor, E-mail: zfy5607@163.com
(责任编辑武海龙)
Main Internal Factors of Influencing Sorghum Feeding Value and Its Countermeasures
ZHANG Fuyao1WU Shubiao2,3LIU Qingshan1
(1. Shanxi Key Laboratory of Sorghum Genetic and Germplasm Innovation, Sorghum Institute of Shanxi Academy of Agricultural Science, Jinzhong 030600, China; 2. Biotechnology Center of Shanxi Academy of Agricultural Science, Taiyuan 030031, China; 3. School of Environmental and Rural Science, University of New England, Armidale NSW 2351, Australia)
Abstract:The studies demonstrate that three types of chemicals which adversely affect the utilization of nutrients in the most of cases are present in the sorghum when it is used as an animal feed ingredient. These include polyphenol, kafirin, and phytate. This paper reviewed the chemical and physical characteristics of these chemicals, their abilities to counteract with digestive enzymes, and mostly negative impact on digestibility of nutrients including starch, amino acids and minerals in animals. The benefits to supplement phytase in sorghum-based animals feed to improve nutrient digestibility and thus overall animal growth performance were also discussed. On the other hand, some of them such as tannin are beneficial to ruminant in different ways when sorghum is fed. It is concluded that with careful selection of suitable varieties and supplementation of beneficial enzymes, sorghum can be effectively used as a major feed ingredient in animal production.[Chinese Journal of Animal Nutrition, 2016, 28(1):1-8]
Key words:sorghum; animals feed; polyphenol; kafirin; phytate
中图分类号:S852.2
文献标识码:A
文章编号:1006-267X(2016)01-0001-08
作者简介:张福耀(1956—),男,山西盂县人,研究员,主要从事高粱遗传育种研究。E-mail: zfy5607@163.com
基金项目:山西省回国留学人员重点科研资助项目(2012-重点6);现代农业产业技术体系建设专项资金(CARS-06-01-01)
收稿日期:2015-07-17
doi:10.3969/j.issn.1006-267x.2016.01.001
