热带假丝酵母菌与桑叶黄酮对犊牛营养物质代谢和瘤胃发酵的影响
2016-04-27杨春涛刁其玉曲培滨司丙文马俊南周玉财
杨春涛 刁其玉 曲培滨 司丙文 马俊南 周玉财 屠 焰*
(1.中国农业科学院饲料研究所,奶牛营养学北京市重点实验室,北京100081;
2.首农辛普劳(北京)农业科技有限公司,北京100081)
热带假丝酵母菌与桑叶黄酮对犊牛营养物质代谢和瘤胃发酵的影响
杨春涛1刁其玉1曲培滨1司丙文1马俊南1周玉财2屠焰1*
(1.中国农业科学院饲料研究所,奶牛营养学北京市重点实验室,北京100081;
2.首农辛普劳(北京)农业科技有限公司,北京100081)
摘要:本文旨在研究饲粮中添加热带假丝酵母菌(CT)与桑叶黄酮(MLF)对断奶前后犊牛能量与氮代谢、瘤胃微生物蛋白合成以及瘤胃发酵的影响。选取(20±2)日龄中国荷斯坦公犊牛48头,随机分为4组,对照组(CON)饲喂基础饲粮,断奶前为代乳品和开食料,断奶后为开食料;CT组在基础饲粮中添加CT;MLF组添加MLF;CM组添加CT和MLF。犊牛于56日龄断奶(代乳品),试验期60 d。分别于犊牛28、42、56和80日龄采集瘤胃液,35和63日龄进行消化代谢试验。结果表明:与CT组相比,CM组犊牛断奶前代谢能显著提高(P<0.05),较CON组,断奶后CM组氮利用率显著提高(P<0.05);断奶前MLF组较CON和CT组氮的生物学价值显著提高(P<0.05)。与CON组相比,CT组显著提高了28~80日龄瘤胃液pH和56、80日龄瘤胃液微生物蛋白含量(P<0.05),CT、MLF和CM组瘤胃液氨态氮浓度无显著变化(P>0.05);与CON组相比,56日龄MLF组总挥发性脂肪酸浓度和丁酸含量显著提高(P<0.05);42日龄乙酸/丙酸CT和MLF组较CON组有提高的趋势(P=0.090),各组间乙酸和戊酸含量无显著差异(P>0.05)。结果提示,饲粮添加CT有助于改善断奶前犊牛瘤胃液pH和促进瘤胃微生物蛋白的合成;添加CT和MLF有助于提高断奶前犊牛饲粮代谢能和氮的生物学价值,提高断奶后犊牛总能代谢率和氮的利用率,降低粪能和总排出氮量,同时具有改善瘤胃发酵的作用,并且CT与MLF联合使用效果优于单一添加。
关键词:犊牛;热带假丝酵母菌;桑叶黄酮;微生物蛋白;营养物质代谢;瘤胃发酵
犊牛从出生到适应外界环境,再经历断奶,短时间内在免疫机能和营养物质消化代谢等方面发生了巨大改变[1]。其瘤胃健康发育对营养物质的吸收利用以及成年后生产性能的发挥具有重要的意义。酵母益生类物质作为反刍动物瘤胃发酵的天然调控剂,不仅可以促进瘤胃发育、维持瘤胃液pH稳定、改善瘤胃内环境,还可以提高营养物质利用率[2]。其中热带假丝酵母菌(Candidatropicalis,CT)作为反刍动物饲料添加剂在降解饲粮纤维方面具有巨大的潜力[3],在瘤胃中通过激活纤维分解菌,增加乙酸、丙酸、丁酸等挥发性脂肪酸(VFA)含量,为反刍动物提供能量,同时还可以提高饲粮的体外干物质(DM)消化率[4]。黄酮类化合物作为植物次级代谢产物,广泛存在于大多数高等植物茎叶中[5],其通过调节一些代谢关键酶的活性和表达,进而调节脂类和碳水化合物的代谢[6],提高营养物质的吸收利用率。然而,单独使用酵母制剂在反刍动物中的应用效果并不理想。在一些研究中使用活性酵母或者酵母培养物改善了动物生产性能,但在另一些研究中活性酵母并没有改善动物生产性能,甚至使用酵母培养物制剂后导致生产性能降低。Timmerman等[7]研究发现,由于微生物及产生的代谢产物间潜在的协同作用,不同菌属益生菌或益生菌与天然植物提取物联合使用有可能比单一菌株益生菌更有效。因此,本试验在犊牛饲粮中添加CT与桑叶黄酮(mulberry leaf flavonoids,MLF),旨在探讨CT与MLF及其两者复合物的相互作用对断奶前后犊牛能量和氮代谢、瘤胃微生物蛋白(MCP)合成以及瘤胃发酵的影响,为益生菌与植物提取物在犊牛培育中的应用提供理论支持。
1材料与方法
1.1试验时间与地点
试验于2014年8月至2014年11月在北京市三元绿荷西郊一场进行。试验期60 d,其中预试期7 d,正试期53 d。
1.2试验设计与饲粮
本试验采用单因素随机设计,共分4组。对照组(CON)饲喂基础饲粮;CT组在基础饲粮中添加CT;MLF组在基础饲粮中添加MLF;CM组则在基础饲粮添加CT及MLF。CT制剂(活菌含量5×109CFU/g;北京华农生物工程有限公司生产)添加总量根据Chung等[8]研究结果为每头犊牛5×109CFU/d。MLF(黄酮含量50 mg/g;提取工艺:桑叶经物理破碎、超声波提取、抽滤、减压浓缩、真空干燥成粉末;西安飞达生物技术有限公司生产)添加总量根据陈丹丹等[9]研究结果为每头3 g/d。基础饲粮为不含抗生素和微生物制剂的代乳品和开食料,其中代乳品是依照国家发明专利CN 02128844.5由北京精准动物营养研究中心生产提供。基础饲粮营养水平见表1。
1.3试验动物与饲养管理
选用自然分娩、初生重(40±2.5) kg、饲喂足量初乳及鲜乳的(20±2)日龄中国荷斯坦公犊牛48头。随机分为4个组,每组12头。犊牛21~27日龄为试验预试期,进行代乳品过渡,27日龄时全部换成代乳品。代乳品用煮沸后冷却到50~60 ℃的热水按DM占12.5%的比例冲泡成乳液,待温度降至40 ℃左右饲喂犊牛,每天分2次饲喂(08:00和15:00),每头犊牛每天饲喂量为体重的12%(每2周根据体重增长调整1次)。50~56日龄进行断代乳品过渡,56日龄时完全断代乳品。断奶前后将所需添加的制剂在每日晨饲时分别添加到代乳品乳液或开食料中。试验期开食料自由采食,并保证干净、充足水源。犊牛采用犊牛岛单独饲养,每个犊牛岛占地面积为1.6 m×3.6 m。

表1 开食料组成及营养水平、代乳品
预混料为每千克开食料提供 Premix provided the following per kg of the starter:VA 15 000 IU,VD 5 000 IU,VE 50 mg,Fe 90 mg,Cu 12.5 mg,Mn 30 mg,Zn 90 mg,Se 0.3 mg,I 1.0 mg,Co 0.5 mg。
1.4样品采集与测定
1.4.1饲料样品
试验过程中采集具有代表性的代乳品、开食料样品,依照AOAC(2000)[10]的方法测定其营养成分含量,其中:总能(GE)以PARR-6400全自动氧弹量热仪测定;粗蛋白质(CP)含量以KDY-9830全自动凯氏定氮仪测定;粗脂肪(EE)含量采用ANKOM-XT15i全自动脂肪分析仪测定;同时测定样品中有机物(OM)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)、钙(Ca)和磷(P)含量。
1.4.2消化代谢试验样品
每组选取接近平均体重4头健康犊牛,于35和63日龄利用消化代谢笼(专利号ZL 201420358189.7)采取全收粪尿法分别进行犊牛断奶前与断奶后消化代谢试验。试验期均为7 d,其中预试期3 d,正试期4 d,记录每头犊牛每天实际采食量、排粪量和排尿量。正试期连续采集日粪便总量的10%作为混合样品,每100 g鲜粪加入10%的稀盐酸10 mL固氮。连续收集每头犊牛日排尿量的1%作为混合样品,用10%稀盐酸调整尿样使pH≤3。正试期每天采集具有代表性的代乳品和开食料样品。收集的饲料、粪、尿样品于-20 ℃冷冻保存待测。
代乳品、开食料和粪样中DM、GE和CP含量以及尿能与尿氮测定参考AOAC(2000)中方法进行测定[10],试验仪器如上所述。计算饲粮消化能、代谢能、GE表观消化率、GE代谢率和消化能代谢率,公式如下:
消化能=摄入GE-粪能;
代谢能=摄入GE-粪能-尿能-甲烷能;
GE表观消化率=消化能/摄入GE;
GE代谢率=代谢能/摄入GE;
消化能代谢率=代谢能/消化能。
式中:甲烷能按GE 8%计算[11]。
1.4.3瘤胃液样品
每组选取接近组平均体重的4头犊牛,分别于28、42、56和80日龄晨饲前,采用灭菌口腔导管采集瘤胃内容物100 mL,4层纱布过滤后,立即用便携式pH计(testo-206-pp)测定瘤胃液pH,然后分装于10 mL灭菌离心管中,放入液氮带回实验室,-80 ℃保存待测。
瘤胃液4 ℃解冻,取上清液1 mL,加25%偏磷酸溶液0.3 mL,振荡3~5 s混匀后,静置30 min,15 000×g离心15 min后,将上清液分装0.5 mL。瘤胃液中VFA含量参照Cao等[12]方法测定;氨态氮(NH3-N)浓度采用靛酚比色法[13]测定;MCP含量参照Makkar等[14]的方法测定。
1.5统计分析
以SAS 9.2软件进行统计。除消化代谢试验中能量与氮的数据利用one-way ANOVA模型进行分析外,其他数据利用MIXED模型进行分析。差异显著(P<0.05)时采用最小显著差数法(least significant difference,LSD)进行比较。
one-way ANOVA模型为:
Yij=μ+Ti+εij。
MIXED模型为:
Yijk=μ+Ti+Dj+TDij+C(T)ik+εijk。
2结果与分析
2.1CT与MLF对犊牛采食量的影响
由表2可知,断奶前饲粮添加CT与MLF有提高总DM采食量的趋势(P=0.086),CM组开食料采食量显著高于CON组(P<0.05)。代乳品采食量和断奶后开食料采食量组间无显著差异(P>0.05)。
2.2CT与MLF对犊牛能量消化代谢的影响
由表3可知,饲粮添加CT与MLF在有提高断奶前犊牛摄入GE(P=0.067)和消化能(P=0.089)的趋势,同时CM组代谢能显著高于CON组(P<0.05)。与CON组相比,断奶后CM组通过降低粪能[差异显著(P<0.05)]显著提高了GE代谢率(P<0.05),而CT组与MLF组间GE代谢率无显著差异(P>0.05)。试验全期饲粮添加CT与MLF对犊牛尿能无显著影响(P>0.05)。
2.3CT与MLF对犊牛氮消化代谢的影响
由表4可知,犊牛断奶前饲粮添加CT与MLF表现出提高沉积氮(P=0.058)和氮利用率(P=0.062)的趋势,同时MLF组较CON和CT组显著提高了氮的生物学价值(P<0.05)。断奶后通过降低尿氮排出量及总排出氮量,CT和CM组较其他组显著提高了氮利用率(P<0.05);饲粮添加CT和MLF表现出提高沉积氮(P=0.076)和氮的生物学价值(P=0.068)的趋势。然而,添加CT与MLF对断奶前后犊牛摄入氮和粪氮排出量无显著影响(P>0.05)。

表2 热带假丝酵母菌与桑叶黄酮对犊牛采食量的影响(干物质基础)
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as below.
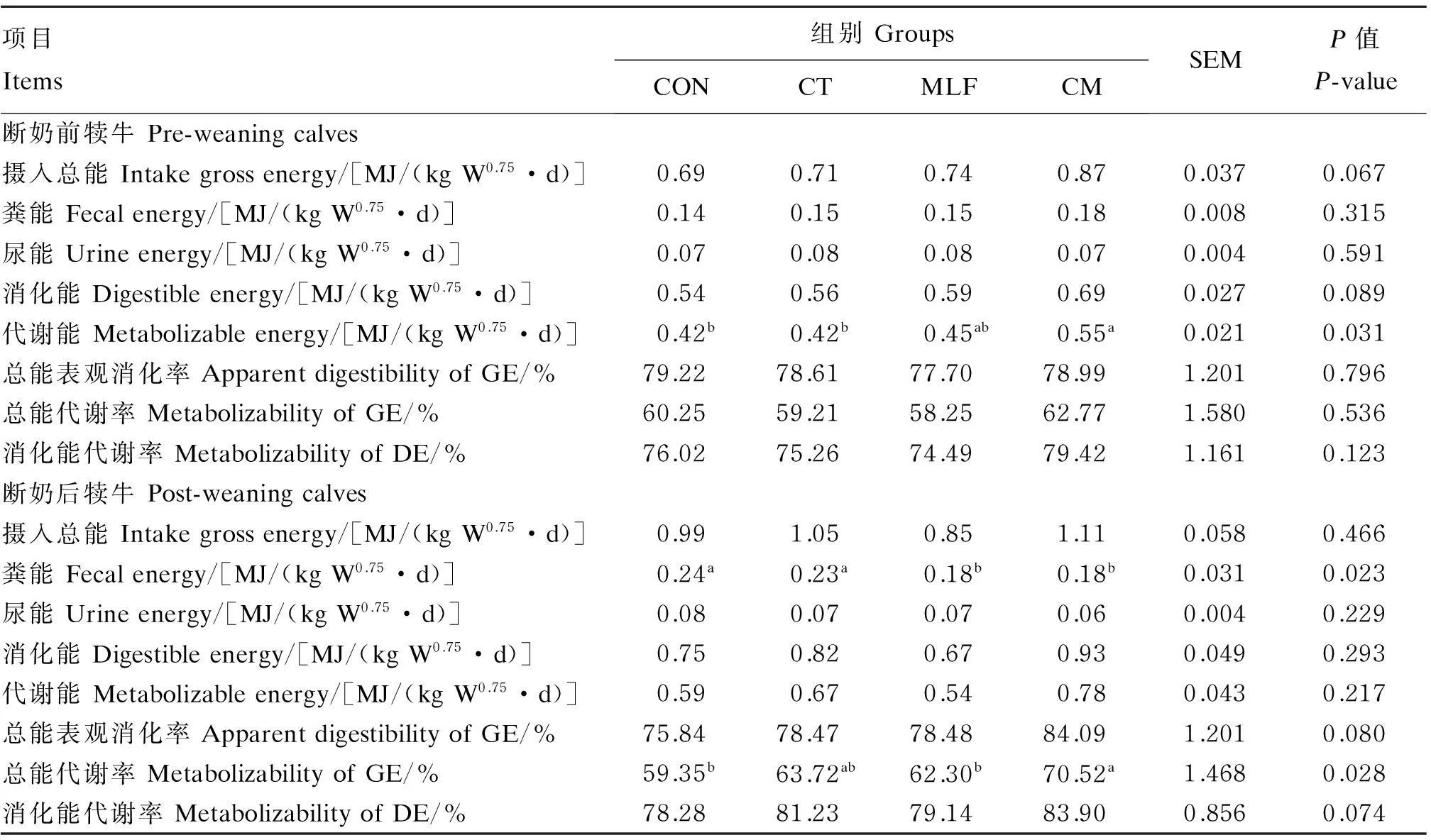
表3 热带假丝酵母菌与桑叶黄酮对犊牛能量消化代谢的影响(干物质基础)
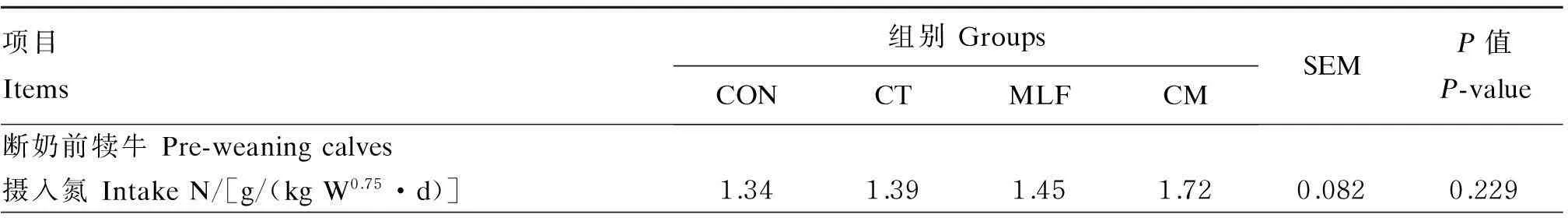
表4 热带假丝酵母菌与桑叶黄酮对犊牛氮消化代谢的影响(干物质基础)
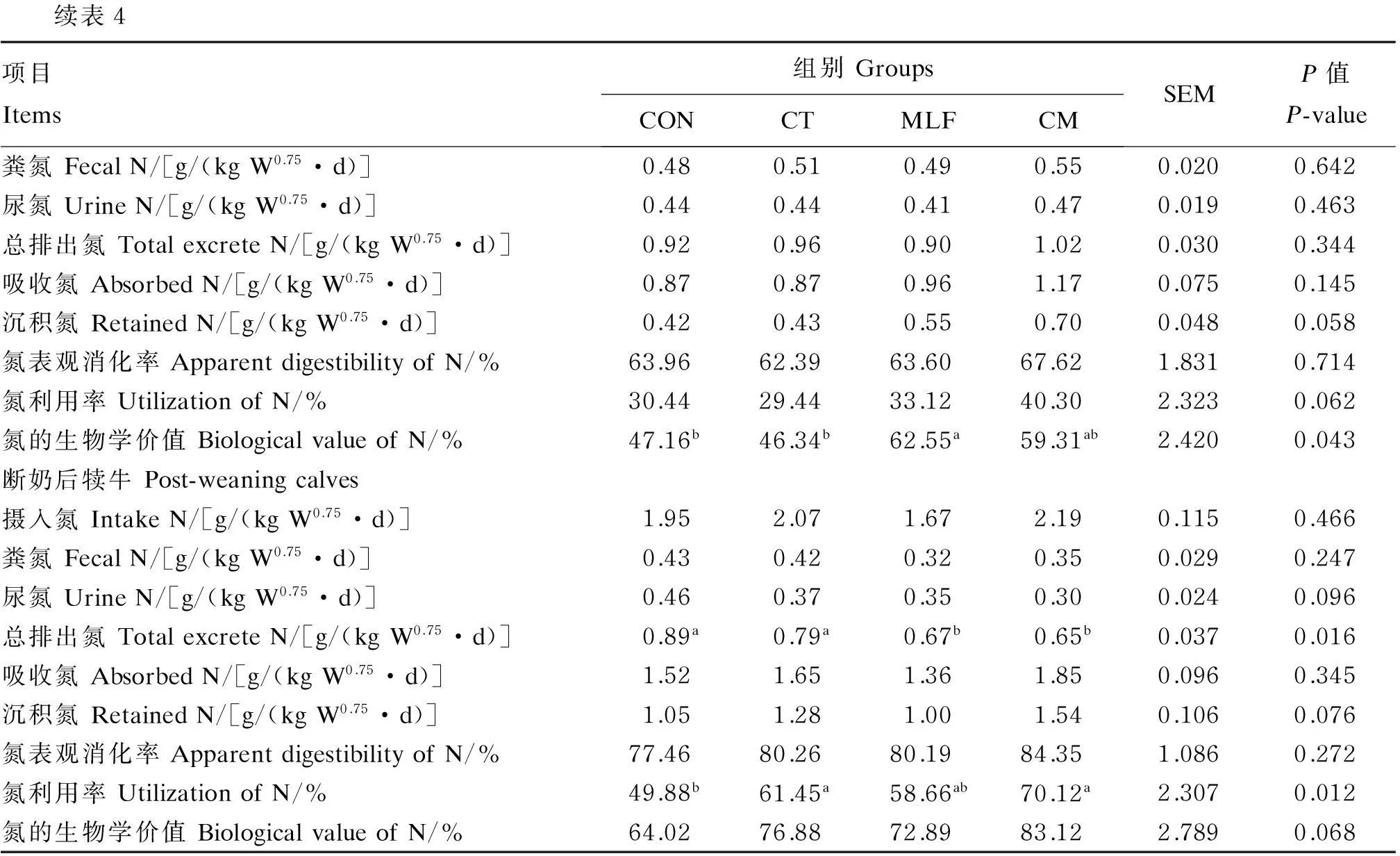
续表4项目Items组别GroupsCONCTMLFCMSEMP值P-value粪氮FecalN/[g/(kgW0.75·d)]0.480.510.490.550.0200.642尿氮UrineN/[g/(kgW0.75·d)]0.440.440.410.470.0190.463总排出氮TotalexcreteN/[g/(kgW0.75·d)]0.920.960.901.020.0300.344吸收氮AbsorbedN/[g/(kgW0.75·d)]0.870.870.961.170.0750.145沉积氮RetainedN/[g/(kgW0.75·d)]0.420.430.550.700.0480.058氮表观消化率ApparentdigestibilityofN/%63.9662.3963.6067.621.8310.714氮利用率UtilizationofN/%30.4429.4433.1240.302.3230.062氮的生物学价值BiologicalvalueofN/%47.16b46.34b62.55a59.31ab2.4200.043断奶后犊牛Post-weaningcalves摄入氮IntakeN/[g/(kgW0.75·d)]1.952.071.672.190.1150.466粪氮FecalN/[g/(kgW0.75·d)]0.430.420.320.350.0290.247尿氮UrineN/[g/(kgW0.75·d)]0.460.370.350.300.0240.096总排出氮TotalexcreteN/[g/(kgW0.75·d)]0.89a0.79a0.67b0.65b0.0370.016吸收氮AbsorbedN/[g/(kgW0.75·d)]1.521.651.361.850.0960.345沉积氮RetainedN/[g/(kgW0.75·d)]1.051.281.001.540.1060.076氮表观消化率ApparentdigestibilityofN/%77.4680.2680.1984.351.0860.272氮利用率UtilizationofN/%49.88b61.45a58.66ab70.12a2.3070.012氮的生物学价值BiologicalvalueofN/%64.0276.8872.8983.122.7890.068
2.4CT与MLF对犊牛瘤胃液pH、NH3-N浓度和MCP含量的影响
由表5可知,饲粮添加CT提高了犊牛瘤胃液pH,其中28、42日龄CT组分别显著高于CM与MLF组(P<0.05)。断奶前后添加CT与MLF对犊牛瘤胃液NH3-N浓度无显著影响(P>0.05)。随着犊牛日龄增加瘤胃液MCP含量显著提高(P<0.05),断奶后不同组表现出差异,其中56、80日龄CT组、80日龄MLF组均显著高于CON组(P<0.05)。
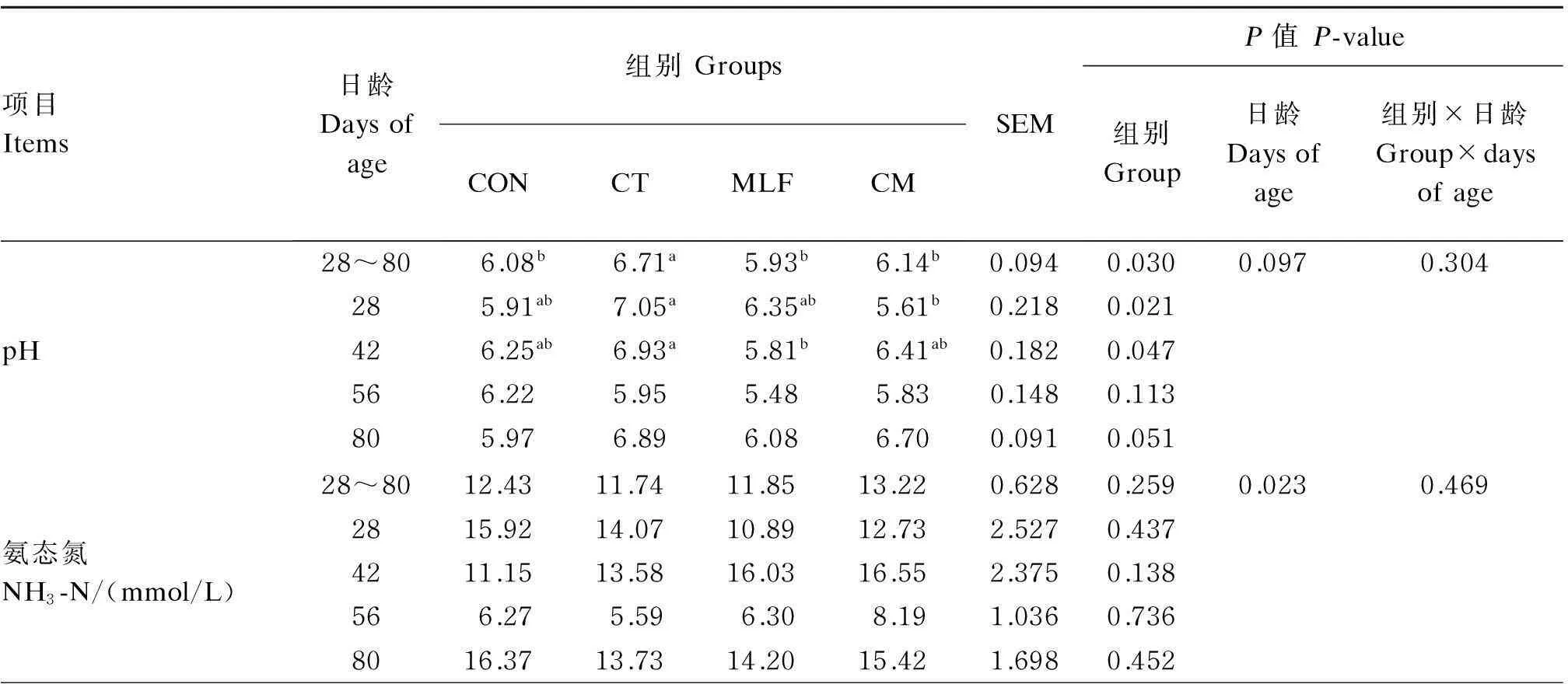
表5 热带假丝酵母菌与桑叶黄酮对犊牛瘤胃液pH、NH3-N浓度和MCP含量的影响

续表5项目Items日龄Daysofage组别GroupsCONCTMLFCMSEMP值P-value组别Group日龄Daysofage组别×日龄Group×daysofage微生物蛋白MCP/(mg/mL)28~801.431.891.881.750.0800.3440.0240.008280.991.311.511.460.0980.145421.381.781.631.740.0740.271561.62b2.01a1.98ab1.77ab0.2100.018801.68b2.45a2.43a1.97ab0.2690.009
2.5CT与MLF对犊牛瘤胃液VFA含量的影响
由表6可知,添加CT与MLF对犊牛瘤胃液VFA产生了一定的影响,同时随着犊牛日龄的增加总挥发性脂肪酸(TVFA)浓度和丁酸含量显著提高(P<0.05)。56日龄MLF组TVFA浓度显著高于CON组(P<0.05),而其他日龄各组间无显著差异(P>0.05)。与CON组相比,CT组显著降低
了42日龄犊牛瘤胃液丙酸含量(P<0.05),而MLF组显著提高了56日龄丁酸含量(P<0.05)。从表中还可以看出,42日龄时CT和MLF组与CON组相比有提高乙酸/丙酸的趋势(P=0.090),然而各组间乙酸和戊酸含量无显著差异(P>0.05)。
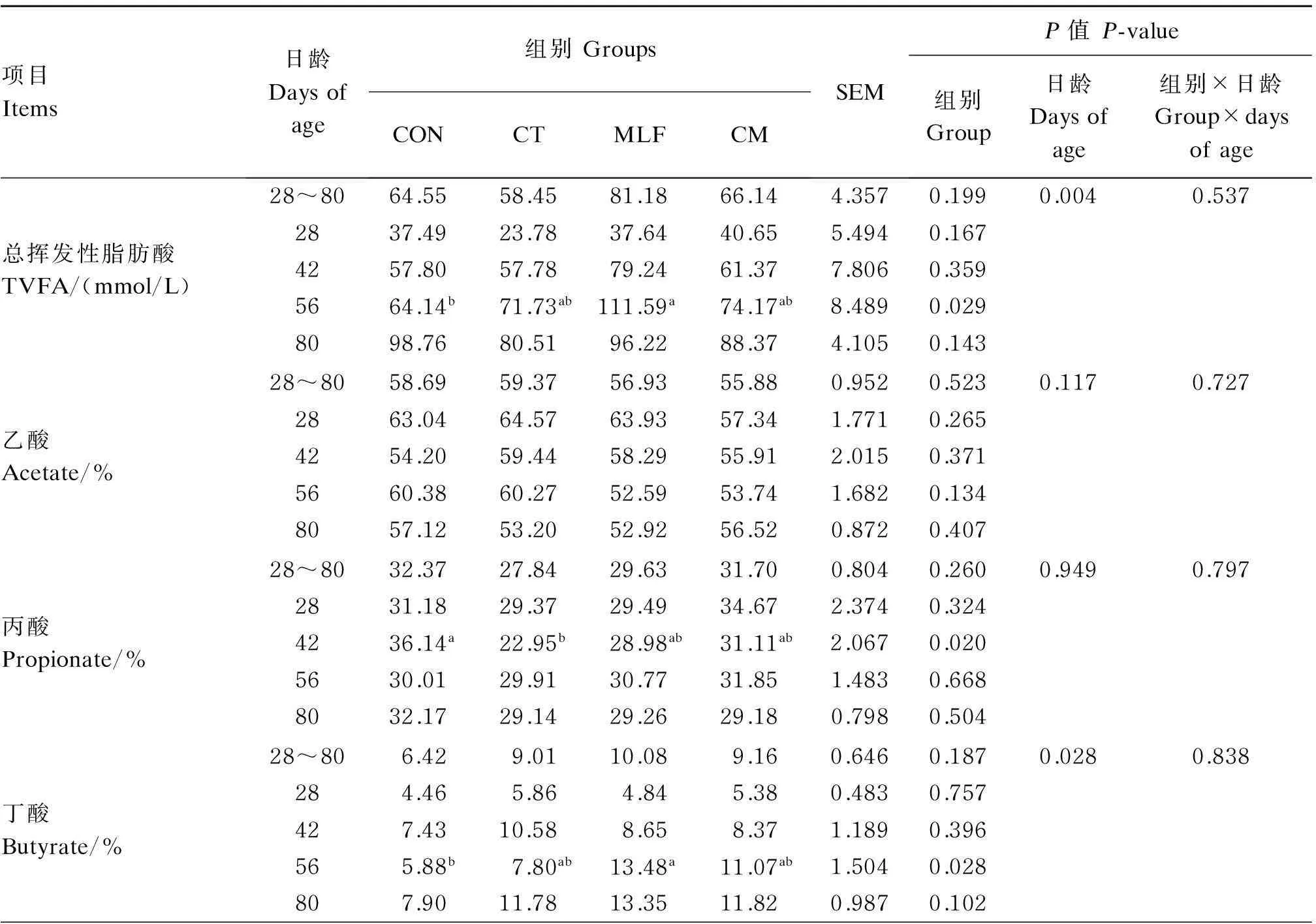
表6 热带假丝酵母菌与桑叶黄酮对犊牛瘤胃液VFA含量的影响
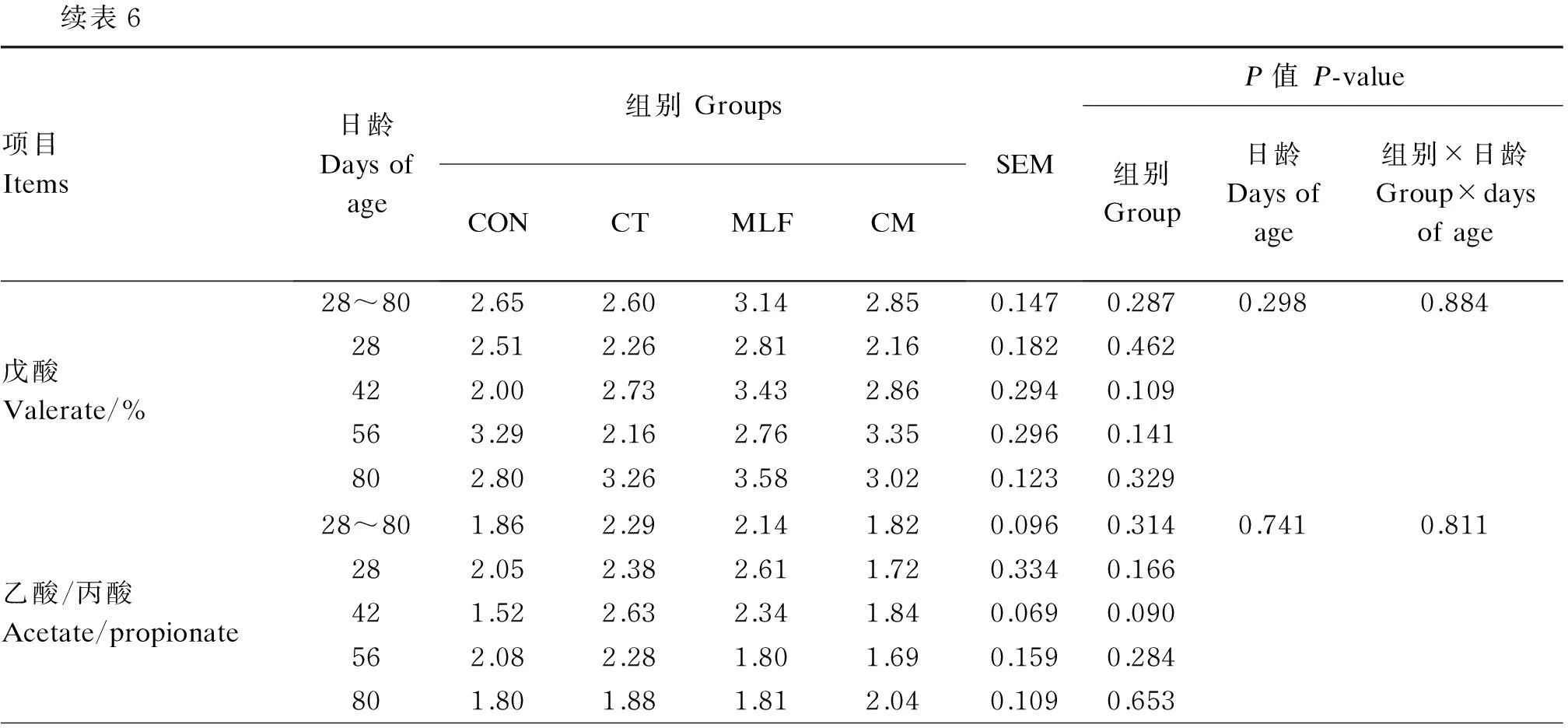
续表6项目Items日龄Daysofage组别GroupsCONCTMLFCMSEMP值P-value组别Group日龄Daysofage组别×日龄Group×daysofage戊酸Valerate/%28~802.652.603.142.850.1470.2870.2980.884282.512.262.812.160.1820.462422.002.733.432.860.2940.109563.292.162.763.350.2960.141802.803.263.583.020.1230.329乙酸/丙酸Acetate/propionate28~801.862.292.141.820.0960.3140.7410.811282.052.382.611.720.3340.166421.522.632.341.840.0690.090562.082.281.801.690.1590.284801.801.881.812.040.1090.653
3讨论
3.1CT与MLF对犊牛能量和氮消化代谢的影响
胃肠道的发育直接影响到动物对营养物质的消化利用。张昌吉等[15]与孙耀贵等[16]分别通过对绵羊和肉鸡研究发现,饲粮添加酵母菌与黄酮类化合物较无添加的对照组具有提高营养物质表观消化率的作用。从本试验可以看出,添加CT与MLF复合物通过提高断奶前犊牛开食料采食量,增加摄入GE从而提高了营养物质的代谢能,而断奶后饲粮添加MLF及其与CT的复合物提高了GE表观消化率和GE代谢率,降低了粪能的排出量。这说明饲粮添加CT与MLF有助于提高哺乳期犊牛食欲、增加GE的摄入。代乳品中碳水化合物主要是乳糖、葡萄糖以及半乳糖,而开食料中主要是淀粉,断奶后犊牛饲粮中添加MLF及其与CT的复合物,可能是通过刺激胃肠道促进消化酶的分泌或提高淀粉酶活性从而提高了碳水化合物的消化吸收[7],降低了粪能。
对于氮的消化利用从结果中可以看出,饲粮添加MLF及其与CT的复合物显著提高了断奶前犊牛氮的生物学价值和断奶后氮的利用率。这可能是由于CT通过刺激瘤胃多种蛋白质分解菌,更多将饲粮中CP降解合成为MCP[17],MLF则通过提高胃肠道消化酶的活性,两者相互作用共同提高了氮的利用率,这与Lee等[18]研究结果一致。从本试验还可以看出断奶后(63日龄)犊牛饲粮添加MLF及其与CT的复合物降低了总排出氮量(23.49~24.71 g/d),低于Hill等[19]的结果(19.3~34.9 g/d;8周龄),这可能是由于MLF与CT产生的小肽、氨基酸等多种代谢产物间相互作用[5],改善了饲粮氨基酸的平衡从而提高了氮利用率减少了粪尿中氮排出。结合能量与氮的消化代谢结果可以发现,CT与MLF联合使用较单独使用表现出明显优势,可能是由于酵母产生的有机酸和维生素等代谢产物与黄酮类化合物相互作用,共同促进了动物机体对能量和氮的利用[20-21]。
3.2CT与MLF对犊牛瘤胃发酵的影响
反刍动物瘤胃液pH、NH3-N和VFA作为发酵的重要指标,具有反映瘤胃功能和瘤胃内环境稳定性的作用[22]。本试验中,饲粮添加CT提高了断奶前犊牛瘤胃液pH,这与Bayatkouhsar等[23]利用乳酸杆菌对犊牛瘤胃液pH研究的结果一致。瘤胃液pH对瘤胃微生物,尤其纤维分解菌具有重要的影响,随着瘤胃液pH升高,纤维分解菌活性增强[24],这对于犊牛瘤胃有益菌群的建立具有重要的作用。瘤胃液NH3-N浓度处于动态变化之中,反映了瘤胃中蛋白质降解与MCP合成的动态平衡关系,其中适宜微生物生长繁殖的浓度为6~30 mg/dL[25]。Anderson等[26]研究发现,断奶后犊牛瘤胃液NH3-N浓度要显著低于断奶前,本试验也出现相似的结果。可能是由于新生犊牛瘤胃功能发育不全,随着日龄增加动物发育成熟以及微生物菌群逐渐建立,瘤胃微生物在增殖的过程中,将更多的NH3-N转化为MCP,降低了NH3-N浓度[27],这也正好解释了随着犊牛日龄的增加瘤胃液MCP增加的现象。瘤胃中MCP可为反刍动物提供50%~80%的小肠可吸收蛋白质[28],其在瘤胃的合成主要与微生物可利用能量与蛋白质相关,添加CT与MLF提高了断奶犊牛瘤胃MCP的合成,说明CT与MLF可以促进瘤胃微生物对饲粮中的能量和蛋白质的利用,同样代谢试验结果也证实添加CT与MLF有助于提高犊牛营养物质消化利用的作用。庞德公等[29]研究结果也表明,饲粮添加产朊假丝酵母对瘤胃液NH3-N浓度无影响的同时,提高了瘤胃微生物对饲料蛋白质利用效率,进而促进瘤胃微生物的生长。
3.3CT与MLF对犊牛瘤胃发酵产物的影响
VFA作为反刍动物瘤胃发酵的重要产物,可为反刍动物提供70%~80%的代谢能。其中乙酸主要为粗饲料发酵产物,主要通过三羧酸循环氧化产生ATP用于细胞维持和组织合成[30];丙酸主要由可溶性碳水化合物发酵产生经瘤胃壁吸收后成为血液葡萄糖合成的主要前体物。从本试验可以发现,随着犊牛日龄的增加瘤胃液TVFA浓度显著提高,说明犊牛瘤胃功能逐渐发育完善。饲粮添加CT、MLF及两者复合物显著了瘤胃发酵,其中56日龄时与CON组相比, CT、MLF及CM组TVFA浓度分别提高了11.83%、73.98%和15.64%,添加MLF瘤胃液TVFA达到111.59 mmol/L。这与Sun等[22]利用纳豆芽孢杆菌对犊牛研究结果一致,同时Newbold等[31]研究也发现对绵羊饲喂植物提取物精油后显著增加了瘤胃液TVFA的浓度,然而Spanghero等[32]却发现添加植物提取物却降低了瘤胃液VFA含量。造成这种差异可能是与所添加的植物提取物类型、剂量以及试验的动物不同有关[33]。添加CT通过降低丙酸含量增加了乙酸/丙酸,改善了瘤胃发酵模式。究其原因可能是CT在瘤胃内与其他微生物相互作用刺激瘤胃微生物快速繁殖,利用了大量丙酸,这也解释了饲粮中添加CT有助于MCP合成的现象。从本试验还可以发现,添加MLF显著提高了丁酸含量。丁酸对于幼龄反刍动物的瘤胃发育至关重要,不仅可以促进瘤胃上皮细胞增殖和分化,还可以提高胃肠道敏感性和促进肠道蠕动[34]。这说明饲粮添加MLF有助于断奶前后犊牛瘤胃发育。然而,添加CT瘤胃液丁酸含量却无显著变化,这与Sun等[22]和丁洪涛等[35]得出的饲粮中分别添加纳豆芽孢杆菌与产朊假丝酵母对瘤胃液丁酸含量均无显著影响的结果相似。
3.4CT与MLF对犊牛影响的异同
总结上述结果,可以发现饲粮添加CT与MLF均对犊牛能量和蛋白质的利用产生了积极作用。然而,CT主要通过利用自身产生的多种代谢产物刺激瘤胃微生物大量生长和繁殖,增加瘤胃MCP的含量以及降低丙酸含量,提高瘤胃液pH、能量与氮的利用率。MLF作为雌二醇类似物,通过调节一些代谢关键酶的活性和表达,促进胃肠道消化酶分泌,提高犊牛饲粮能量与蛋白质消化利用率。而CT与MLF联合使用,则在提高营养物质消化利用和促进瘤胃MCP合成与发酵等方面均表现出优势。
4结论
① 饲粮添加CT有助于改善断奶前犊牛瘤胃液pH和促进瘤胃MCP的合成。
② 添加CT和MLF有助于提高断奶前犊牛饲粮代谢能和氮的生物学价值,提高断奶后犊牛总能代谢率和氮的利用率,降低粪能和总排出氮量,同时具有改善瘤胃发酵的作用,并且CT与MLF联合使用效果优于单一添加。
参考文献:
[1]HAMMON H M,STEINHOFF-WAGNER J,SCHNHUSEN U,et al.Energy metabolism in the newborn farm animal with emphasis on the calf:endocrine changes and responses to milk-born and systemic hormones[J].Domestic Animal Endocrinology,2012,43(2):171-185.
[3]MARRERO Y,CASTILLO Y,BURROLA-BARRAZA M E,et al.Morphological,biochemical and molecular identification of the yeastLevica25:A Potential Ruminal Microbial Additive[J].Global Veterinaria,2011,7(1):60-65.
[4]MARRERO Y,CASTILLO Y,RUIZ O,et al.Feeding of yeast (Candidaspp.) improvesinvitroruminal fermentation of fibrous substrates[J].Journal of Integrative Agriculture,2015,14(3):514-519.
[6]KOBAYASHI Y,MIYAZAWA M,KAMEI A,et al.Ameliorative effects of mulberry (MorusalbaL.) leaves on hyperlipidemia in rats fed a high-fat diet:induction of fatty acid oxidation,inhibition of lipogenesis,and suppression of oxidative stress[J].Bioscience,Biotechnology and Biochemistry,2010,74(12):2385-2395.
[7]TIMMERMAN H M,KONING C J M,MULDER L,et al.Monostrain,multistrain and multispecies probiotics-a comparison of functionality and efficacy[J].International Journal of Food Microbiology,2004,96(3):219-233.
[8]CHUNG Y H,WALKER N D,MCGINN S M,et al.Differing effects of 2 active dried yeast (Saccharomycescerevisiae) strains on ruminal acidosis and methane production in nonlactating dairy cows[J].Journal of Dairy Science,2011,94(5):2431-2439.
[9]陈丹丹,屠焰,马涛,等.桑叶黄酮和白藜芦醇对肉羊气体代谢及甲烷排放的影响[J].动物营养学报,2014,26(5):1221-1228.
[10]AOAC.Official methods of analysis[M].17th ed.Gaithersburg,MD:Association of Official Analytical Chemists,2000.
[11]DENG K D,JIANG C G,TU Y,et al.Energy requirements of Dorper crossbred ewe lambs[J].Journal of Animal Science.2014,92(5):2161-2169.
[12]CAO Y C,YANG H J.Ruminal digestibility and fermentation characteristicsinvitroof fenugreek and alfalfa hay combination with or without the inoculation ofNeocallimastixsp.YAK11[J].Animal Feed Science and Technology,2011,169(1/2):53-60.
[13]VERDOUW H,VAN ECHTELD C J A,DEKKERS E M J.Ammonia determination based on indophenol formation with sodium salicylate[J].Water Research,1978,12(6):399-402.
[14]MAKKAR H P S,SHARMA O P,DAWRA R K,et al.Simple determination of microbial protein in rumen liquor[J].Journal of Dairy Science,1982,65(11):2170-2173.
[15]张昌吉,刘哲,郝正里,等.添加酵母培养物对绵羊全颗粒饲粮中氮消化代谢的影响[J].中国饲料,2007(5):20-23.
[16]孙耀贵,张向杰,程佳,等.2种中药成分对肉鸡生产性能、营养物质消化利用率、肠道消化酶活性和肠道菌群的影响[J].中国畜牧兽医,2013,40(4):93-98.
[17]ENJALBERT F,GARRETT J E,MONCOULON R,et al.Effects of yeast culture (Saccharomycescerevisiae) on ruminal digestion in non-lactating dairy cows[J].Animal Feed Science and Technology,1999,76(3/4):195-206.
[18]LEE S S,HA J K,CHENG K J.Influence of an anaerobic fungal culture administration oninvivoruminal fermentation and nutrient digestion[J].Animal Feed Science and Technology,2000,88(3/4):201-217.
[19]HILL S R,KNOWLTON K F,DANIELS K M,et al.Effects of milk replacer composition on growth,body composition,and nutrient excretion in preweaned Holstein heifers[J].Journal of Dairy Science,2008,91(8):3145-3155.
[20]CHAUCHEYRAS-DURAND F,DURAND H.Probiotics in animal nutrition and health[J].Beneficial Microbes,2010,1(1):3-9.
[21]BODAS R,PRIETO N,GARCA-GONZLEZ R,et al.Manipulation of rumen fermentation and methane production with plant secondary metabolites[J].Animal Feed Science and Technology,2012,176(1/2/3/4):78-93.
[22]SUN P,WANG J Q,DENG L F.Effects ofBacillussubtilisnattoon milk production,rumen fermentation and ruminal microbiome of dairy cows[J].Animal,2013,7(2):216-222.
[23]BAYATKOUHSAR J,TAHMASEBI A M,NASERIAN A A,et al.Effects of supplementation of lactic acid bacteria on growth performance,blood metabolites and fecal coliform and lactobacilli of young dairy calves[J].Animal Feed Science and Technology,2013,186(1/2):1-11.
[24]RUSSELL J B,WILSON D B.Why are ruminal cellulolytic bacteria unable to digest cellulose at low pH?[J].Journal of Dairy Science,1996,79(8):1503-1509.
[25]GHORBANI G R,MORGAVI D P,BEAUCHEMIN K A,et al.Effects of bacterial direct-fed microbials on ruminal fermentation,blood variables,and the microbial populations of feedlot cattle[J].Journal of Animal Science,2002,80(7):1977-1985.
[26]ANDERSON K L,NAGARAJA T G,MORRILL J L.Ruminal metabolic development in calves weaned conventionally or early[J].Journal of Dairy Science,1987,70(5):1000-1005.
[27]CROCKER L M,DEPETERS E J,FADEL J G,et al.Influence of processed corn grain in diets of dairy cows on digestion of nutrients and milk composition[J].Journal of Dairy Science,1998,81(9):2394-2407.
[28]STORM E,ØRSKOV E R.The nutritive value of rumen micro-organisms in ruminants 1.Large-scale isolation and chemical composition of rumen micro-organisms[J].British Journal of Nutriton,1983,50(2):463-470.
[29]庞德公,杨红建,曹斌斌,等.高精料全混合日粮中产朊假丝酵母添加水平对体外瘤胃发酵特性和纤维降解的影响[J].动物营养学报,2014(4):940-946.
[30]杨春涛,司丙文,斯琴巴特尔,等.补饲不同能氮比精料对牧区冬春季羔羊营养物质消化及瘤胃发酵的影响[J].动物营养学报,2014,26(9):2637-2644.
[31]NEWBOLD C J,MCINTOSH F M,WILLIAMS P,et al.Effects of a specific blend of essential oil compounds on rumen fermentation[J].Animal Feed Science and Technology,2004,114(1/2/3/4):105-112.
[32]SPANGHERO M,ZANFI C,FABBRO E,et al.Effects of a blend of essential oils on some end products ofinvitrorumen fermentation[J].Animal Feed Science and Technology,2008,145(1/2/3/4):364-374.
[33]CASTILLEJOS L,CALSAMIGLIA S,FERRET A,et al.Effects of dose and adaptation time of a specific blend of essential oil compounds on rumen fermentation[J].Animal Feed Science and Technology,2007,132(3/4):186-201.
[34]CANANI R B,COSTANZO M D,LEONE L,et al.Potential beneficial effects of butyrate in intestinal and extraintestinal diseases[J].World Journal of Gastroenterology,2011,17(12):1519-1528.
[35]丁洪涛,刘星,夏冬华,等.产朊假丝酵母对奶牛体外瘤胃发酵参数及日粮营养物质消化率的影响[J].中国畜牧杂志,2012,48(9):56-59.
(责任编辑王智航)
Effects ofCandidatropicalisand Mulberry Leaf Flavonoids on Nutrient Metabolism and Rumen Fermentation of Calves
YANG Chuntao1DIAO Qiyu1QU Peibin1SI Bingwen1MA Junnan1ZHOU Yucai2TU Yan1*
(1. Feed Research Institute, Chinese Academy of Agricultural Sciences, Beijing Key Laboratory for Dairy Cow Nutrition, Beijing 100081, China; 2. Beijing Capital Agribusiness Simplot Agricultural Science and Technology Co., Ltd., Beijing 100081, China)
Abstract:This study was aimed to investigate the effects of Candida tropicalis (CT) and mulberry leaf flavonoids (MLF) on energy and nitrogen metabolism, rumen microbial protein synthesis and rumen fermentation of pre- and post-weaning calves. Forty-eight Chinese Holstein bull calves aged (20±2) days were used and assigned to one of the four groups with 12 calves each. The calves in the control group (CON group) were fed a basal diet which including a milk replacer and a starter in pre-weaning period and the starter in post-weaning period. Calves in CT, MLF and CM groups were fed the basal diet with CT, MLF and the compound of CT and MLF, respectively. The calves were weaned (milk replacer) at 56 days of age and the trial lasted 60 days. The rumen fluid was collected at 28, 42, 56 and 80 days of age, digestion trials were conducted to estimate nutrients metabolism at 35 and 63 days of age, respectively. The results showed as follows: comparing with CT group, metabolizable energy of pre-weaning calves in CM group was significantly higher (P<0.05); compared with CON group, the utilization of nitrogen of post-weaning calves in CM group was significantly increased (P<0.05); nitrogen biological value of pre-weaning calves in MLF group was significantly higher than that in CON and CT groups (P<0.05). Compared with CON group, rumen fluid pH (28 to 80 days of age) and microbial protein content (56 and 80 days of age) in CT group were significantly increased (P<0.05), but the concentration of ammonia nitrogen was not impacted by treatments (P>0.05); total volatile fatty acid concentration and butyrate content in MLF group were significantly higher than those in CON group at 56 days of age (P<0.05); there was an increasing tendency for acetate to propionate ratio in CT and MLF groups compared to that in CON group (P=0.090), and the contents of acetate and valerate were not significantly affected (P>0.05). In conclusion, the supplementation of CT can help to increase rumen fluid pH and microbial protein synthesis for pre-weaning calves; the supplementation of CT and MLF can increase metabolizable energy of diet and nitrogen biological value for pre-weaning calves, decrease fecal energy and total excrete nitrogen, improve metabolizability of gross energy and utilization of nitrogen of post-weaning calves. Furthermore, it also can improve rumen fermentation. Compared with the effects of single using, the combining of CT and MLF is preferable.[Chinese Journal of Animal Nutrition, 2016, 28(1):224-234]
Key words:calf; Candida tropicalis; mulberry leaf flavonoids; microbial protein; nutrient metabolism; rumen fermentation
*Corresponding author, professor, E-mail: tuyan@caas.cn
中图分类号:S816.7;S823
文献标识码:A
文章编号:1006-267X(2016)01-0224-11
作者简介:杨春涛(1987—),男,河北邢台人,硕士,研究方向为反刍动物营养。E-mail: yangchuntao0808@163.com*通信作者:屠焰,研究员,硕士生导师,E-mail: tuyan@caas.cn
基金项目:奶牛产业技术体系北京市创新团队;国家科技支撑计划课题“华北农区及北方大城市奶牛健康养殖生产技术集成及产业化示范”(2012BAD12B06)
收稿日期:2015-07-14
doi:10.3969/j.issn.1006-267x.2016.01.029
