重组大肠杆菌转化富马酸生产L-丙氨酸
2016-04-26徐友强马玉岳姜增妍裴疆森
徐友强,马玉岳,姚 粟,姜增妍,张 奇,张 露,裴疆森,程 池
(1. 中国食品发酵工业研究院,北京100015;
2. 山东省富马酸生物转化工程技术研究中心,山东烟台265709)
重组大肠杆菌转化富马酸生产L-丙氨酸
徐友强1,马玉岳2,姚粟1,姜增妍2,张奇1,张露1,裴疆森1,程池1
(1. 中国食品发酵工业研究院,北京100015;
2. 山东省富马酸生物转化工程技术研究中心,山东烟台265709)
摘要:通过克隆来源于睾丸酮丛毛单胞菌的L-天冬氨酸-β-脱羧酶基因,在一株具有L-天冬氨酸酶生产能力的大肠埃希氏菌CICC 11022S中异源表达,构建转化富马酸生产L-丙氨酸的重组工程菌。结果发现:重组工程菌9 h转化富马酸产生112.7 g/L的L-丙氨酸,生产速率12.5 g/(L·h),转化率93.8%。富马酸价格较低,有效降低L-丙氨酸生产的原料成本。通过构建重组工程菌,以富马酸为底物,高效生产L-丙氨酸,结果表明该方法具有较好的工业应用潜力。
关键词:L-丙氨酸;L-天冬氨酸酶;L-天冬氨酸-β-脱羧酶;重组工程菌
L-丙氨酸是一种具有重要价值的氨基酸,在医药和食品行业应用广泛。L-丙氨酸甜味柔和,能与谷氨酸钠制成混合调味品,可调制并明显改善食品风味,而不破坏食物原有的风格[1];是合成甜味剂阿力甜的主要原料,阿力甜的甜度是蔗糖的2 000倍,目前已在多个国家和地区获准使用[2-3];是合成维生素B6和L-氨基丙醇(盐酸左氧氟沙星合成前体)的重要中间体,也是营养剂补糖氨基酸营养输液的组成成分之一[4-6]。最近,有研究利用L-丙氨酸合成N-(9-fluorenylmethyloxycarbonyl)-L-alanine,用于检测牛奶中的抗生素氧氟沙星(ofloxacin),极大提高了检测的灵敏度[7];还有研究将L-丙氨酸与电子自旋共振(electron spin resonance,ESR)联合用于癌症放疗剂量的评估,效果显著[8]。
L-丙氨酸生产技术包括化学合成法、蛋白水解提取法和微生物转化法。其中,微生物转化法是现在应用最广泛的L-丙氨酸生产方法。徐虹等[9]选育具有高L-天冬氨酸-β-脱羧酶活力的假单胞菌,以L-天冬氨酸为底物,采用游离细胞法生产L-丙氨酸,每升培养液可转化L-天冬氨酸2.0 kg。现有L-丙氨酸生产工艺以L-天冬氨酸作为原料,L-天冬氨酸价格较高,而且转化过程脱去羧基,造成了碳流失,从而显著增加了生产成本。L-天冬氨酸微生物转化生产是利用微生物产生的L-天冬氨酸酶,转化底物富马酸和氨水实现的,其转化生产过程如图1所示。
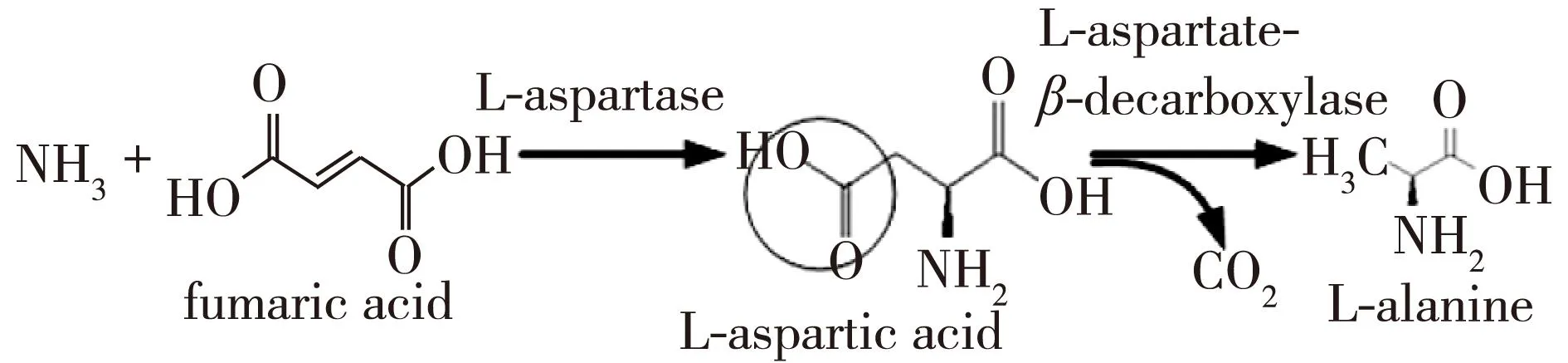
图1 L-天冬氨酸和L-丙氨酸的微生物转化生产过程Fig.1 Process of L-aspartic acid and L-alanine transformation by microorganisms
富马酸价格仅为L-天冬氨酸的40%左右,可以有效降低原料成本。前期有研究对产L-天冬氨酸酶的菌株和L-天冬氨酸-β-脱羧酶的菌株进行固定,利用固定化细胞以富马酸和氨水为底物,26 h可以催化生产1.05 mol/L的L-丙氨酸[10];还有研究利用纯化的L-天冬氨酸酶和L-天冬氨酸-β-脱羧酶催化富马酸生产L-丙氨酸,但是酶的用量较大,同时生产的效率较低,难于工业化[11]。克隆来源于睾丸酮丛毛单胞菌的L-天冬氨酸-β-脱羧酶基因,在携带L-天冬氨酸酶基因的大肠杆菌中异源表达,构建重组大肠杆菌工程菌,利用双酶耦合催化,以期实现以重组工程菌高效转化富马酸生产L-丙氨酸的工艺技术。
1材料与方法
1.1材料
1.1.1菌株和质粒
菌株EscherichiacoliDH5α购自北京全式金生物技术有限公司,E.coliCICC 11022S为中国工业微生物菌种保藏管理中心保藏菌株。组成型质粒pETPtac和pETPT7在前期工作中构建[12],pETDuet-1购自Novagen公司。
1.1.2酶和试剂
限制性内切酶,Thermo Scientific公司。高保真DNA聚合酶Fast Pfu,北京全式金生物技术有限公司。T4 DNA连接酶,NEB公司。质粒提取试剂盒、DNA纯化试剂盒和DNA回收试剂盒,天根生化科技(北京)有限公司。氨苄青霉素和硫酸卡那霉素,Sigma公司。其他化学试剂均为国产分析纯。
1.2方法
1.2.1L-天冬氨酸-β-脱羧酶基因asd的克隆
根据PseudomonasdacunhaeATCC 21192的L-天冬氨酸-β-脱羧酶基因序列(GenBank:AB091385.1)设计引物对asd.f(NdeI)/asd.r(XhoI)(表1),正反向引物分别含有核酸内切酶NdeI和XhoI,扩增asd基因。
PCR反应体系:模板DNA(Comamonastestosteroni基因组)(100 ng/μL)0.5 μL,上下游引物(20 μmol/L)各1 μL,dNTPs(10 mmol/L)4 μL,5× Fast Pfu Buffer 10 μL,Fast Pfu DNA聚合酶(2.5 U/μL)1 μL,ddH2O 33.5 μL。总体积50 μL。
PCR反应条件:94 ℃预变性5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 5 min。
1.2.2组成型重组质粒的构建
提取载体pETPtac、pETPT7和pETDuet-1,核酸内切酶NdeI和XhoI分别处理载体和PCR扩增的asd基因,切胶回收,T4 DNA连接酶连接载体和基因片段,构建载体pETPtac-asd、pETPT7-asd和pETDuet-asd。
以pETPtac-asd为模板,设计引物对Ptac.f(MluI)/asd.r(EcoR I)(表1)扩增DNA片段Ptac-asd(PCR体系和条件同asd基因的克隆),核酸内切酶MluI和EcoR I处理PCR扩增的Ptac-asd,插入载体pETDuet-asd的MluI和EcoR I,替换载体的lacI调控基因和T7启动子,构建载体pETPtac-asd-PT7-asd,可以不经诱导,起始下游基因的表达。
1.2.3培养基
LB液体培养基(g/L):酵母粉5,蛋白胨10,NaCl 10。115 ℃灭菌30 min。
LB固体培养基在液体培养基基础上添加20 g/L琼脂粉。
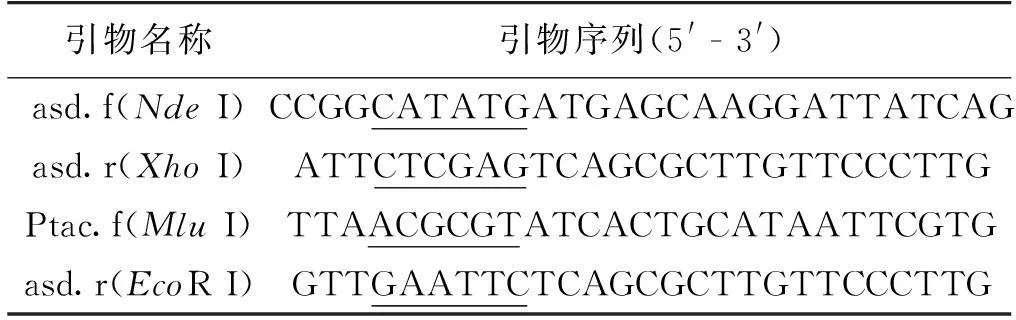
表1 引物序列
注:f表示正向引物,r表示反向引物;下划线处为核酸内切酶位点。
发酵液体培养基(g/L):富马酸10,玉米浆干粉10,MgSO40.2,KH2PO41.0,NaCl 1.5。氨水调节pH 6.5~7.5,115 ℃灭菌30 min。
发酵固体培养基在液态培养基基础上添加20 g/L琼脂粉。
1.2.4培养方法
将基因工程菌株划线到含有100 mg/L氨苄青霉素或者50 mg/L硫酸卡那霉素的LB培养基平板上,(37±1) ℃培养(12±2) h。
无菌条件下,挑取平板上的单菌落,接种到含有100 mg/L氨苄青霉素或者50 mg/L硫酸卡那霉素的发酵培养基中,(37±1) ℃摇床培养(12±2) h,获得基因工程菌株的菌液。
将菌液以体积分数1.0%接种量接种到含有100 mg/L氨苄青霉素或者50 mg/L硫酸卡那霉素的发酵培养基中,(37±1) ℃摇床200 r/min培养(12±2)h,获得基因工程菌株的发酵液。
E.coliCICC 11022S作为对照,以不加抗生素的培养基进行培养。
1.2.5转化方法
不同菌株转化富马酸生产L-丙氨酸:紫外可见分光光度计600 nm测定发酵液的吸光度,以无菌生理盐水统一调节E.coliCICC 11022S、E.coli/pETPtac-asd、E.coli/pETPT7-asd和E.coli/pETPtac-asd-PT7-asd的OD600为7.0。将富马酸以氨水调节pH为8.0,配制富马酸铵饱和溶液。然后将菌液与富马酸铵溶液以体积比1∶ 1进行混合,调节温度(45±1) ℃,转速200 r/min,进行转化,0和12 h分别取样,高效液相色谱(high performance liquid chromatography,HPLC)标准曲线法测定富马酸、L-天冬氨酸和L-丙氨酸的浓度。以L-丙氨酸的浓度高低确定最优的重组菌株。
不同温度培养菌体催化生产L-丙氨酸:将活化的菌株以1%接种量接种发酵培养基,(37±1)℃摇床200 r/min培养(12±2) h,然后将菌液与富马酸铵溶液以体积比1∶ 1进行混合,调节温度(45±1) ℃,转速200 r/min进行转化,0和12 h分别取样,HPLC标准曲线法测定富马酸、L-天冬氨酸和L-丙氨酸的浓度。以L-丙氨酸的浓度高低确定最优培养温度。
全细胞高密度催化生产L-丙氨酸:离心收集菌体,无菌生理盐水悬浮,制备浓度100 OD的菌悬液,然后以菌悬液与富马酸铵溶液以体积比1∶ 6混合,调节温度(45±1) ℃,转速200 r/min,0、3、6、9和12 h分别取样,HPLC标准曲线法测定富马酸、L-天冬氨酸和L-丙氨酸的浓度。
以上催化实验均通过500 mL三角瓶进行,装液量50 mL。
1.2.6分析方法
1)富马酸HPLC测定条件。
样品处理:样品稀释合适倍数,0.22 μm滤膜过滤后HPLC检测。
样品检测:色谱柱为Prevail organic acid(5 μm,250 mm × 4.6 mm),紫外检测器检测波长210 nm,柱温30 ℃,流速0.6 mL/min,进样量10 μL,流动相为0.01 mol/L KH2PO4溶液(H3PO4调节pH为2.3)与甲醇(体积比为95∶ 5)。
2)L-天冬氨酸和L-丙氨酸样品通过异硫氰酸苯酯(PITC)衍生定量检测。
样品衍生:样品400 μL + 0.5 g/L正亮氨酸溶液20 μL + 0.1 mol/L PITC-乙腈溶液200 μL + 1 mol/L三乙胺-乙腈溶液200 μL,涡旋振荡混匀后室温放置60 min,然后加入800 μL正己烷,涡旋振荡1 min,静置10 min。用注射器吸取下层溶液,0.22 μm滤膜过滤后HPLC检测。
样品检测:色谱柱为ZORBAX SB-C18(5 μm,4.6 mm × 150 mm),紫外检测器设定波长为254 nm,柱温38 ℃,流速设定为0.6 mL/min,进样量10 μL,流动相A为0.1 mol/L pH 6.5的乙酸铵-乙腈(体积比97∶3)溶液,流动相B为乙腈溶液。洗脱程序为0~ 8 min流动相B的比例18%,8~16 min流动相B的比例由18%梯度升高到80%。
2结果与讨论
2.1L-天冬氨酸-β-脱羧酶基因asd的克隆和表达载体构建
以C.testosteroni基因组DNA为模板,经PCR扩增后,电泳分析,得到1条约1.6 kb的条带,结果如图2(a)所示,其大小与L-天冬氨酸-β-脱羧酶基因(asd)的理论大小一致。将其插入载体pETPtac、pETPT7和pETDuet-1,构建表达载体pETPtac-asd、pETPT7-asd和pETDuet-asd,然后以pETPtac-asd为模板,构建asd基因双拷贝的组成型表达载体pETPtac-asd-PT7-asd。将载体pETPtac-asd、pETPT7-asd和pETPtac-asd-PT7-asd转化大肠杆菌E.coliCICC 11022S,构建基因工程菌株E.coli/pETPtac-asd、E.coli/pETPT7-asd和E.coli/pETPtac-asd-PT7-asd,其单酶切验证如图2(b)、2(c)、2(d)所示。

(a):M1—DL2000Marker,1—asd基因;(b):M2—DNA Marker,1—Xho I酶切处理pETPtac,2—pETPtac-asd;(c):M2—DNA Marker,1—Xho I酶切处理pETPT7,2—pETPT7-asd;(d):M2—DNA Marker,1—Xho I酶切处理pETDuet-1,2—pETPtac-asd-PT7-asd图2 asd基因PCR扩增,质粒pETPtac-asd、pETPT7-asd和pETPtac-asd-PT7-asd单酶切验证Fig.2 PCR amplification of asd,restrication enzyme verification of pETPtac-asd,pETPT7-asd and pETPtac-asd-PT7-asd
2.2菌株E.coliCICC 11022S,E.coli/pETPtac-asd,E.coli/pETPT7-asd和E.coli/pETPtac-asd-PT7-asd生产L-丙氨酸比较
为了使工程菌株在实际工业应用中操作更加简单,构建的基因工程菌株均为不经诱导操作、起始下游基因表达的组成型表达基因工程菌株。不同菌株转化富马酸生产L-天冬氨酸和L-丙氨酸结果如表2所示。

表2 不同菌株转化富马酸生产L-天冬氨酸和L-丙氨酸
注:a—细胞密度OD600为产酶发酵后的OD值;b—富马酸质量浓度为反应体系初始浓度与反应完毕残留浓度的差值。
Takamatsu等[10]研究结果和表2结果均表明,组成型表达的重组菌株可以不经诱导操作,有效地进行异源基因表达。重组菌株E.coli/pETPtac-asd,E.coli/pETPT7-asd和E.coli/pETPtac-asd-PT7-asd均可以转化富马酸生产L-丙氨酸。其中,以E.coli/pETPtac-asd-PT7-asd生产L-丙氨酸的能力最佳,12 h共产生54.76 g/L的L-丙氨酸,生产速率4.56 g/(L·h),同时还生产了16.01 g/L的L-天冬氨酸。与之相比,出发菌株不能产生L-丙氨酸,12 h共生产了L-天冬氨酸100.95 g/L。以上结果表明,成功构建得到L-天冬氨酸酶和L-天冬氨酸-β-脱羧酶双酶共表达的重组菌株,实现了以富马酸为底物、生产L-丙氨酸的工艺技术。该结果还表明,通过增加L-天冬氨酸-β-脱羧酶基因的拷贝数,可以提高L-丙氨酸的生产速率。后续可以开展L-天冬氨酸酶和L-天冬氨酸-β-脱羧酶基因表达的系统优化,在不影响细胞生长代谢的条件下,进一步提高工程菌的生产效率。
2.3重组菌株E.coli/pETPtac-asd-PT7-asd不同温度培养对L-丙氨酸转化的比较
温度对重组菌株的基因异源表达影响较大[13],故对重组菌株E.coli/pETPtac-asd-PT7-asd在不同温度下进行培养,然后同一条件进行转化,考察培养温度对重组菌株转化生产L-丙氨酸的影响,结果如图3所示。
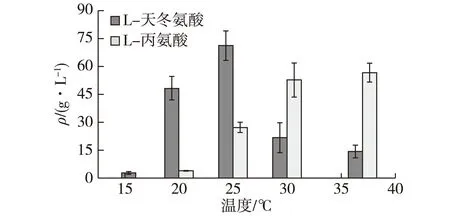
图3 温度对E. coli/pETPtac-asd-PT7-asd 生产L-丙氨酸的影响Fig.3 Effects of different culture temperature on L-alanine production by E. coli/pETPtac-asd-PT7-asd
由图3可知:37 ℃培养E.coli/pETPtac-asd-PT7-asd,与其他培养温度相比,所得等体积发酵液具有最高效的L-丙氨酸转化能力。12 h共产生L-丙氨酸56.66 g/L,略优于30 ℃发酵液(52.77 g/L)。由于大肠杆菌的最适培养温度为37 ℃,温度上升,其菌体生长能力下降明显,故没有进行40 ℃以上培养E.coli/pETPtac-asd-PT7-asd的实验。
2.4重组菌株E.coli/pETPtac-asd-PT7-asd全细胞高密度转化富马酸生产L-丙氨酸
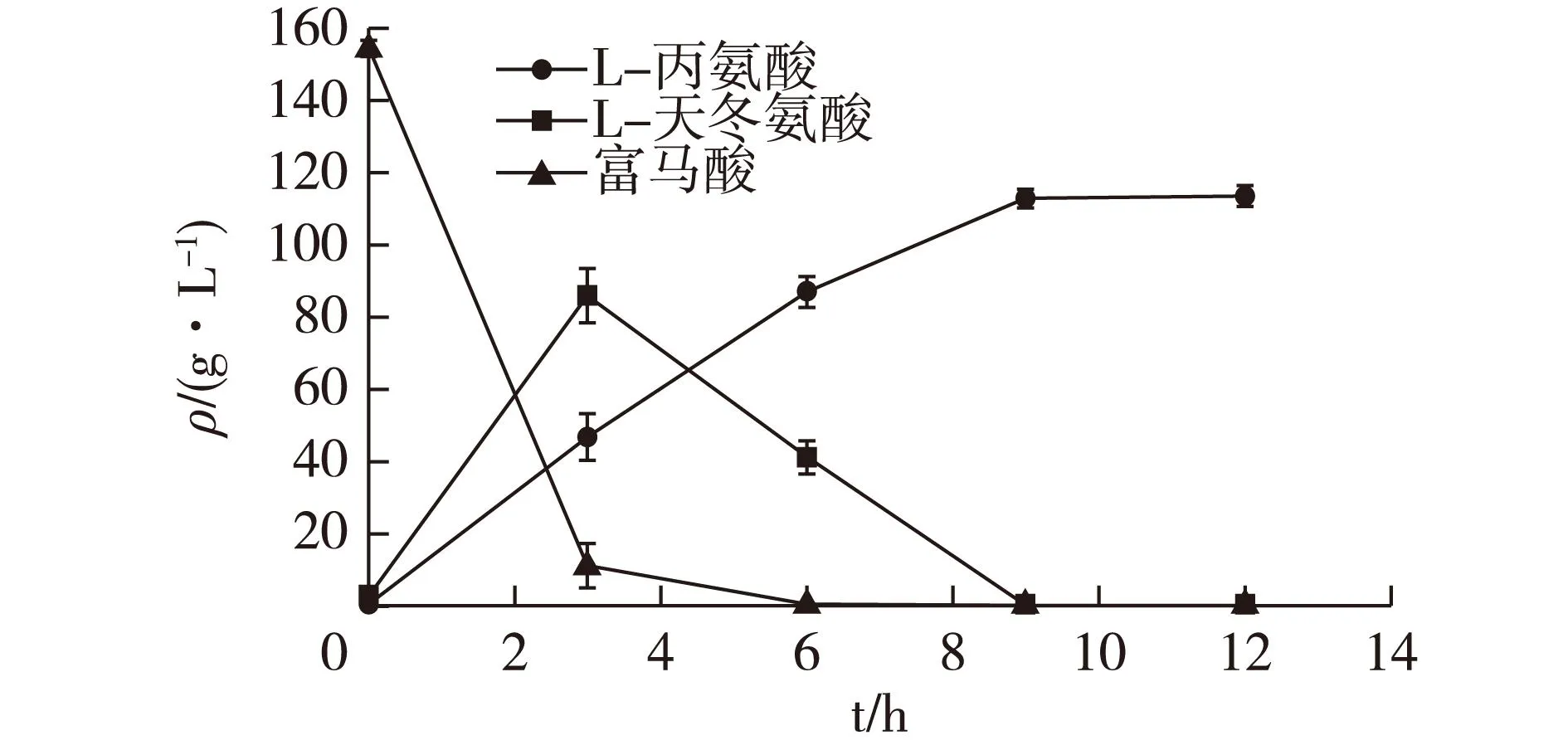
图4 E. coli/pETPtac-asd-PT7-asd全细胞 高密度生产L-丙氨酸Fig.4 Production of L-alanine by high cell density of E. coli/pETPtac-asd-PT7-asd
为进一步提高L-丙氨酸生产效率,尝试了高密度转化方式,结果如图4所示。由图4可知:E.coli/pETPtac-asd-PT7-asd 9 h可以转化154.3 g/L富马酸产生112.7 g/L L-丙氨酸,生产速率12.5 g/(L·h),转化率93.8%。
3结论
首次尝试通过重组菌株双酶耦合表达,实现了以富马酸为底物、转化生产L-丙氨酸的工艺技术,降低了生产的原料成本。全细胞高密度催化结果表明,重组菌株9 h可以转化154.3 g/L富马酸产生112.7 g/L L-丙氨酸,生产速率12.5 g/(L·h),转化率93.8%,表明该重组菌株具有一定的工业应用价值。
参考文献:
[1]张维刚,丁学杰.相转移催化合成DL-丙氨酸的研究[J].精细化工,1999,16(5):38-40.
[2]凌关庭.阿力甜及其FAO/WHO(1995)标准[J].中国食品添加剂,1996(2):21-24.
[3]杨海燕,张日生.阿力甜:性质优良的甜味剂[J].中国食品添加剂,2000(3):23-25.
[4]陈天豪,李仁宝,杨威.维生素B6的合成工艺改进[J].中国医药工业杂志,2004,35(1):1-2.
[5]苗华,孙兰英,郭惠元.(S)-2(+)-2-氨基丙醇的制备[J].中国医药工业杂志,1998,29(10):470.
[6]董学伟,张春枝,金凤燮.中空纤维膜反应器转化L-天冬氨酸生成L-丙氨酸[J].食品与发酵工业,2003,29(1):32-35.
[7]ZHAO T,YU B F,TANG W J,et al.Spectrofluorimetric determination of ofloxacin in milk withN-(9-f ̄l ̄u ̄o ̄r ̄e ̄n ̄y ̄l ̄m ̄e ̄t ̄h ̄y ̄l ̄o ̄x ̄y ̄c ̄a ̄r ̄b ̄o ̄n ̄y ̄l)-l-alanine[J].Spectrochim Acta A Mol Biomol Spectrosc,2015,148:125-130.
[8]RECH A B,BARIBI G L,VENTURA L H,et al.In vivo dose evaluation during gynaecological radiotherapy using l-alanine/ESR dosimetry[J].Radiat Prot Dosimetry,2014,159(1-4):194-198.
[9]徐虹,王雪根,朱建良,等.L-丙氨酸酶法工业生产的研究[J].工业微生物,1997,27(2):17-20.
[10]TAKAMATSU S,UMEMURA I,YAMAMOTO K,et al.Production of l-alanine from ammonium fumarate using two immobilized microorganisms[J].Eur J Appl Microbiol Biotechnol,1982,15:147-152.
[11]JANDEL A S,HUSTEDT H,WANDREY C.Continuous production of l-alanine from fumarate in a two-stage membrane reactor[J].Eur J Appl Microbiol Biotechnol,1982,15:59-63.
[12]XU Y,CHU H P,GAO C,et al.Systematic metabolic engineering ofEscherichiacolifor high-yield production of fuel bio-chemical 2,3-butanediol[J].Metab Eng,2014,23:22-33.
[13]GöRANSSON M,SONDéN B,NILSSON P,et al.Transcriptional silencing and thermoregulation of gene expression inEscherichiacoli[J].Nature,1990,344:682-685.
(责任编辑管珺)
Transformation of fumaric acid for the production of L-alanine by recombinantEscherichiacoli
XU Youqiang1,MA Yuyue2,YAO Su1,JIANG Zengyan2,ZHANG Qi1,ZHANG Lu1,PEI Jiangsen1,CHENG Chi1
(1. China National Research Institute of Food and Fermentation Industries,Beijing 100015,China;2. Engineering Technology Research Center of Fumaric Acid Biotransformation in Shandong Province,Yantai 265709,China)
Abstract:The gene coding for L-aspartate-β-decarboxylase from Comamonas testosteroni was cloned and expressed in an Escherichia coli strain CICC 11022S with the capability for L-aspartic acid production. The recombinant strain was used for the synthesis of L-alanine. The recombinant strain produced 112.7 g/L L-alanine from fumaric acid with a rate of 12.5 g/(L·h)and a conversion ratio of 93.8%. Fumaric acid has a low price,which efficiently reduces the substrate cost for L-alanine production. L-alanine was producd from fumaric acid by using the recombinant strain,and the results showed that the technology had industrial application potential.
Keywords:L-alanine;L-aspartase;L-aspartate-β-decarboxylase;recombinant strain
中图分类号:Q78
文献标志码:A
文章编号:1672-3678(2016)02-0007-05
作者简介:徐友强(1986—),男,山东青州人,博士,工程师,研究方向:发酵工程;程池(联系人),教授级高级工程师,E-mail:cheng100027@163.com
基金项目:烟台市科技发展计划(2014SF151);中国食品发酵工业研究院2015年科技发展基金(博士专项)(2015KJFZ-BS-03)
收稿日期:2015-07-21
doi:10.3969/j.issn.1672-3678.2016.02.002
