不同剂量的雌激素对大鼠子宫内膜机械损伤后修复的影响
2016-04-26程龙凤王蔼明付鑫赵勇徐祥波贺斌
程龙凤,王蔼明*,付鑫,赵勇,徐祥波,贺斌*
(1. 安徽医科大学海军临床学院,合肥 230032;2. 中国人民解放军海军总医院,北京 100048;3. 内蒙古民族大学临床医学院,通辽 028000;4. 国家卫生计生委科学技术研究所,北京 100081)
不同剂量的雌激素对大鼠子宫内膜机械损伤后修复的影响
程龙凤1,2,王蔼明1,2*,付鑫2,3,赵勇2,徐祥波4,贺斌4*
(1. 安徽医科大学海军临床学院,合肥230032;2. 中国人民解放军海军总医院,北京100048;3. 内蒙古民族大学临床医学院,通辽028000;4. 国家卫生计生委科学技术研究所,北京100081)
【摘要】目的本研究旨在探讨不同剂量的雌激素对大鼠子宫内膜机械损伤后修复的影响。方法选择动情期Wistar雌鼠50只,随机分为正常对照组、损伤组、损伤+10 μg雌激素组、损伤+100 μg雌激素组。除正常对照组外,对各组大鼠左侧宫腔进行机械搔刮,搔刮后立即皮下注射17 β-雌二醇,剂量分别为0 μg/100 μl、10 μg/100 μl、100 μg/100 μl,连续7 d。损伤后21 d合笼交配,见栓后5.5 d通过HE染色观察各组子宫内膜形态改变,免疫组织化学观察各组间容受相关分子整合素αvβ3、白血病抑制因子(LIF)的表达情况,观察见栓后7 d各组间两侧子宫着床点个数。结果(1)孕5.5 d,HE染色可见损伤组和损伤+100 μg雌激素组腺体数目明显减少,实质细胞减少,纤维化面积较大;正常对照组和损伤+10 μg雌激素组腺体丰富,实质细胞多。(2)免疫组织化学染色可见:损伤各组与正常对照组比较,内膜αvβ3、LIF表达量显著下降(P<0.05);损伤+10 μg组与损伤组、损伤+100 μg组比较,αvβ3、LIF表达量显著增多(P<0.05);损伤组与损伤+100 μg组比较,αvβ3表达量无显著性差异(P>0.05),LIF表达量显著减少(P<0.05)。(3)孕7 d,与正常对照组及各组自身对照侧比较,损伤各组损伤侧着床点个数显著减少(P<0.01);损伤各组间比较,损伤+10 μg组着床个数较损伤组、损伤+100 μg组稍增多,但无显著性差异(P>0.05);损伤+100 μg组与损伤组比较,着床个数相当,无显著性差异(P>0.05)。结论机械损伤后,子宫内膜在自然修复情况下不仅存在形态结构差异,且容受功能出现明显下降;外源性雌激素干预可在一定程度上促进子宫内膜修复,改善子宫内膜容受功能,其中10 μg剂量(相当于大鼠生理剂量)效果最佳,大剂量的雌激素可能导致子宫内膜容受性的下降。
【关键词】机械损伤;子宫内膜容受性;雌二醇;大鼠
(JReprodMed2016,25(4):353-359)
正常月经周期中,内膜功能层的修复依赖基底层细胞以及腺上皮细胞的再生,但是在病理情况下,内膜基底层损伤,功能层再生不足,活性内膜丧失,影响生殖预后。导致子宫内膜损伤的主要因素是不恰当的宫腔内操作[1],损伤后的内膜易形成粘连或纤维化。宫腔镜下粘连分解术是现今临床主要的治疗手段[2],然而粘连在术后容易复发,成为制约生殖预后的瓶颈。雌激素序贯疗法是临床上较为普遍采用的术后辅助治疗手段之一[3],但其用法用量尚无统一标准。且关于雌激素能否改善损伤后的内膜容受功能,目前相关研究较少,其作用仍存在争议。本实验在建立大鼠宫腔内机械损伤模型的基础上,通过受孕观察损伤后大鼠子宫内膜容受性的改变,并使用不同剂量的外源性雌激素干预,探讨雌激素对损伤后子宫内膜容受功能的影响,为临床上子宫内膜损伤患者的个体化辅助治疗提供前期动物实验基础。
材料与方法
一、实验动物及试剂
1. 实验动物:9~10周龄的Wistar大鼠(购自北京维通利华实验动物技术有限公司),体重约220~250 g,饲养于国家卫生计生委科学技术研究所SPF级实验动物屏障系统。环境温度20~22℃,相对湿度70%~85%,每日光照及黑暗刺激各12 h,自由摄食、水。雌雄分笼饲养。
2. 主要试剂:免疫组化一抗兔抗大鼠αvβ3、白血病抑制因子(LIF)均购自北京博奥森生物有限公司,批号分别为bs-0086R、bs-1058R;二抗(兔二步法检测试剂盒)购自北京中杉金桥生物技术有限公司(批号:PV6001);二氨基联苯胺(DAB)显色试剂盒购自北京中杉金桥生物技术有限公司(批号:ZLI9032);山羊血清购自北京中杉金桥生物技术有限公司(批号:ZLI9021)。
3. 17β-雌二醇试剂的配制:称取一定量的17β-雌二醇粉剂(Alfa Aesar,英国),使用定量的无水乙醇将17β-雌二醇充分溶解后,加入定量的无菌花生油配制成1 mg/ml的母液,置于涡旋机上混匀15 min。在无菌超净工作台上抽吸一定量的母液,添加无菌花生油,配制成浓度为10 μg/100 μl及100 μg/100 μl的雌二醇备用。
二、实验方法
1. 分组:通过阴道细胞涂片选择动情期雌鼠50只,随机分为:A组(正常对照组,n=11只),无任何干预;B组(损伤组,n=13只):建立大鼠单侧宫腔机械损伤模型;C组(损伤+10 μg雌激素组,n=13只),损伤后立即皮下注射17β-雌二醇10 μg/100 μl,以后每日晨9时皮下注射雌二醇油溶液,连续7 d;D组(损伤+100 μg雌激素组,n=13只),损伤后立即皮下注射17β-雌二醇100 μg/100 μl,以后每日晨9时皮下注射雌二醇油溶液,连续7 d。
2. 大鼠子宫内膜损伤模型的建立:根据本研究组前期实验研究方法,使用2.5%戊巴比妥钠(sigma,美国)腹腔注射对大鼠进行麻醉,具体剂量按200 μl/100 μg给予。麻醉后的大鼠,经左侧背部切口,逐层分离组织,进入腹腔后在背部脂肪团周围找到子宫,并提拉出腹腔,注意保护卵巢及周围血管;于子宫远端(近卵巢侧)剪一直径约0.2 cm小口,根据大鼠子宫粗细大小,选择相应型号的自制刮勺进行搔刮,搔刮长度自切口起约为1~1.5 cm,力度以不穿透子宫为宜,直至刮出大量内膜且自觉宫腔粗糙;以4号丝线缝合子宫切口,关腹,缝合皮肤,碘伏棉球消毒伤口。右侧子宫剪开后,不予搔刮,立即缝合子宫,其后操作同左侧。手术当日记为第1天。损伤侧建模过程由同一位宫腔内操作术者进行,以保证模型一致性。
3. 取材及处理:各组大鼠于手术日后第21天与雄鼠1∶1合笼交配。每日清晨检查阴道栓,见栓者记为孕第0.5天,至孕5.5 d时断颈处死大鼠,每组5只。处死后立即剖腹取子宫组织,剔除脂肪及结缔组织后,剪取手术损伤段及对侧未损伤段组织置于4%多聚甲醛中固定24 h以上,常规石蜡包埋,切片。各组剩余大鼠于孕7 d断颈处死后打开腹腔,记录着床胚胎数并拍照。
4. 组织染色及图像分析:(1)HE染色:子宫横切片脱蜡、水化,苏木精染色液中3 min,1%盐酸酒精分化片刻,冲水1 min;1%氨水中返蓝,伊红染色液染色5 min,冲水,脱水,二甲苯透明,中性树脂封片。显微镜下观察并拍照。(2)免疫组织化学染色:子宫横切片脱蜡、水化、采用枸橼酸盐缓冲液煮沸方式进行抗原修复。室温下将组织切片置于3%H2O2中20 min,PBS洗涤,切片加5%山羊血清置37℃孵育20 min,随后滴加一抗αvβ3(1∶1 600)或LIF(1∶3 200),4℃过夜。随后,滴加二抗于37℃孵育30 min,DAB显色和苏木素复染后,脱水透明,中性树胶封片。随机选取4个视野,以深棕色为阳性信号,电子显微镜(Leica,德国)下拍照。采用医学彩色图像分析系统(Image-Pro Plus 6.0)分别测量αvβ3、LIF阳性染色区域面积,并利用软件计算其与子宫内膜面积比。
三、统计学处理
结果
一、孕5.5 d子宫内膜组织HE染色结果
各组大鼠孕5.5 d子宫横切面HE染色后可见:正常对照组:内膜腺体开口丰富,实质细胞多;损伤组:内膜中腺体数量少,基质纤维化面积大,实质细胞减少;损伤+10 μg雌激素组:腺体开口较丰富,腺上皮细胞排列较整齐,基质纤维化程度较轻,实质细胞较多;损伤+100 μg雌激素组:宫腔面积尚存,腺体数量较损伤组稍多,纤维化面积仍较大(图1)。
二、孕5.5 d子宫内膜组织免疫组仅化学染色结果
1. 整合素αvβ3的表达:正常对照组:αvβ3于内膜腺上皮胞质及胞浆中表达,围绕宫腔分布,且延伸至内膜内1/2;损伤组:表达量显著较少,分布稀疏,仅表达在内膜浅层;损伤+10 μg雌激素组:αvβ3于内膜浅至中层(未及内膜1/2)及腺体周围表达;损伤+100 μg雌激素组:表达量较少,且分布于内膜浅层。

1A、1B为正常对照组;1C、1D为损伤组;1E、1F为损伤+10 μg E2组;1G、1H为损伤+100 μg E2组图1 各组大鼠孕5.5 d子宫横切面 HE染色 ×400

2A、2B为正常对照组;2C、2D为损伤组;2E、2F为损伤+10 μg E2组;2G、2H为损伤+100 μg E2组图2 整合素αvβ3和LIF在孕5.5 d子宫内膜的定位表达 免疫组织化学染色 ×400
2. LIF的表达:正常对照组:LIF表达于子宫内腔上皮细胞、腺上皮细胞、基质细胞的胞浆和胞核中,分布均匀,排列致密;损伤组:表达量显著减少,基质中分布稀疏;损伤+10 μg雌激素组:LIF表达于内膜浅至中层,分布较均匀;损伤+100 μg雌激素组:LIF仅表达于腺上皮浅层,基质中呈少量散在分布(图2、3,表1)。

图3 各组子宫内膜整合素αvβ3、LIF的表达面积

组 别例数整合素αvβ3LIF正常对照组517.5±5.3*22.4±4.7*损伤组58.2±1.39.7±1.6损伤+10μg雌激素组512.1±2.1#13.6±2.4#损伤+100μg雌激素组56.7±1.66.7±1.1**
注:与其它各组比较,*P<0.05;与损伤组、损伤+100 μg组比较,#P<0.05;与损伤组比较,**P<0.05
三、孕7 d胚胎着床点情况
大鼠正常胚胎于孕7 d前后完成着床过程,肉眼观察可见宫腔内突起的光滑小结节(图4)。正常对照组左右两侧着床数相当,分布均匀,大小均一。各组大鼠未损伤侧(右侧)着床个数比较,无显著性差异(P>0.05);损伤各组损伤侧着床点个数较正常对照组显著减少(P<0.01)。损伤各组间比较,损伤+10 μg组着床个数较损伤组、损伤+100 μg组稍增多,但无显著性差异(P>0.05);损伤+100 μg组较损伤组比较,着床点个数略增加,但亦无显著性差异(P>0.05),可能与实验例数较少有关(表2)。
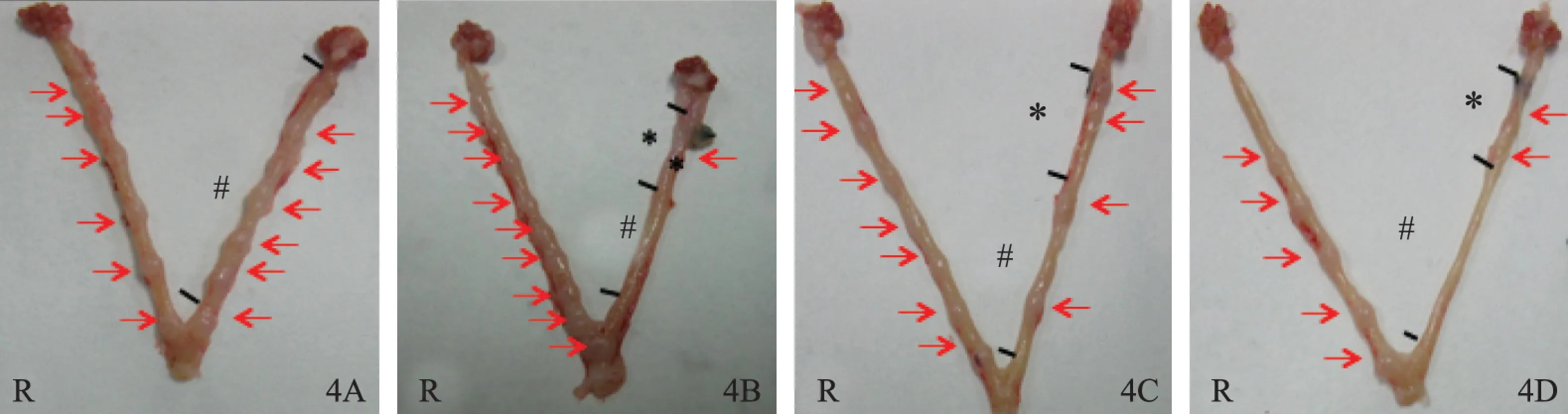
*损伤区域;#非损伤区域;R为右侧图4 肉眼观察各组大鼠孕7 d双侧子宫胚胎着床情况4A:正常对照组4B:损伤组 4C:损伤+10 μg组 4D:损伤+100 μg组
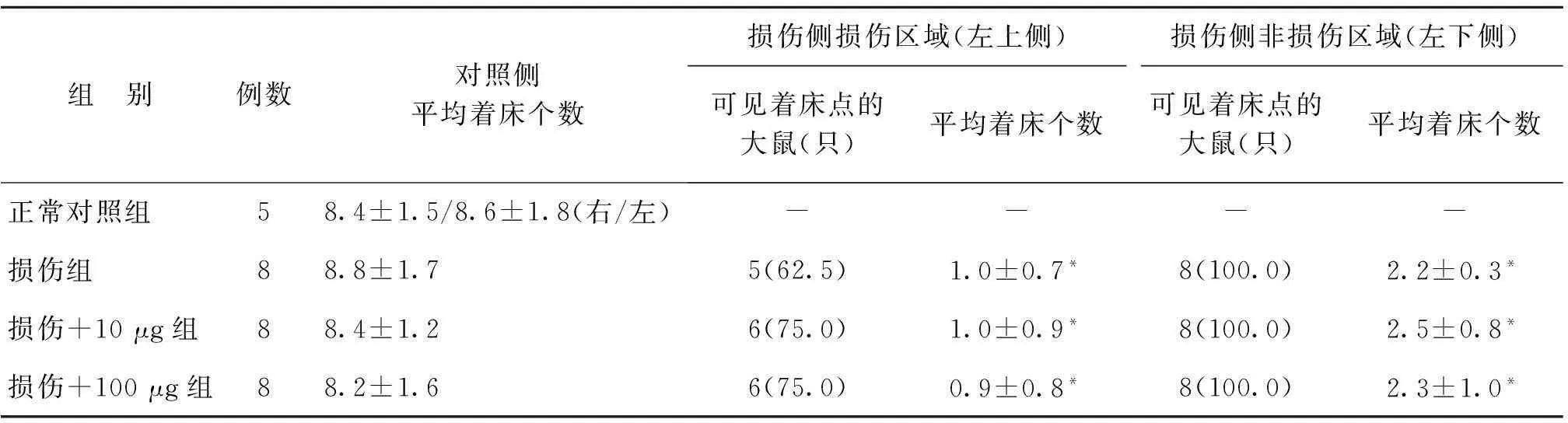
组 别例数对照侧平均着床个数损伤侧损伤区域(左上侧)损伤侧非损伤区域(左下侧)可见着床点的大鼠(只)平均着床个数可见着床点的大鼠(只)平均着床个数正常对照组58.4±1.5/8.6±1.8(右/左)----损伤组88.8±1.75(62.5)1.0±0.7*8(100.0)2.2±0.3*损伤+10μg组88.4±1.26(75.0)1.0±0.9*8(100.0)2.5±0.8*损伤+100μg组88.2±1.66(75.0)0.9±0.8*8(100.0)2.3±1.0*
注:与正常对照组及各组自身对照侧比较,*P<0.01
讨论
生理情况下,子宫内膜伴随卵巢激素水平改变,发生周期性增殖与脱落,体内产生的雌激素在卵泡期促进子宫内膜增殖。然而在内膜病理损伤的情况下,雌激素作为宫腔镜粘连分解术后预防宫腔粘连再发生的常用手段之一,对内膜修复的作用仍然存在争议。子宫内膜病理性损伤是临床常见的导致育龄妇女不孕的原因之一。大部分情况下,损伤后的子宫内膜在自然修复过程中伴随着腺体、上皮不完全再生,胶原纤维增生等,不仅发生形态改变,也涉及内膜的容受功能改变。目前,评估子宫内膜功能的方法有限,容受性相关细胞分子常常用来评价内膜对胚胎的容受功能。
本实验模拟临床刮宫操作,建立大鼠子宫内膜机械损伤模型,在此基础上进行不同剂量的雌激素干预。结果显示,正常对照组和损伤+10 μg雌激素组腺体开口较损伤组和损伤+100 μg雌激素组数量多,实质细胞丰富,纤维化面积小。肯定了雌激素对内膜病理损伤后增殖修复的促进作用,但本实验中较大剂量(100 μg)雌激素干预后的内膜形态与损伤后未干预组比较,内膜形态上无明显差异,且在平均着床数目上略少于其余各组,提示雌激素在剂量上的应用仍需进一步探讨。
此外,胚胎植入过程需要多种因子的参与,胚胎本身与子宫内膜的交流主要通过整合素来完成[4]。整合素是一类细胞粘附分子,表达于细胞膜,并通过结合相应的配体(骨桥蛋白等)发挥生物学功能。胚胎和内膜表达的整合素可识别并结合骨桥蛋白,促进胚胎与内膜的粘附[5]。在种植窗口期,由于雌二醇调节细胞因子和生长因子的分泌,子宫内膜中整合素的表达显著增高,使得内膜容受功能最大化。此外,整合素可以增加血管通透性,促进局部血管的扩张,参与子宫内膜蜕膜化,这些都有益于胚胎与内膜的粘附。众多研究表明,在人类和其他动物模型中,胚胎种植期整合素αvβ3的表达显著增高[6-10]。参与调解子宫内膜功能的细胞因子还有LIF、白介素-6(IL-6)、白介素-1(IL-1)等。其中,作为IL-6家族成员的LIF,是对胚胎植入起到关键作用的细胞因子之一[11]。早在1991年,Bhatt等[12]就证实了子宫内膜中LIF是启动胚胎着床必须的细胞因子。LIF基因突变的雌性小鼠虽可以正常排卵,受精卵发育可至胚泡阶段,但在着床期胚泡游离于宫腔不能植入[13]。研究发现在不孕妇女的子宫内膜中,LIF的表达显著减少[14]。且有研究认为LIF的表达数量可以预测生殖预后[15]。
本研究在大鼠子宫内膜机械损伤后不给予或给予不同剂量的雌激素干预,结果显示,在无雌激素和大剂量雌激素干预情况下,受损的子宫内膜在胚胎植入时整合素αvβ3和LIF表达明显减少,且分布相对局限,仅表达在内膜浅层,提示子宫内膜在机械损伤后,不仅存在内膜形态的改变,例如腺体数量减少,纤维化面积增多,而且容受功能也出现一定程度的下降,损伤后的子宫内膜即使通过体内激素生理周期的调节,其功能仍然存在一定缺陷。有研究报道,10 μg外源性雌激素用于去势大鼠后,体内雌激素水平约相当于大鼠动情期生理雌激素水平[16-17]。本研究结果中给予10 μg雌激素干预后,子宫内膜整合素αvβ3的表达较未干预组增多,分布均匀;LIF的表达也明显改善,阳性细胞数量增多,分布至内膜浅中层。提示与生理水平相当的外源性雌激素可改善子宫内膜损伤后的内膜容受功能,但仍不能恢复至正常。100 μg外源性雌激素干预后,整合素αvβ3的表达较损伤干预组减少,且分布较稀疏,LIF的表达相似,提示过高的雌激素水平也可能降低子宫内膜容受性。林洪波等[18]的研究发现雌激素水平在一定范围内时,与LIF表达呈正相关,随着雌激素水平的升高,LIF表达增加,但超过一定浓度时,反而呈负相关,即过高的雌激素导致LIF表达水平的下降。本实验结果与之相符。
临床工作中,我们常常使用外源性雌激素来诱导子宫内膜发育、改善子宫内膜容受性,为胚胎移植做内膜准备,但其具体用法用量尚不统一[17,19]。在大鼠中,见栓后的第7天已完成胚胎植入[20],肉眼可见子宫内面突起白色小结节。本研究结果显示,子宫内膜损伤大鼠损伤侧较对照侧着床个数显著减少,提示机械损伤后子宫内膜容受功能下降,与孕5.5 d容受相关因子的表达变化相一致。不同组间比较,10 μg雌激素组损伤侧宫腔出现着床的大鼠只数较损伤后未干预组损伤侧出现着床的大鼠只数稍增多。除正常对照组外,余各组间大鼠着床个数比较无显著性差异,结果可能与实验例数较少有关。外源性10 μg 17-β 雌二醇在大鼠体内可升高血清雌激素至相当于大鼠动情期生理水平[21],因此推测,临床治疗中,给予人体生理剂量相当的外源性雌激素干预,可能对子宫内膜修复的效果最佳。
综上所述,本研究观察了雌激素对大鼠子宫内膜损伤后功能修复的影响,包括种植窗口期整合素αvβ3、LIF的表达以及成功植入的胚胎个数,初步评估了子宫内膜病理损伤后自然修复能力以及雌激素干预对子宫内膜修复的影响,认为生理剂量的外源性雌激素可以促进子宫内膜近期及远期修复,而大剂量的雌激素并无益于子宫内膜损伤后的改善。本研究旨在为后期在模型基础上实施预防及治疗提供参考,以期为指导临床治疗提供思路。但由于本研究所采用的大鼠子宫内膜损伤模型与人类子宫内膜之间尚存在种属来源及结构功能的差异,蛋白表达机制的差异以及如何观察胚胎本身对子宫内膜功能的影响等问题还有待于进一步研究。
【参考文献】
[1]March CM. Management of Asherman’s syndrome[J/OL]. Reprod Biomed Online,2011,23:63-76.
[2]March CM. Asherman’s syndrome[J]. Semin Reprod Med,2011,29:83-94.
[3]Tonguc EA,Var T,Yilmaz N,et al. Intrauterine device or estrogen treatment after hysteroscopic uterine septum resection[J]. Int J Gynaecol Obstet,2010,109:226-229.
[4]徐慧颖,李娜,张云山. 胚胎植入-子宫内膜容受性是关键[J]. 生殖医学杂志,2014,23:198-202.
[5]Lessey BA,Castelbaum AJ. Integrins and implantation in the human[J]. Rev Endocr Metab Disord,2002,3:107-117.
[6]Lessey BA,Castelbaum AJ,Buck CA,et al. Further characterization of endometrial integrins during the menstrual cycle and in pregnancy[J]. Fertil Steril,1994,62:497-506.
[7]Fazleabas AT,Bell SC,Fleming S,et al. Distribution of integrins and the extracellular matrix proteins in the baboon endometrium during the menstrual cycle and early pregnancy[J]. Biol Reprod,1997,56:348-356.
[8]Damario MA,Lesnick TG,Lessey BA,et al. Endometrial markers of uterine receptivity utilizing the donor oocyte model[J]. Hum Reprod,2001,16:1893-1899.
[9]Illera MJ,Lorenzo PL,Gui YT,et al. A role for alphavbeta3 integrin during implantation in the rabbit model[J]. Biol Reprod,2003,68:766-771.
[10]Cheng JG,Rodriguez CI,Stewart CL. Control of uterine receptivity and embryo implantation by steroid hormone regulation of LIF production and LIF receptor activity:towards a molecular understanding of “the window of implantation”[J]. Rev Endocr Metab Disord,2002,3:119-126.
[11]Paiva P,Menkhorst E,Salamonsen L,et al. Leukemia inhibitory factor and interleukin-11:critical regulators in the establishment of pregnancy[J]. Cytokine Growth Factor Rev,2009,20:319-328.
[12]Bhatt H,Brunet LJ,Stewart CL. Uterine expression of leukemia inhibitory factor coincides with the onset of blastocyst implantation[J]. Proc Natl Acad Sci U S A,1991,88:11408-11412.
[13]Stewart CL,Kaspar P,Brunet LJ,et al. Blastocyst implantation depends on maternal expression of leukaemia inhibitory factor[J]. Nature,1992,359:76-79.
[14]Seli E,Kayisli UA,Cakmak H,et al. Removal of hydrosalpinges increases endometrial leukaemia inhibitory factor (LIF) expression at the time of the implantation window[J]. Hum Reprod,2005,20:3012-3017.
[15]Mikolajczyk M,Wirstlein P,Skrzypczak J. The impact of leukemia inhibitory factor in uterine flushing on the reproductive potential of infertile women--a prospective study[J]. Am J Reprod Immunol,2007,58:65-74.
[16]Russo LA,Peano BJ,Trivedi SP,et al. Regulated expression of matrix metalloproteinases,inflammatory mediators,and endometrial matrix remodeling by 17beta-estradiol in the immature rat uterus[J]. Reprod Biol Endocrinol,2009,7:124.
[17]Fielder EP,Guzick DS,Guido R,et al. Adhesion formation from release of dermoid contents in the peritoneal cavity and effect of copious lavage:a prospective,randomized,blinded,controlled study in a rabbit model[J]. Fertil Steril,1996,65:852-859.
[18]林洪波,庞厚清,汪燕,等. 超排卵着床期小鼠子宫内膜LIF表达与雌孕激素的关系[J]. 中国现代医药杂志,2009,11:39-43.
[19]郑嵘,王燕,吴维. 中重度宫腔粘连术后应用不同剂量雌激素对预后的影响[J]. 公共卫生与预防医学,2014,25:118-120.
[20]Schlafke S,Enders AC. Cytological changes during cleavage and blastocyst formation in the rat[J]. J Anat,1967,102:13-32.
[21]Gibbs RB. Fluctuations in relative levels of choline acetyltransferase mRNA in different regions of the rat basal forebrain across the estrous cycle:effects of estrogen and progesterone[J]. J Neurosci,1996,16:1049-1055.
[编辑:肖晓辉]
Effect of different doses of estradiol on endometrium repair after mechanical injury in rat
CHENGLong-feng1,2,WANGAi-ming1,2*,FUXin2,3,ZHAOYong2,XUXiang-bo4,HEBin4*
1.AnhuiMedicalUniversity,Hefei230032 2.NavyGeneralHospital,Beijing100048 3.InnerMongoliaUniversityFortheNationalitiesCollegeofClinicalMedicine,InnerMongolia,Tongliao028000 4.ReproductivePhysiologyLaboratory,NationResearchInstituteforFamilyPlanning,Beijing
100081
【Abstract】
Objective: To evaluate the effect of different doses of estradiol on endometrium repair after mechanical injury in rat.
Methods: Fifty Wistar female rats were randomly divided into four groups:control group,endometrium injury group,injury+10 μg estradiol group and injury+100 μg estradiol group. The left side of uterine cavity of all rats except the control group was received mechanical scratching. 17-beta estradiol at doses of 0 μg,10 μg,and 100 μg in 100 μl solvent was subcutaneously injected once daily for 7 consecutive days after scratched. After 21 days of injury,all the female rats were mated with male rats. Then the endometrial morphological changes by HE staining and the markers related endometrial receptivity including integrin αvβ3 and interleukin (LIF)by immunohistochemistry staining were observed on the 5.5thday of pregnancy,and counted the number of embryos on both sides of uterine on the 7thday.
Results: On the 5.5thdays of pregnancy,HE staining showed that the numbers of gland and parenchymal cells were decreased,and the fibrosis area was enlarged in the injury group or the injury+100 μg estradiol group. Gland and parenchymal cells were abundant in the control group or the injury+10 μg estradiol group. Immunohistochemistry staining showed that the expressions of integrin αvβ3 and LIF were significantly decreased in all injury groups than those in the control group (P<0.05). Among the three injury groups,the expressions of integrin αvβ3 and LIF in the injury+10 μg group were significantly higher than those in the injury group or the injury+100 μg estradiol group (P<0.05). The LIF expression was significantly decreased in the injury group than that in the injury+100 μg estradiol group (P<0.05),while the expression of integrin αvβ3 was not significantly different (P>0.05).Compared with the control group or self-control side,the numbers of embryos in all the injury groups were significantly reduced on the 7thday of pregnancy(P<0.01). The numbers of embryos were not significantly different among the three injury groups(P>0.05).
Conclusions: Endometrium presents not only morphological changes,but also significantly decreases in receptivity undergoing natural repair after mechanical injury. An appropriate amount of exogenous estradiol can promote endometrium repair and improve the endometrial receptivity. The best effect was at a dose of 10 μg,and high dose of estradiol may lead to decline of endometrial receptivity in rats.
Key words:Mechanical Injury;Endometrial receptivity;Estradiol;Rat
【作者简介】程龙凤,女,安徽合肥人,在读硕士生,生殖内分泌专业.((* )通讯作者,Email:王蔼明 one_army@sina.com;贺斌 hebox@263.net)
【基金项目】国家“十二五”科技支撑计划项目(2012BAI32B05);国家自然科学基金项目(81370703)
【收稿日期】2015-08-17;【修回日期】2015-11-23
DOI:10.3969/j.issn.1004-3845.2016.04.012
