5-氟尿嘧啶激活TGF-β1/Smad通路治疗结肠癌的机制研究
2016-04-25杨东海
杨东海
054000 河北省邢台市,邢台医学高等专科学校第二附属医院胃肠外科
·论著·
5-氟尿嘧啶激活TGF-β1/Smad通路治疗结肠癌的机制研究
杨东海
054000河北省邢台市,邢台医学高等专科学校第二附属医院胃肠外科
【摘要】目的探讨5-氟尿嘧啶(5-Fu)通过激活转化生长因子β1/Smad(TGF-β1/ Smad)通路治疗结肠癌的机制。方法将24只雄性Wistar大鼠随机分为正常对照组,氧化偶氮甲烷处理组(AOM组)和AOM及5-Fu处理组(AOM+5-Fu组),每组8只。通过实时定量PCR、免疫印迹及免疫组织化学方法观测5-Fu处理后结肠癌组织中TGF-β1及其Ⅱ型受体(TGF-β RⅡ)和下游Smad基因家族成员Smad4表达的变化。结果与对照组大鼠相比,AOM组大鼠TGF-β1 mRNA、TGF-β RⅡ mRNA和Smad4 mRNA的表达显著降低(P<0.01);与AOM组大鼠相比,AOM+5-Fu组TGF-β1 mRNA、TGF-β RII mRNA和Smad4 mRNA的表达显著增加(P<0.01),但没有恢复到对照组水平。与对照组大鼠相比,AOM组大鼠TGF-β1、TGF-β RⅡ和Smad4与β-actin的比值显著降低(P<0.01);与AOM组大鼠相比,AOM+5-Fu组处理后TGF-β1、TGF-β RⅡ和Smad4与β-actin的比值显著增加(P<0.01),但没有恢复到对照组水平。与对照组大鼠相比,AOM组大鼠TGF-β1、TGF-β RⅡ和Smad4的AOD值显著降低(P<0.01);与AOM组大鼠相比,AOM+5-Fu组处理后TGF-β1、TGF-β RⅡ和Smad4的AOD值显著增加(P<0.01),但没有恢复到对照组水平。结论5-Fu能够提高结肠癌组织中TGF-β1,TGF-β RⅡ和Smad4的表达,激活了TGF-β1/Smad通路。
【关键词】结肠肿瘤;5-氟尿嘧啶;转化生长因子β1;受体,转化生长因子βⅡ型;Smad4蛋白
结肠癌(colon cancer)是消化系统主要的恶性肿瘤之一。近年来,随着生活水平提高、饮食结构改变以及人口老龄化等,结肠癌的发病率呈上升趋势,成为严重威胁人类健康的疾病之一[1]。关于结肠癌的治疗,手术切除是最有效的治疗方法,但是晚期结肠癌,化学疗法和放射疗法仍然是一种重要的治疗手段[2]。在临床上,5-氟尿嘧啶(5-fluorouracil,5-Fu)是目前应用最广的抗嘧啶类化疗药物,对消化系统癌症有良好疗效,在肿瘤内科治疗中占有重要地位[3]。5-Fu的治疗机制是通过抑制胸腺嘧啶核苷酸合成酶而抑制DNA的合成。关于5-Fu抑制肿瘤细胞DNA的合成的途径,成为了近年来研究的热点。本研究通过氧化偶氮甲烷(azoxymethane,AOM)建立大鼠结肠癌模型[4],通过实时定量PCR、免疫印迹及免疫组织化学方法观测5-Fu处理后结肠癌组织中转化生长因子β1(TGF-β1)及其Ⅱ型受体(TGF-β RⅡ)和下游Smad基因家族成员Smad4表达的变化,探讨5-Fu通过激活TGF-β1/ Smad通路治疗结肠癌的作用机制,期望所获结果为临床应用5-Fu治疗结肠癌提供理论依据。
1材料与方法
1.1实验动物及分组健康成年雄性Wistar大鼠24只,由河北医科大学实验动物中心提供,体重200~250 g。大鼠被分为正常对照组(Con组),氧化偶氮甲烷处理组(AOM组)和氧化偶氮甲烷及5-Fu处理组(AOM+5-Fu组)。每组8只。
1.2结肠癌模型制备及药物处理氧化偶氮甲烷(Sigma公司,A5486-100MG)溶解于0.9%氯化钠溶液中,AOM组和AOM+5-Fu组大鼠接收皮下AOM注射,用于诱导结肠肿瘤发生,剂量为15 mg/kg体重,每周1次,连续3周。AOM+5-Fu组大鼠在最后一次AOM注射后1 d腹腔注射5-Fu(Sigma公司,F6627-1G),剂量为25 mg/kg体重,每隔5天注射1次,连续注射3次。AOM组大鼠腹腔注射0.9%氯化钠溶液。正常对照组大鼠无任何处理。最后1次5-Fu注射3 d后,所有大鼠处死取结肠癌组织用于实时定量PCR、免疫印迹和免疫组织化学检测。
1.3实时定量PCR检测对照组大鼠切取部分结肠组织,AOM组和AOM+5-Fu组大鼠切取部分结肠癌组织,以0.9%氯化钠溶液(DEPC水配制)冲洗,Trizol Reagent提取RNA,检测其浓度及纯度,按照试剂盒使用说明书制备反应体系逆转录,设计检测指标的相应引物及内参引物,设定反应条件进行PCR扩增。
TGF-β1引物:5'-GACTCCTGCTGCTTTCTCC-3′
5'-GCGGTCCACCATTAGCAC-3′
TGF-β RⅡ引物:5'- GGACGACACCCAGCGTTTA-3' 5'- AGATCGCTCCCATAGTTCACC-3'
Smad4引物:5'- AAGGCCTAGCACCACCTTAG-3'
5'-AGCCTTAAACTCTGACCTGT-3'
GAPDH引物:5'-TGAACGGGAAGCTCACTG-3'
5'-GCTTCACCACCTTCTTGATG-3'
实时荧光定量PCR检测,应用7300 Systerm SDS Software 进行数据处理,统计分析。
1.4免疫印迹检测对照组大鼠切取部分结肠组织,AOM组和AOM+5-Fu组大鼠切取部分结肠癌组织,入4℃裂解液匀浆15 min,4℃离心,取上清,Bradford法测定蛋白浓度,用于TGF-β1、TGF-β RⅡ和Smad4免疫印迹检测。每个样品取50 μg总蛋白经12% SDS-PAGE凝胶电泳分离,电转移至PVDF膜上,用5% 脱脂奶粉室温封闭2 h,入5%脱脂奶粉稀释的山羊抗TGF-β1多克隆抗体(Santa-Cruz公司,C-16,sc-31609, 1∶500)、兔抗TGF-β RⅡ多克隆抗体(Santa-Cruz公司,L-21,sc-400, 1∶200)或山羊抗Smad4多克隆抗体(Santa-Cruz公司,C-20,sc-1909, 1∶1 000)相应一抗4℃ 过夜。PVDF膜以TTBS洗3次,10 min/次。洗膜后加相应的荧光2抗IgG(1∶3 000),室温孵育2 h。TTBS洗膜(3次,10 min/次)。ECL增强免疫发光后显色,采集图片。用Gel-ProAnalyzer软件测量免疫印迹条带相对吸光度值,计算与内参(β-actin)免疫印迹条带相对吸光度的比值,进行分析。
1.5免疫组织化学检测对照组大鼠切取部分结肠组织,AOM组和AOM+5-Fu组大鼠切取部分结肠癌组织,4%多聚甲醛固定24 h,入30%蔗糖液过夜(4℃),冰冻切片(40 μm)。然后进行免疫组织化学SABC法染色。主要步骤为:抗原修复;正常血清室温孵育切片 30 min;TGF-β1(1∶100)、TGF-β RⅡ(1∶50)和Smad4(1∶200)一抗4℃ 孵育48 h;1∶500生物素化二抗室温孵育2 h;1∶500链霉亲和素-过氧化物酶复合物室温孵育1 h;DAB显色5 min;苏木精复染;常规梯度脱水、透明、封片。阴性对照实验以PBS 替代一抗。Olympus显微镜采集图片;IPP6.0图像分析软件测量免疫反应强度平均光密度(AOD)值,进行分析。

2结果
2.13组大鼠实时定量PCR结果与对照组大鼠相比,AOM组大鼠TGF-β1 mRNA、TGF-β RⅡ mRNA和Smad4 mRNA的表达显著降低(P<0.01);与AOM组大鼠相比,5-Fu处理后TGF-β1 mRNA、TGF-β RⅡ mRNA和Smad4 mRNA的表达显著增加(P<0.01),但没有恢复到对照组水平。见图1,表1。
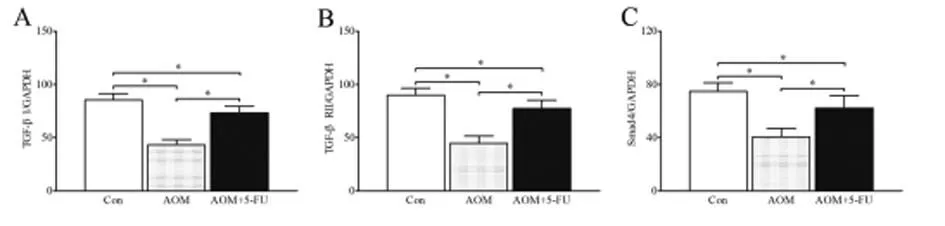
图13组大鼠TGF-β1 mRNA(A)、TGF-β RⅡ mRNA(B)和Smad4 mRNA(C)表达结果
表13组大鼠TGF-β1 mRNA、TGF-β RⅡ mRNA和
Smad4 mRNA表达结果
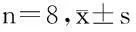

组别TGF-β1mRNATGF-βRⅡmRNASmad4mRNACon组85.5±5.990.1±6.574.8±6.5AOM组43.3±4.9*44.9±6.7*40.6±6.5*AOM+5-Fu组73.4±6.3*#77.6±7.8*#62.4±9.2*#
注:与Con组比较,*P<0.01;与AOM组比较,#P<0.01
2.23组大鼠免疫印迹结果与对照组大鼠相比,AOM组大鼠TGF-β1、TGF-β RⅡ和Smad4与β-actin的比值显著降低(P<0.01);与AOM组大鼠相比,5-Fu处理后TGF-β1、TGF-β RⅡ和Smad4与β-actin的比值显著增加(P<0.01),但没有恢复到对照组水平。见图2,表2。
2.33组大鼠免疫组织化学结果与对照组大鼠相比,AOM组大鼠TGF-β1、TGF-β RⅡ和Smad4的AOD值显著降低(P<0.01);与AOM组大鼠相比,5-Fu处理后TGF-β1、TGF-β RⅡ和Smad4的AOD值显著增加(P<0.01),但没有恢复到对照组水平。见图3,表3。
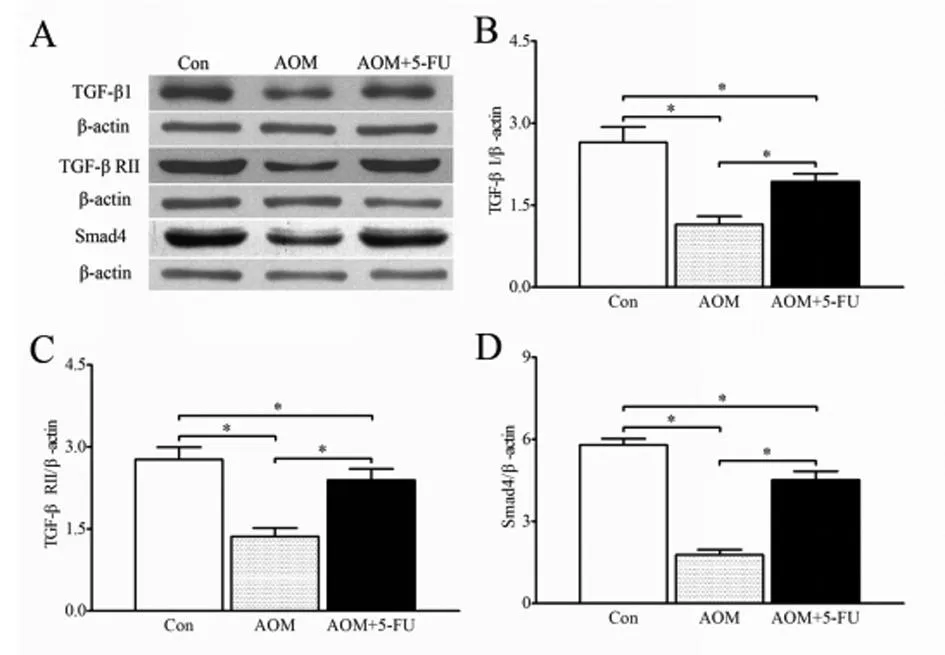
图23组大鼠TGF-β1、TGF-β RⅡ和Smad4免疫印迹条带(A)及与β-actin的比值;B:TGF-β1;C:TGF-β RⅡ;D:Smad4
表23组大鼠TGF-β1、TGF-β RⅡ和Smad4蛋白表达结果


组别TGF-β1TGF-βRⅡSmad4Con组2.65±0.282.77±0.225.80±0.22AOM组1.15±0.15*1.36±0.15*1.77±0.19*AOM+5-Fu组1.93±0.14*#2.39±0.21*#4.51±0.32*#
注:与Con组比较,*P<0.01;与AOM组比较,#P<0.01
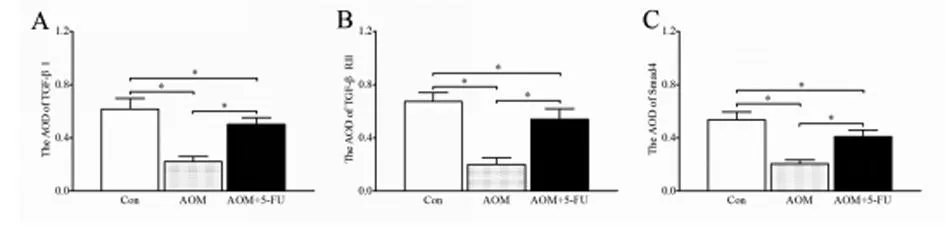
图33组大鼠TGF-β1(A)、TGF-β RⅡ(B)和Smad4(C)免疫组织化学AOD值结果
表33组大鼠TGF-β1、TGF-β RⅡ和Smad4
免疫组织化学AOD值结果

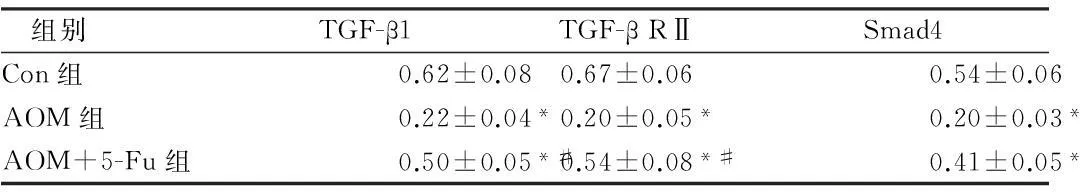
组别TGF-β1TGF-βRⅡSmad4Con组0.62±0.080.67±0.060.54±0.06AOM组0.22±0.04*0.20±0.05*0.20±0.03*AOM+5-Fu组0.50±0.05*#0.54±0.08*#0.41±0.05*#
注:与Con组比较,*P<0.01;与AOM组比较,#P<0.01
3讨论
本研究通过实时定量PCR、免疫印迹及免疫组织化学方法显示,AOM处理组大鼠结肠癌组织中TGF-β1, TGF-β RII和Smad4在基因和蛋白水平的表达比正常结肠组织显著降低,与AOM处理组大鼠相比,5-Fu处理后大鼠结肠癌组织中TGF-β1,TGF-β RⅡ和Smad4的表达显著提高,上述结果提示5-Fu可以通过激活TGF-β1/Smad通路对大鼠结肠癌具有一定的治疗作用。
临床上,结肠癌的表现缺乏特异性,给临床早期明确诊断增加了困难,确诊往往需要结肠镜检查[2]。近年来,我国结肠癌的发病率呈逐年上升的趋势,严重影响着患者的生存质量。因此,对结肠癌的治疗具有非常重要的临床意义。研究显示,结肠癌的肿瘤发生与多种分子通路有关,如TGF-β1/Smad通路、Wnt/β-catenin通路、诱生型一氧化氮合酶(iNOS)分子、热休克蛋白-90(HSP-90)分子以及环氧合酶-2(COX-2)分子途径等[5]。因此,对上述分子途径的干扰,能够对结肠癌的治疗具有一定的临床意义。有研究报道,结肠癌及胃癌患者中存在TGF-β RⅡ的失活及Smad基因的突变,导致TGF-β1/Smad通路的中断[6],20%~25%的结肠癌患者中存在TGF-β RⅡ基因的突变[7]。本实验中发现,AOM处理组大鼠TGF-β1,TGF-β RⅡ和Smad4的表达显著降低,这与上述实验结果基本一致。而激活TGF-β1/Smad通路,用于恶性肿瘤治疗方面的研究相对较少。
本研究发现,5-Fu能够明显提高AOM引起的结肠癌组织中TGF-β1,TGF-β RⅡ和Smad4的表达,显示5-Fu激活了TGF-β1/Smad通路。其激活机制可能为:结肠癌组织中升高的TGF-β1与TGF-β RⅡ结合后,激活并募集转化生长因子βⅠ型受体(TGF-β RⅠ),形成二聚体受体复合物。随后,TGF-β RⅡ磷酸化TGF-β RⅠ的甘氨酸-丝氨酸富集区域,然后活化TGF-β RⅠ的丝氨酸/苏氨酸活性。活化的TGF-β RⅠ磷酸化受体调节的Smads蛋白Smad 2和Smad 3,使Smad 2和Smad 3得构象发生改变,从受体复合物中释放出来,进而被Smad 4蛋白的MH2结构域识别并形成异质二聚体复合物,然后转运到细胞核内,与序列特异的DNA结合蛋白结合,激活特定的靶基因,通过介导细胞G1期阻滞,促进分化和凋亡,抑制细胞生长[8,9]。Smad4作为TGF-β1介导的信号通路中的一种关键因子,其表达的升高能够抑制细胞过度增殖与生长[10]。研究表明,Smad4基因是一种肿瘤抑制基因[11],Smad4基因的突变,导致Smad4的活性降低,引起TGF-β1信号通路的中断,最终诱发癌症的发生[12,13]。本研究从结肠癌标本上观察到的实验结果进一步证实。
综上所述,本实验观察到5-Fu能够提高结肠癌组织中TGF-β1,TGF-β Ⅱ和Smad4的表达,激活了TGF-β1/Smad通路。上述研究结果为临床应用5-Fu治疗结肠癌提供一定的理论依据。
参考文献
1Fleshman JW, Smallwood N.Current concepts in rectal cancer.Clin Colon Rectal Surg,2015,28: 5-11.
2Kim JH.Chemotherapy for colorectal cancer in the elderly.World J Gastroenterol,2015,21: 5158-5166.
3Chang PK,Chiang MH,Jao SW,et al.The outcome of 5-fluorouracil chemotherapy after the completion of neoadjuvant chemoradiotherapy,administered until 2 weeks before rectal cancer resection.J Chin Med Assoc,2015,78: 475-480.
4Watanabe H,Kashimoto N,Ushijima M,et al.Effects of a water-soluble extract of Ganoderma lucidum mycelia on aberrant crypt foci induced by azoxymethane and small-intestinal injury by 5-Fu in F344 rats.Med Mol Morphol,2013,46: 97-103.
5Chen J,Huang XF.The signal pathways in azoxymethane-induced colon cancer and preventive implications.Cancer Biol Ther,2009,8:1313-1317.
6Markowitz S,Wang J,Myeroff L,et al.Inactivation of the type II TGF-beta receptor in colon cancer cells with microsatellite instability.Science,1995,268: 1336-1338.
7Derynck R,Akhurst RJ,Balmain A.TGF-beta signaling in tumor suppression and cancer progression.Nat Genet,2001,29: 117-129.
8Krafft E1,Lybaert P,Roels E,et al.Transforming growth factor Beta 1 activation, storage, and signaling pathways in idiopathic pulmonary fibrosis in dogs.J Vet Intern Med,2014,28: 1666-1675.
9Strand DW,Liang YY,Yang F,et al.TGF-β induction of FGF-2 expression in stromal cells requires integrated smad3 and MAPK pathways.Am J Clin Exp Urol,2014,2: 239-248.
10Flanders KC,Heger CD,Conway C,et al.Brightfield proximity ligation assay reveals both canonical and mixed transforming growth factor-β/bone morphogenetic protein Smad signaling complexes in tissue sections.J Histochem Cytochem,2014,62:846-863.
11Howe JR,Roth S,Ringold JC,et al.Mutations in the SMAD4/DPC4 gene in juvenile polyposis.Science,1998,280:1086-1088.
12Hata A,Shi Y,Massagué J.TGF-beta signaling and cancer: structural and functional consequences of mutations in Smads. Mol Med Today,1998,4: 257-262.
13Salovaara R,Roth S,Loukola A,et al.Frequent loss of SMAD4/DPC4 protein in colorectal cancers.Gut,2002,51: 56-59.
The action mechanism of 5-fluorouracil in treatment of colon cancer by activating TGF-β1/Smad pathway
YANGDonghai.
TheSecondHospitalAffiliatedtoXingtaiMedicalCollege,Hebei,Xingtai054000,China
【Abstract】ObjectiveTo explore the action mechanism of 5-fluorouracil (5-Fu) in treatment of colon cancer by activating TGF-β1/Smad pathway.MethodsA total of 24 male Wistar rats were randomly divided into control group,azoxymethane treatment group (AOM group),AOM plus 5-Fu treatment group (AOM+5-Fu group),with 8 rats in each group. The expression levels of transforming growth factor-β1 (TGF-β1),TGF-β typeⅡ receptor (TGF-β RⅡ) and Smad4 of Smad gene family members were detected by Real-time quantitative PCR, Western Blot and immunohistochemistry,respectively.ResultsAs compared with those in control group, the expression levels of TGF-β1 mRNA,TGF-β RⅡ mRNA and Smad4 mRNA were significantly decreased (P<0.01). As compared with those in AOM group, the expression levels of TGF-β1, TGF-β RⅡ and Smad4 were significantly increased (P<0.01) after 5-Fu treatment.ConclusionThe 5-Fu can increase the expression levels of TGF-β1, TGF-β RⅡ and Smad4 in colon cancer tissues to activate TGF-β1/Smad pathway.
【Key words】colon cancer;5-fluorouracil;transforming growth factor-β1;receptor,transforming growth factor-β typeⅡ;Smad4 protein
(收稿日期:2015-09-08)
【中图分类号】R 735.35
【文献标识码】A
【文章编号】1002-7386(2016)06-0805-04
doi:10.3969/j.issn.1002-7386.2016.06.001
