盐酸小檗碱对草鱼补体系统及补体c3作用的研究
2016-04-23彭耀宗黄利挂李学刚
彭耀宗,周 霞,韩 冰,黄 涛,黄利挂,李学刚,3,4
(1.西南大学药学院,重庆 400715;2.西南大学生命科学学院,400715;
3.重庆中药现代化生产力促进中心,重庆 400715;
4.重庆市药物过程与质量控制工程技术研究中心,重庆 400715)
盐酸小檗碱对草鱼补体系统及补体c3作用的研究
彭耀宗1,周霞1,韩冰2,黄涛1,黄利挂1,李学刚1,3,4
(1.西南大学药学院,重庆400715;2.西南大学生命科学学院,400715;
3.重庆中药现代化生产力促进中心,重庆400715;
4.重庆市药物过程与质量控制工程技术研究中心,重庆400715)
摘要:为了探究盐酸小檗碱(berberine hydrochloride)对草鱼(Ctenopharyngodon idellus)补体c3的作用机理,用含0、0.06%、0.12%、0.24%盐酸小檗碱饲料投喂草鱼,在第7 d、14 d检测血清中补体c3含量,在第14 d检测肝脏中补体c3 mRNA表达量及急性感染嗜水气单胞菌(Aeromonas hydrophila)后存活情况。并进一步对盐酸小檗碱体内药代动力学和补体消耗试验进行了研究。结果显示;摄食盐酸小檗碱的草鱼血清中补体c3含量和肝脏补体c3 mRNA表达量均显著性增加(P<0.05/P<0.05),草鱼的存活率与对照组相比也有显著性提高(P<0.01)。补体消耗试验结果显示,当盐酸小檗碱在血清中浓度小于5 mg/L时与对照组相比补体消耗不显著,当盐酸小檗碱浓度大于5 mg/L时,补体消耗达到显著性差异(P<0.05),表明此时盐酸小檗碱与补体c3直接结合,激活补体。药代动力学实验发现,灌服盐酸小檗碱后,出现双峰现象,两峰值分别是0.243 mg/L和0.117 mg/L,此浓度远远低于与补体c3直接结合量最低量(5 mg/L)。结果表明,盐酸小檗碱对草鱼补体c3的作用机理可能是通过上调补体c3mRNA的表达增加补体c3数量,而非通过直接结合补体c3来改变其活性。
关键词:草鱼(Ctenopharyngodon idellus);盐酸小檗碱;补体c3;中药
近年来,我国水产养殖业得到长足的发展,随之而来的病害防控使得抗生素滥用成灾,各国取消饲用抗生素的呼声也越来越高,中药以其独特的优势已成为各国研究的热点[1]。鱼类主要疾病是细菌性和病毒性疾病[2-3],黄连类清热解毒中药具有很好的抗菌抗病毒作用,黄连的代表性成分小檗碱(Berberine,BBR)又称黄连素,是黄连主要的生物碱,是一种黄色的异喹啉类生物碱[4-7],现代医学研究表明,小檗碱有杀菌、抗病毒、降血糖以及免疫调节等作用[8-9],在杀菌抗病毒方面,国内外已有不少报道[10-13]。但大部分是黄连复方杀菌抗病毒[14-15],而关于黄连单体小檗碱对免疫大分子机理研究却鲜有报道。
补体c3是补体成分中含量最高的一种,不论是经典途径还是替代途径,均需在c3被活化之后,才能推进后续补体成分的连锁反应[16],参与抗菌及多种免疫调节和应答反应[17],在补体系统激活中起关键性作用。因此一定程度上提高补体c3水平对鱼类非特异性免疫有重大意义。本研究工作系统评价了盐酸小檗碱对补体c3含量,mRNA表达及其分子结构变化的影响,为黄连等清热类中药在水产养殖上的应用提供理论依据。
1材料和方法
1.1试验鱼
试验草鱼(Ctenopharyngodonidellus)(500±10) g购自重庆市草鱼养殖厂,从中挑选整齐、健壮的草鱼,在实验室循环水养殖箱中驯养14 d,水中溶氧保持在5 mg/L以上,水温控制(25±1) ℃。
1.2饲料与分组
通威全价饲料打成粉,按0、600、1 200、2 400 mg/kg添加盐酸小檗碱,将各种原料充分混合后,加入膨化机中,即制备成普通饲料(NC)组、0.06%(BBR-L)组、0.12%(BBR-M)组、0.24%(BBR-H)组的盐酸小檗碱饲料,烘干后放于室温保存。
1.3测定指标与方法
1.3.1草鱼血清补体c3含量测定
将试验鱼随机分在NC、BBR-L、BBR-M、BBR-H组,每组6尾,每天投喂饲料10 g/尾,分别在第7 d、14 d尾静脉取血,4 ℃离心,4 000 r/min,10 min,取上清液置备血清,血清保存于4 ℃冰箱,重复三次,血清补体c3含量测定按南京建成补体c3试剂盒说明书进行。
1.3.2RNA提取、cDNA合成和实时荧光定量PCR
RNA的提取及cDNA的合成:NC、BBR-L、BBR-M、BBR-H组喂养(10 g/(尾·d))14 d后取肝脏每尾50 mg,液氮研磨,按照TRIzol (Invitrogen公司)说明书提取肝脏总RNA,测定其浓度和纯度,用1.5%的琼脂糖凝胶电泳鉴定其完整性,按照PrimeScript®RTreagentKit(Takara公司)试剂盒说明书将提取的总RNA反转录为cDNA,-20 ℃保存备用。
实时荧光定量PCR分析基因表达:利用primer Primer 5.0设计引物,根据实验室获得草鱼的补体c3全长序列(GenBank登录号:AY374472.1) 和β-actin 基因(GenBank登录号:DQ211096.1),设计荧光定量引物(表1), 荧光定量PCR反应采用荧光染料SYBR Green,根据TaKaRa公司产品设计反应体系。在Bio-Rad的CFX96系统上执行。PCR反应程序:95 ℃ 3 min,95 ℃ 10 s,53.9 ℃ 30 s,72 ℃ 30 s ,42个循环,溶解曲线从55.0 ℃到95.0 ℃ 每5 s增加0.5 ℃作为一个时间间隔用来检测补体c3的表达差异。mRNA相对表达水平的计算采用了2-△△CT法和用β-actin进行标准化。

表1 草鱼补体c3基因和β-actin参考基因引物序列
1.3.3细菌攻毒实验
嗜水气单胞菌(Aeromonashydrophila)菌株由中国海洋微生物菌种保藏管理中心提供,将NC、BBR-L、BBR-M、BBR-H组喂养14 d后,每组30尾,分别腹腔注射0.2 mL无菌生理盐水和等量的嗜水气单胞菌(108cfu/mL),观察发病症状及死亡情况,分离细菌,确认死因,连续10 d均无死亡情况后统计草鱼存活情况。
1.3.4补体消耗实验
盐酸小檗碱体外补体激活实验Ji等[18]已报道。本研究在他们实验上稍加改善。将试验鱼随机分为8组,每组10尾,尾静脉取血,分离血清,取30 μL的草鱼血清分别与等量的4、10、20、40、80、120、160 mg/L的盐酸小檗碱溶液充分混合,搅拌1.5 h。用等体积的PBS代替盐酸小檗碱作为对照组。分别在每支试管中加入60 μL新鲜兔红细胞(1×108cells/mL),不时轻微摇动1.5 h后,在每支试管中加入3.38 mL PBS,并在1 600g条件下离心5 min,取上清液于414 nm处测定吸光度。在60 μL兔红细胞中分别加入3.44 mL蒸馏水或PBS,获得溶血的最大值和最小值(自发溶血)。补体引起的兔红细胞溶血率按下面公式计算:溶血率={[A414 nm(样品)-A414 nm(自然溶血)]/
[A414 nm(100% 全溶血)-A414 nm(自然溶血)]}×100%。
1.3.5药代实验
每尾鱼按48 mg/kg灌服盐酸小檗碱(5 mg/mL),药液务必灌入草鱼前肠,无回吐者用于试验。在0.5、1、1.5、2、3、4、5、6、8、12、24、36 h尾静脉采血,置于预先用1%肝素钠抗凝过的试管内,分离血浆,-20 ℃保存,各时间点设置6个重复。样品前处理参考马寅[19]的方法,把血清和乙酸乙酯按体积比1∶4比例混合,离心,收集上清液于15 mL离心管中,同法重复1次,合并2次收集的上清液,置于氮吹仪上吹干,加入1 mL甲醇,涡旋2 min,经0.25 μm一次性针头过滤器过滤后,采用流动相乙腈-磷酸二氢钾(50∶50),流速1.0 mL/min,检测波长345 nm,进样量50 μL,进样检测,保留时间为25 min,回收率及精密度试验参考马寅[19]方法进行。
1.3.6实验数据的分析
所有数值均为平均值±标准差。统计分析采用spss软件,用独立样本t-检验分析试验结果的差异显著性,P<0.05 为显著性差异。
2结果与分析
2.1草鱼血清补体c3含量的变化
投喂盐酸小檗碱饲料后血清补体c3的变化见图1,投喂7 d, BBR-M和BBR-H组显著高于对照组(P<0.05)。当投喂14 d后,3个给药组补体c3升高均达显著水平(P<0.05),且呈一定趋势的剂量依赖关系。结果表明盐酸小檗碱能促进草鱼血清补体c3含量的增加,且与浓度和喂养时间成正相关。
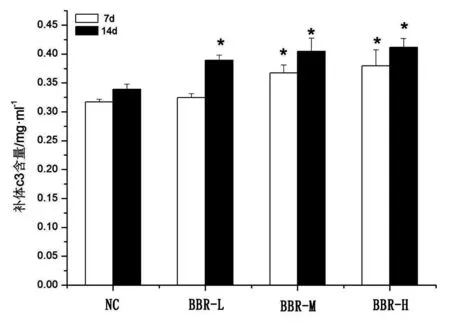
图1 各个浓度盐酸小檗碱对草鱼血清补体c3的影响
2.2补体c3 mRNA的表达
投喂盐酸小檗碱饲料14 d后,检测肝脏中补体c3 mRNA表达的变化(图2)。PCR结果显示,试验组草鱼补体c3 mRNA表达均显著性升高(P<0.05),高浓度的上调比例大于低浓度,且上调的趋势与血清中补体c3结果类似。表明盐酸小檗碱能上调草鱼补体c3 mRNA的表达。
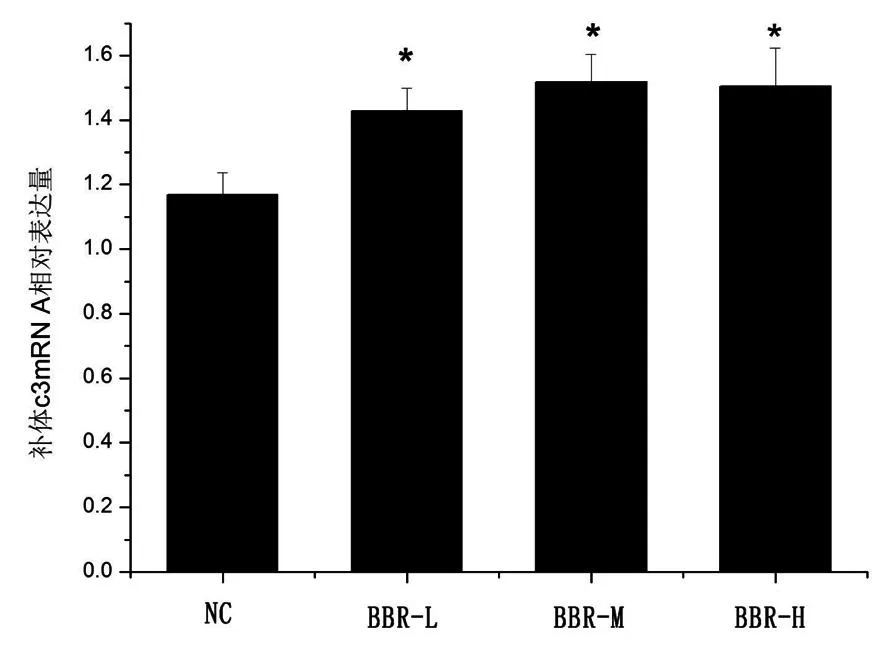
图2 不同含量盐酸小檗碱对补体c3 mRNA表达的影响
2.3细菌攻毒试验结果
攻毒结果见图3,BBR-L、BBR-M、BBR-H组草鱼存活数分别是15尾、21尾和22尾,存活率分别为50%、70%、73.3%。而对照组(NC)存活仅3尾,存活率为10%。统计分析结果显示,各个浓度试验组草鱼存活率均显著提高(P<0.01),表明盐酸小檗碱能提高草鱼的免疫力,且高剂量比低剂量更有效。

图3 草鱼投喂不同浓度盐酸小檗碱后用嗜水气
2.4体外补体消耗试验
图4可见,当盐酸小檗碱在血清中浓度为2 mg/L时溶血率为85.71%,与对照组85.19%相比变化不大,此时未激活补体,当盐酸小檗碱在血清中浓度为5 mg/L时,溶血率为82.42%,溶血率有所下降但未达显著水平(P>0.05),当盐酸小檗碱在血清中的浓度超过10 mg/L时,溶血率先降低后升高,其浓度为10、20、40、60 mg/L时溶血率显著性下降(P<0.05),此结果与Ji等[18]报道是一致的,表明此浓度的盐酸小檗碱激活补体系统。40 mg/L以后溶血率逐渐升高,可能是由于高浓度盐酸小檗碱具有溶血功能。试验结果表明,当血清中盐酸小檗碱浓度小于5 mg/L时不能激活补体,当盐酸小檗碱浓度≥10 mg/L时补体被激活。
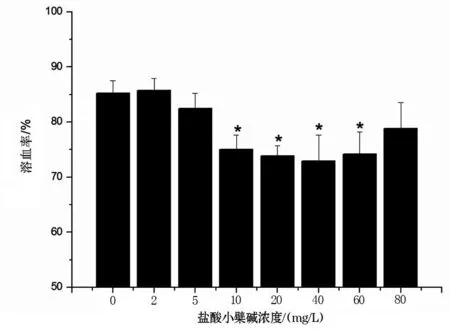
图4 盐酸小檗碱对补体消耗的影响
2.5盐酸小檗碱药代动力学
在设定的色谱条件下,本法回收率为95.3%±1.1%,日内与日间精密度均小于10%,结果显示此法适合样品检测。灌服盐酸小檗碱后,血药浓度随时间变化见图5,灌服药物后血药浓度逐渐升高,在1.5 h时达到第一个峰(0.243 mg/L),之后血药浓度下降后又升高,在第5 h时到达第二峰(0.117 mg/L),36 h后检测不到盐酸小檗碱。本研究结果出现明显双峰现象与秦青英[20]研究罗非鱼口灌盐酸小檗碱和王亮等[21]研究小鼠口服小檗碱等结果类似,出现双峰的原因可能是因为分布-重吸收,当组织的药物浓度高于血浆,药物可能从组织转移到血浆,或肝肠循环造成二次吸收带来的。

图5 口灌盐酸小檗碱在草鱼体内血浆的药物浓度-
3讨论
补体系统在被病原体或者抗原抗体复合物等多种物质激活后,能诱导炎症反应和抗体的形成,介导病原体的清除[22],其中补体c3在激活途径中起关键作用,其水平是衡量体液免疫的重要指标[23-24]。在我们研究中,投喂盐酸小檗碱14 d后,攻毒实验表明草鱼存活率显著提高。为探究体液免疫的保护作用,我们对补体c3作用机理展开了研究,实验发现草鱼摄食盐酸小檗碱后,血清中补体c3的含量明显升高,荧光定量PCR实验也表明补体c3 mRNA相对表达显著性增加,蛋白质的表达与mRNA的实验结果是一致的,说明盐酸小檗碱能通过上调补体c3 mRNA表达来提高补体c3数量。
天然补体c3发挥功效主要是通过蛋白酶水解切割后其构象改变完成的[25],补体c3活化会引起膜攻击复合物的形成,当补体c3被激活后进而推动后续免疫反应[26]。Ji等[18]报道在草鱼血清中加入盐酸小檗碱,盐酸小檗碱能与补体c3直接结合,改变补体c3构象,进而激活补体c3。本研究结果与文献报道结果类似,即盐酸小檗碱在血清中浓度达到5 mg/L时,可以激活补体c3,但未达显著水平,当盐酸小檗碱浓度达到10 mg/L后,激活作用达到显著水平,可见高浓度的盐酸小檗碱可以与补体c3直接结合并改变补体c3的构像,激活补体c3,浓度低于5 mg/L则无此作用。研究盐酸小檗碱体内药代动力学发现,药-时曲线出现2个峰,最大值为0.243 mg/L,远远低于盐酸小檗碱与补体c3直接作用所需要的浓度(5 mg/L),因此,可以推测,草鱼摄食盐酸小檗碱后,体内血药浓度不足以达到盐酸小檗碱与补体c3直接相结合的浓度,此时盐酸小檗碱与补体c3不能直接结合产生激活作用。
本试验表明,盐酸小檗碱能提高草鱼免疫力,对草鱼补体c3作用机理可能是通过上调补体c3 mRNA的表达,增加体内补体c3数量来完成。而并非通过直接结合补体c3改变其活性来完成的,这也为黄连、黄柏等含小檗碱的中草药用于水产疾病的防止提供了理论依据。
参考文献:
[1]Gorbach S L.Antimicrobial use in animal feed-time to stop[J].New England J Med,2001,345(16):1202.
[2]李华,李强,付雷.几种中草药对海水养殖中常见病原菌的抗菌作用[J].大连海洋大学学报,2011,26(1):6-11.
[3]李义,黄辉,陈建.中国水生动物病毒病研究进展[J].四川畜牧兽医学院学报,1998,(2):8.
[4]Ma B L,Ma Y M.Pharmacokinetic properties,potential herb-drug interactions and acute toxicity of oral rhizoma coptidis alkaloids[J].Exp Opin on Drug Metabol Toxicol,2013,9(1):51-61.
[5]Ye M,Fu S,Pi R,et al.Neuropharmacological and pharmacokinetic properties of berberine:a review of recent research[J].J Pharma Pharmacol,2009,61(7):831-837.
[6]Fan D,Wu X,Dong W,et al.Enhancement by sodium caprate and sodium deoxycholate of the gastrointestinal absorption of berberine chloride in rats[J].Drug Develop Indust Pharma,2013,39(9):1447-1456.
[7]Eom K S,Kim H J,So H S,et al.Berberine-induced apoptosis in human glioblastoma T98G cells is mediated by endoplasmic reticulum stress accompanying reactive oxygen species and mitochondrial dysfunction[J].Biol Pharmaceut Bull,2010,33(10):1644-1649.
[8]昝琦,刘欣,逄越,等.补体C3结构与功能研究进展[J].中国免疫学杂志,2014,(4):549-553.
[9]Huang C G,Chu Z L,Wei S J,et al.Effect of berberine on arachidonic acid metabolism in rabbit platelets and endothelial cells[J].Thromb Res,2002,106(4):223-227.
[10]Freile M L,Giannini F,Pucci G,et al.Antimicrobial activity of aqueous extracts and of berberine isolated from Berberis heterophylla [J].Fitoterapia,2003,74(7):702-705.
[11]Stermitz F R,Lorenz P,Tawara J N,et al.Synergy in a medicinal plant:antimicrobial action of berberine potentiated by 5'-methoxyhydnocarpin,a multidrug pump inhibitor[J].Proceed Nat Acad Sci,2000,97(4):1433-1437.
[12]Hayashi K,Minoda K,Nagaoka Y,et al.Antiviral activity of berberine and related compounds against human cytomegalovirus[J].Bioor Medic Chem Letters,2007,17(6):1562-1564.
[13]李一珊,倪晨,童建辉,等.黄连、五倍子醇提物对罗非鱼源性链球菌生长曲线的影响[J].中国实验方剂学杂志,2013,19(6):234-237.
[14]蒋国政,李继昌,韩振兴,等.六味中药对养殖场供水渠道真菌的抗菌活性研究[J].中国兽医杂志,2012,48(8):68-70.
[15]杨国栋,肖鱼,赵建培.防治草鱼出血病并发症的经验[J].饲料研究,1985,(10):20.
[16]Smith L C,Clow L A,Terwilliger D P.The ancestral complement system in sea urchins[J].Immunol Rev,2001,180(1):16-34.
[17]万金娟,刘波,戈贤平,等.硬骨鱼补体系统的研究进展[J].江西农业学报,2012(11):159-164.
[18]Ji C,Zhang D F,Li A H,et al.Effect of berberine hydrochloride on grass carpCtenopharyngodonidellaserum bactericidal activity against Edwardsiella ictaluri [J].Fish Shellfish Immunol,2012,33(1):143-145.
[19]马寅.氟苯尼考和恩诺沙星在大黄鱼体内的代谢动力学研究[D].浙江宁波:宁波大学,2012.
[20]秦青英.盐酸小檗碱在罗非鱼体内药代动力学及残留研究[D].广东湛江:广东海洋大学,2014.
[21]王亮,叶小利,李学刚,等.黄连生物碱在大鼠体内的代谢转化及分布[J].中国中药杂志,2010,(15):2017-2020.
[22]Ferreira A M.How echinococcus granulosus deals with complement [J].Parasitol Today,2000,16:168.
[23]Holland M C H,Lambris J D.The complement system in teleosts[J].Fish Shellfish Immunol,2002,12(5):399-420.
[24]Ellis A E.Immunity to bacteria in fish [J].Fish Shellfish Immunol,1999,(4):291-308.
[25]Janssen B J,Huizinga E G,Raaijmakers H C,et al.Structures of complement component C3 provide insights into the function and evolution of immunity [J].Nature,2005,437(22):505-511.
[26]Law S K,Lichtenberg N A,Levine R P.Evidence for an ester linkage between the labile binding site of C3b and receptive surfaces[J].J Immunol,1979,123(3):1388-1394.
(责任编辑:张潇峮)
The effects of berberine hydrochloride on complement system and complement c3 in Ctenopharyngodon idellus
PENG Yao-zong1,ZHOU Xia1,HAN Bing2,HUANG Tao1,HUANG Li-gua1,LI Xue-gang1,3,4
(1.SchoolofPharmaceuticalSciences,SouthwestUniversity,Chongqing400715,China;2.SchoolofLifeSciences,SouthwestUniversity,Chongqing400715,China;3.InstituteofModernBioPharmaceutical,Chongqing400715,China;4.EngineerResearchCenterofChongqingPharmaceuticalProcessandQualityControl,Chongqing4001715,China)
Abstract:To explore the effect of berberine hydrochloride on the complement c3 of Ctenopharyngodon idellus,the level of complement c3 in serum were studied for 7 day and 14 day,the mRNA expression of c3 in the liver and resistance against acute Aeromonas hydrophila infection in C.idellus were evaluated after 14 days of feeding with berberine hydrochloride at the rate of 0,0.06%,0.12%,0.24%,respectively.The pharmacokinetics in vivo and complement consumption test in vitro of berberine hydrochloride were further studied.The results showed that the complement c3 levels in serum and the mRNA expression of c3 in the liver of fish fed with berberine hydrochloride increased significantly when compared with the control (P<0.05/P<0.01).The survival rate was significantly higher in groups fed with berberine hydrochloride than the control (P<0.01).In addition,complement consumption showed significant difference only when the concentration of berberine hydrochloride was higher than 5 mg/L.Berberine hydrochloride combined with complement molecules directly and the complement system was activated at this time.The pharmacokinetics experiment found that bimodal phenomena appeared after taking berberine hydrochloride and the value of two peaks was 0.243 mg/L and 0.117 mg/L,respectively,which was much lower than 5 mg/L.The results suggested that the berberine hydrochloride could enhance the immunity of C.idellus and the effect of berberine hydrochloride on the complement c3 in C.idellus might not be by combining with complement molecules directly,but through up-regulating the mRNA expression of c3 to increase the quantity of c3 protein.
Key words:Ctenopharyngodon idellus;berberine hydrochloride;complement c3;Chinese herbal medicine
中图分类号:S948
文献标识码:A
文章编号:1000-6907-(2016)02-0050-05
作者简介:第一彭耀宗(1988-),男,硕士研究生,专业方向为天然药物化学。E-mail:pyz516565384@163.com通讯作者:李学刚。E-mail:xuegangli@swu.edu.cn
收稿日期:2015-07-15;
修订日期:2015-10-28
资助项目:国家科技支撑计划-石柱黄连规范化种植基地及其SOP优化升级研究(2011BAI13B02-1);石柱黄连须散中试工艺研究,西南大学校地合作基金(Sz201302);重庆百名高端工程技术人才培养计划
