幼鱼阶段电刺激对稀有鲫性腺发育及繁殖的影响
2016-04-23陈冬明刘小红黄自豪王志坚
陈冬明,刘小红,黄自豪,王志坚
(西南大学生命科学学院,淡水鱼类资源与生殖发育教育部重点实验室,
水产科学重庆市重点实验室,重庆 400715)
陈冬明,刘小红,黄自豪,王志坚
(西南大学生命科学学院,淡水鱼类资源与生殖发育教育部重点实验室,
水产科学重庆市重点实验室,重庆400715)
摘要:控制水域电压为75 V,电流280 mA,持续电刺激5 500 ms左右,电刺激的作用强度是使鱼既能达到休克昏迷状态又能在几分钟内苏醒。通过对1月龄的稀有鲫(Gobiocypris rarus)进行电刺激,观察电刺激对其性腺发育及性成熟后繁殖的影响,以期为渔政部门评价电捕鱼行为对鱼类资源的影响提供参考。结果表明,电刺激1次组、电刺激3次组和电刺激5次组可以促进雌雄鱼的生长和性腺发育,连续电刺激组对雄鱼的生长和性腺发育影响不大却会抑制雌鱼的生长和性腺发育;电刺激1次组、电刺激3次组和电刺激5次组对性成熟后雌雄鱼的繁殖没有产生显著差异,而连续电刺激组对性成熟后雄鱼的繁殖没有产生显著差异,却会造成雌鱼不产卵、或产出的卵颜色泛白,且可产卵雌鱼的产卵周期平均延长4.5 d,产卵量平均减少36粒,受精率平均降低9.2%。组织切片观察发现,电刺激1次组、电刺激3次组和电刺激5次组对性成熟后雌鱼的卵巢没有造成影响,而连续的周期性电刺激对性成熟后雌鱼卵巢中大的卵细胞的细胞膜造成了损坏,细胞膜界限变得不清晰;电刺激对性成熟后雄鱼精巢没有造成影响。
关键词:电刺激;性腺发育;生长;繁殖;稀有鲫(Gobiocypris rarus)
鱼类的生长繁衍受各种环境因子的影响,包括温度、光照、盐度、溶氧和pH等,这些因子及相互作用决定鱼类生长繁衍的内在潜力[1]。鱼类在受到外界各类环境因子的刺激后会作出反应,克服由环境变化而引起的伤害[2]。电刺激属于一种物理性环境刺激因子,鱼类在水中受到不同强度的电场刺激时,会产生各种异常反应,当电场电压过高时则会引起鱼的死亡[3]。电捕鱼就是利用鱼类在水中受到一定强度的电场刺激会被击晕、休克、失去活动性而进行捕捞的一种方法。《中华人民共和国渔业法 》明确规定,禁止采取电鱼等破坏渔业资源的方法进行捕捞,但电捕鱼行为屡禁不止。有关鱼类在各种电场中行为反应特征的研究已有大量报道[4-9]。有研究发现,电刺激对鱼类会造成不利影响,如引起鱼类死亡[10]、缺氧[11]以及行为形态异常[12]等;也有研究发现,电刺激对鱼类会产生有利影响,如提高鱼苗存活率[13]、诱导雄鱼精液排放[14]、促进河豚分泌毒素[15]以及提高雄鱼精子寿命[16]等。有关电刺激对亲鱼繁殖的影响研究,仅Marriott[17]研究了电刺激对性成熟细磷大麻哈鱼(pinksalmon)繁殖的影响以及孙照林[18]研究了电捕草鱼(Ctenopharyngodonidellus)亲鱼的催产试验。而有关幼鱼阶段电刺激对其性腺发育及性成熟后繁殖的影响研究,目前未见报道。

1材料与方法
1.1试验材料
1.2试验方法
1.2.1电刺激方法与试验分组
试验仪器为实验室自制的电刺激仪。电刺激时控制水域电压75 V,电流280 mA,持续电刺激5 500 ms左右。该作用强度下,受试鱼休克昏迷后能在几分钟内苏醒。本研究所使用的电刺激方法参照吴弈锦等[16]的实验方法。电刺激时间为晚上20∶00。试验设置1个对照组,4个处理组。对照组(A组)不进行电刺激,处理组分别电刺激1次(B组)、电刺激3次(C组)、电刺激5次(D组)和连续电刺激(E组)。选取30日龄的幼鱼425尾(电刺激实验后,375尾用于性腺发育观察,50尾用于繁殖观察),平均每组85尾,并开始第一次电刺激,之后每隔5天电刺激1次,直至结束繁殖观察实验。从60日龄开始取材,每组15尾,90日龄开始第二次取材,之后每隔15天取材一次,直至135日龄(基本达性成熟)共需取5次。每次取材用游标卡尺测量体长、千分之一天平测量体重,并取性腺通过组织切片观察性腺发育情况。达性成熟后,每组分别选取雌雄鱼各5尾作为亲鱼,用于繁殖观察。
1.2.2性腺发育
性腺不易取出的(小于105日龄),断头去尾后用Bouin′s液固定,经脱水包埋、石蜡切片(厚度5 μm)、H.E染色后在显微镜(Nikon DXM1200)下拍照,观察性腺的发育情况。可取出性腺的个体(大于105日龄)直接取出性腺后用于组织切片观察(方法同上),并称量性腺重,去掉内脏团称量空壳重,计算性腺成熟系数。公式:成熟系数(GSI)=性腺重/空壳重×100%。性腺发育分期参照代丽[19]和晏正碧[20]的方法。
1.2.3繁殖观察
1.2.3.1雌鱼
雌鱼达性成熟后,每天晚上20∶00左右开始观察雌鱼的产卵情况,当观察到有雄鱼开始持续追逐雌鱼,并用头部顶撞雌鱼腹部等产卵迹象时,将雌鱼捞出与对照组雄鱼进行交配,采用挤压法进行干法授精获得受精卵。记录产卵周期和产卵量。产卵周期为每次产卵和前一次产卵的时间间隔,共持续记录1个月;产卵量为直接计数产出卵子的数量。随机选取10粒受精卵在Nikon SMZ1000解剖镜下观察拍照,并用Image-Pro Plus 6.0图像软件测量卵径。再随机选取50粒受精卵置于直径120 mm培养皿中,观察胚胎发育和死亡情况,每隔8 h观察1次,记录胚胎死亡数和出膜数,并及时清除死亡个体,计算受精率、孵化率和出膜时间。全部出膜后统计初孵仔鱼畸形数,计算初孵仔鱼畸形率。受精后每24 h换1/3曝气自来水。
1.2.3.2雄鱼
雄鱼达性成熟后,各组的雄鱼与对照组雌鱼进行交配。随机选取20粒胚胎置于培养皿中,观察胚胎发育和死亡情况,每隔8 h观察1次,记录胚胎死亡数和出膜数,并及时清除死亡个体,计算受精率、孵化率和出膜时间。全部出膜后统计初孵仔鱼畸形数,计算初孵仔鱼畸形率。受精后每24 h换1/3曝气自来水。
1.3数据分析
实验数据用EXCEL(2003)进行常规计算后,利用SPSS17.0统计分析软件进行单因素方差分析(One-way ANOVA)。所有统计值均以平均值±标准误(mean±SE)表示,P<0.05(*)表示差异显著,P<0.01(**)表示差异极显著。
2结果与分析
2.1生长
2.1.1雌鱼
60日龄,电刺激组雌鱼的体长和体重与对照组无显著差异;90日龄,电刺激1次组、电刺激3次组和电刺激5次组体长和体重的值均大于对照组,但仅电刺激3次组与对照组产生显著差异,连续电刺激组的值小于对照组,但无显著差异;105日龄,电刺激1次组、电刺激3次组和电刺激5次组体长和体重的值均大于对照组,且电刺激3次组与对照组产生极显著差异,电刺激5次组与对照组产生显著差异,而连续电刺激组的值小于对照组,但无显著差异;120日龄,电刺激1次组、电刺激3次组和电刺激5次组体长和体重的值均大于对照组,而连续电刺激组的值小于对照组,但均无显著差异;135日龄,电刺激1次组和电刺激5次组体长和体重的值大于对照组,电刺激3次组的值与对照组接近,但均无显著差异。而连续电刺激组的值小于对照组,且产生显著差异(图1、2)。


图1 幼鱼阶段电刺激对稀有 鲫雌鱼体长的影响

图2 幼鱼阶段电刺激对稀有 鲫雌鱼体重的影响
2.1.2雄鱼
60日龄,电刺激组雄鱼体长和体重的值均大于对照组,且电刺激1次组雄鱼的体重与对照组产生显著差异,电刺激3次组雄鱼的体长和体重与对照组产生显著差异,电刺激5次组和连续电刺激组雄鱼的体长和体重与对照组产生极显著差异;90日龄,电刺激1次组、电刺激3次组和电刺激5次组体长和体重的值均大于对照组,且电刺激1次组与对照组产生显著差异,而连续电刺激组的值与对照组接近;105日龄,电刺激1次组、电刺激3次组和电刺激5次组体长和体重的值均大于对照组,而连续电刺激组的值与对照组接近(图3、4)。

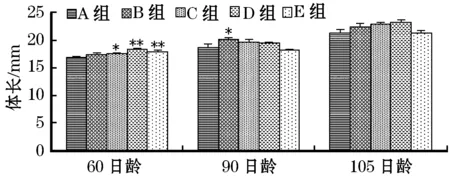
图3 幼鱼阶段电刺激对稀有 鲫雄鱼体长的影响
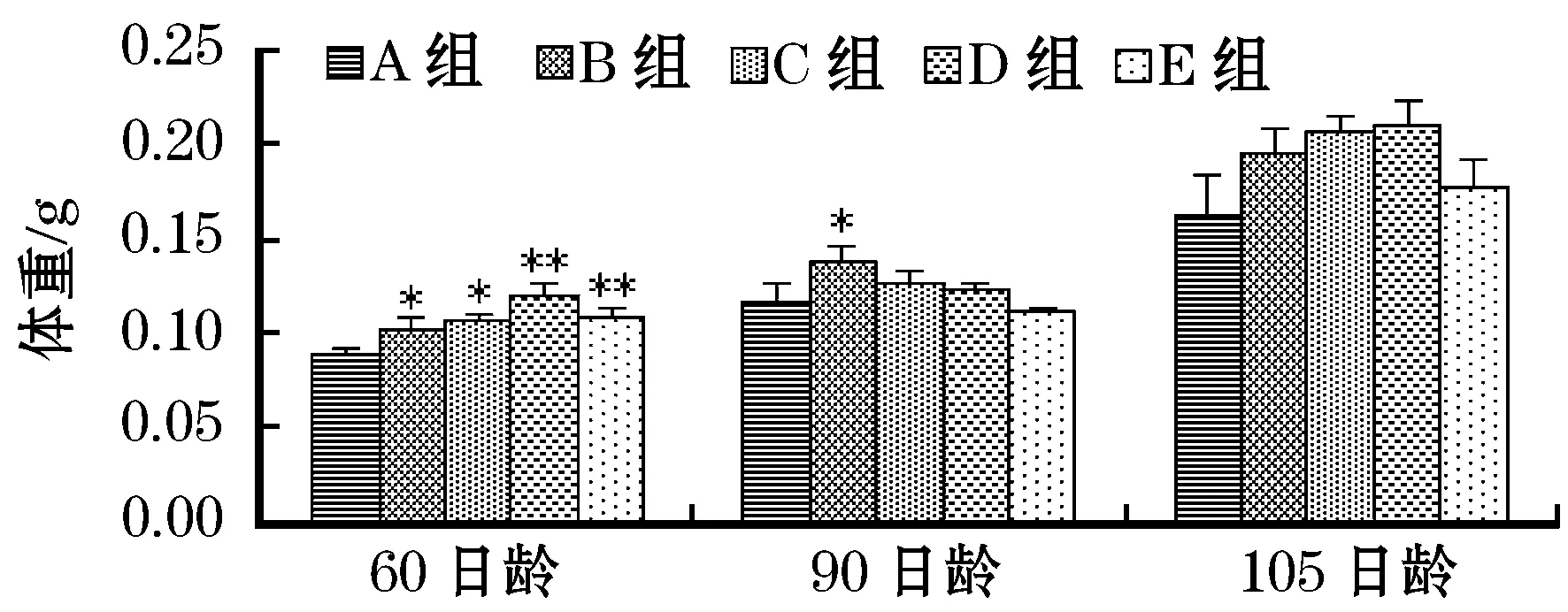
图4 幼鱼阶段电刺激对稀有 鲫雄鱼体重的影响
2.2性腺发育
2.2.1卵巢发育
60日龄和90日龄,各组雌鱼卵巢均处于Ⅱ期。
105日龄,对照组卵巢多数处于Ⅱ期,少量处于Ⅲ期。而电刺激1次组出现Ⅳ期卵巢,并且开始出现Ⅳ期晚期卵巢,Ⅳ时相末卵母细胞所占面积为10.4%。电刺激3次组和电刺激5次组也有Ⅳ期卵巢,但没有出现Ⅳ期晚期卵巢。连续电刺激组卵巢多数处于Ⅱ期,少量处于Ⅲ期。
120日龄,对照组开始出现Ⅳ期晚期卵巢,Ⅳ时相末卵母细胞所占面积为13.1%,另外还有处于Ⅱ期和Ⅲ期卵巢。电刺激1次组、电刺激3次组和电刺激5次组卵巢多数处于Ⅳ期晚期,Ⅳ时相末卵母细胞所占面积分别为46.9%、40.3%和21.8%,只有少量处于Ⅱ期或Ⅲ期。而连续电刺激组仍未出现Ⅳ期晚期卵巢,只有少量处于Ⅲ期,多数处于Ⅱ期。
135日龄,对照组卵巢只有少数处于Ⅳ期晚期,Ⅳ时相末卵母细胞所占面积为13.9%,多数处于Ⅲ期。电刺激1次组卵巢多数处于Ⅳ期晚期,Ⅳ时相末卵母细胞所占面积为51.5%,只有少量处于Ⅲ期。电刺激3次组卵巢全部处于Ⅳ期晚期,Ⅳ时相末卵母细胞所占面积为61.8%。电刺激5次组卵巢少量处于Ⅳ期晚期,Ⅳ时相末卵母细胞所占面积为34.4%,其余处于Ⅲ期和Ⅳ期。连续电刺激组仍未出现处于Ⅳ期晚期卵巢,只有少量处于Ⅳ期,多数处于Ⅱ期(表1)。

表1 幼鱼阶段电刺激对稀有 鲫雌鱼卵巢发育的影响
120日龄和135日龄,计算各组的成熟系数(GSI)发现,电刺激1次组、电刺激3次组和电刺激5次组的值均高于对照组,而连续电刺激组的值均低于对照组。且在120日龄,电刺激1次组和电刺激3次组与对照组产生显著差异,在135日龄,电刺激3次组与对照组产生显著差异。这与组织切片观察的结果相一致(图5)。
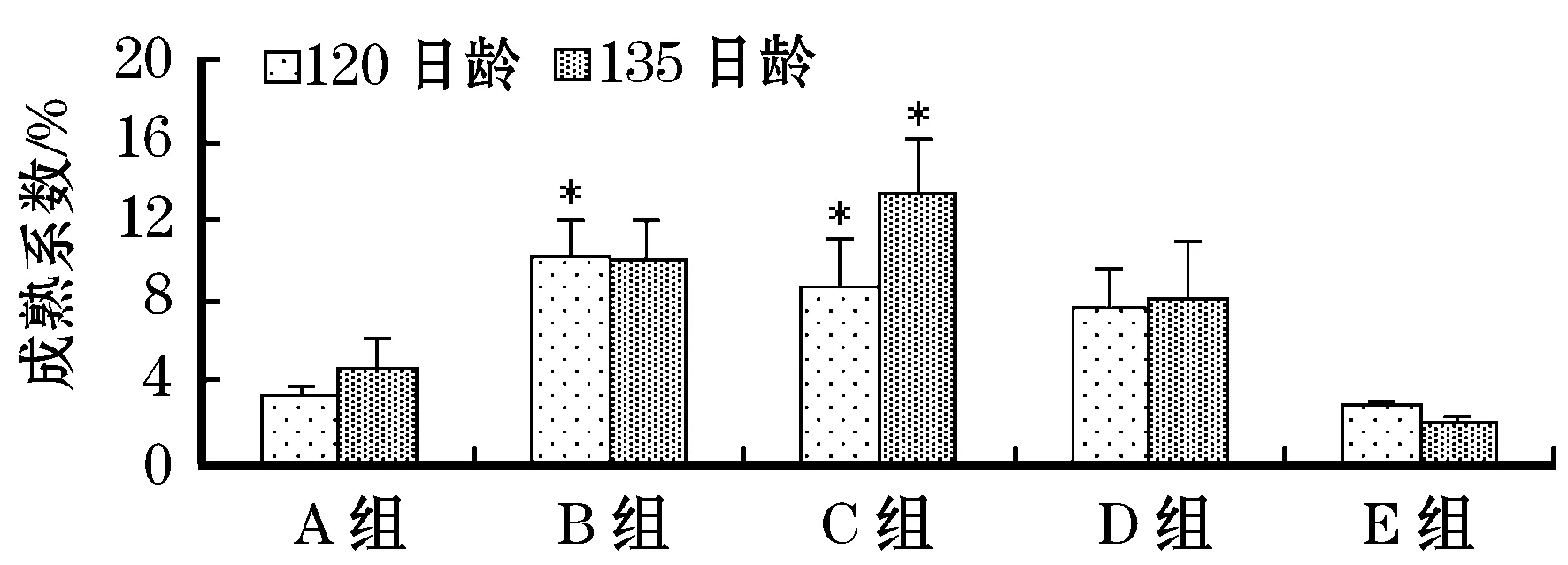
图5 幼鱼阶段电刺激对稀有 鲫雌鱼成熟系数的影响

2.2.2精巢发育
60日龄,各组精巢多数处于Ⅰ期,未见有Ⅴ期精巢出现。此时,电刺激5次组和连续电刺激组的电刺激次数相同,两者均开始出现Ⅳ期精巢,而其余各组精巢仅发育到Ⅱ期或Ⅲ期。
90日龄,对照组开始出现少量Ⅴ期精巢,成熟小叶腔所占面积为1.3%,一半处于Ⅰ期。电刺激1次组精巢一半处于Ⅴ期,成熟小叶腔所占面积为7.8%。电刺激3次组精巢少数处于Ⅴ期,成熟小叶腔所占面积为6.4%。电刺激5次组开始出现少量Ⅴ期精巢,成熟小叶腔所占面积为2.0%。连续电刺激组还未出现Ⅴ期精巢,仅发育到Ⅳ期。
105日龄,对照组精巢少数处于Ⅴ期,成熟小叶腔所占面积为10.9%,另外还有少数处于Ⅱ期和Ⅲ期。电刺激1次组、电刺激3次组和电刺激5次组精巢均多数处于Ⅴ期,成熟小叶腔所占面积分别为13.6%、27.5%和16.9%,少量处于Ⅳ期。连续电刺激组精巢少量处于Ⅴ期,成熟小叶腔所占面积为10.7%,多数处于Ⅳ期,少量处于Ⅲ期(表2)。


表2 幼鱼阶段电刺激对稀有 鲫雄鱼精巢发育的影响
2.3繁殖观察
2.3.1雌鱼
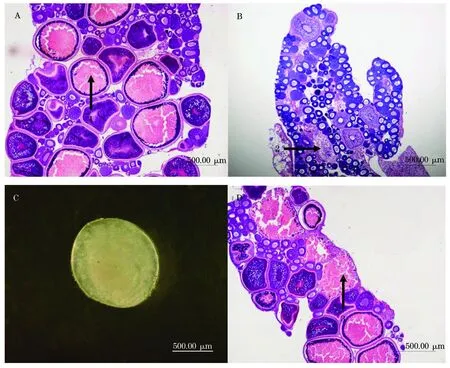
图6 电刺激对稀有 鲫卵巢的影响
(A:电刺激1次、3次和5次组雌鱼卵巢,箭头1示正常Ⅳ时相末卵母细胞;B:连续电刺激组不产卵雌鱼卵巢,箭头2示退化Ⅲ时相卵细胞;C:连续电刺激组雌鱼产出的卵异常;D:连续电刺激组雌鱼卵巢异常,箭头3示退化Ⅳ时相末卵母细胞)
2.3.2雄鱼

表3 幼鱼阶段电刺激对稀有 鲫雌鱼性成熟后繁殖的影响

表4 幼鱼阶段电刺激对稀有 鲫雄鱼性成熟后繁殖的影响
3讨论
3.1环境因子对鱼类生长的影响

3.2电刺激对鱼类性腺发育的影响

3.3电刺激对鱼类繁殖的影响

参考文献:
[1]许国晶,段登选,张金路,等.几个环境因子对鱼类生长发育影响的研究进展[J].山东师范大学学报(自然科学版),2014,29(1):147-150.
[2]胡应高.鱼类的应激反应[J].淡水渔业,2004,34(4):61-63.
[3]普罗塔索夫著.何大仁,俞文钊译.鱼类的行为[M].北京:科学出版社,1984:245.
[4]蔡厚才,池弘福,陈志远,等.鲤、鲫鱼对交流电刺激的反应特性[J].浙江水产学院学报,1993,12(4):271-277.
[5]平慧敏,吴永汉,刘琼.鱼在脉冲电刺激后产生昏迷反应试验的观察和分析[J].云南大学学报(自然科学版),1998,20(S1):27-28.
[6]柯福恩,曹正光,张启伦,等.几种淡水鱼类对水中交流电场强度反应的试验[J].淡水渔业,1982,12(5):25-28.
[7]Demski L S.Eye movements evoked by electrical stimulation of the brain in anesthetized fishes[J].Brain Behav Evolut,1975,11(2):109-129.
[8]Roques J A C,Abbink W,Chereau G,et al.Physiological and behavioral responses to an electrical stimulus in Mozambique tilapia (Oreochromismossambicus)[J].Fish Physiol Biochem,2012,38(6):1855.
[9]Stewart P A M.A study of the response of flatfish (Pleuronectidae) to electrical stimulation[J].J Conseil,1977,37(2):123-129.
[10]许传才,姜昭阳,陈勇.直流电场中鲤的行为特性及体长与电刺激阈值的关系[J].大连水产学院学报,2006,21(3):264-267.
[11]蔡厚才,吕炜泓,钱小荣,等.鲫鱼在强直流电场中的行为初探[J].浙江水产学院学报,1994,13(4):282-287.
[12]马师荟.电击对黄颡鱼机体影响的研究[J].河北渔业,2010,34(10):14-17.
[13]凌长明,植仲培,刘斌,等.周期性电击对罗非鱼鱼苗存活率的影响[J].湛江海洋大学学报,2004,24(4):67-68.
[14]Demski L S,Bauer D H,Gerald J W.Sperm release evoked by electrical stimulation of the fish brain:A functional-anatomical study[J].J Exp Zool,1975,191(2):215-231.
[15]Kodama M,Ogata T,Sato S.External secretion of tetrodotoxin from puffer fishes stimulated by electric shock[J].Mar Biol,1985,87(2):199-202.

[17]Marriott R A.Effects of electric shocking on fertility of mature pink salmon[J].Prog fish Cult,1973,35(4):191-194.
[18]孙照林.电捕草鱼亲鱼的催产试验[J].淡水渔业,1979,9(6):35.
[21]殷名称.鱼类生态学[M].北京:中国农业出版社,1995:38.
[22]王川,金丽,刘晓蕾,等.延迟首次投喂对胭脂鱼仔鱼生长、摄食及消化酶活性的影响[J].水产学报,2013,37(11):1706-1715.
[23]孙丽慧,王际英,丁立云,等.投喂频率对星斑川鲽幼鱼生长和体组成影响的初步研究[J].上海海洋大学学报,2010,19(2):190-195.
[24]季延滨,程民杰,孙学亮,等.不同投喂方式对革胡子鲶生长性能的影响[J].湖南农业科学,2014,53(2):385-388.
[25]李孝珠,常艳利,康清娟,等.温度对池沼公鱼仔鱼生长发育的影响[J].水生态学杂志,2011,32(2):96-99.
[26]胡发文,潘雷,高凤祥,等.温度和盐度变化对大泷六线鱼幼鱼存活与生长的影响[J].海洋科学,2012,36(7):44-48.
[27]黄宁宇,程起群,高露娇,等.流速、温度对西伯利亚鲟幼鱼生长的影响[J].水产学报,2007,31(1):31-37.
[28]郭文学,尹家胜,佟广香,等.养殖方式、光照强度对哲罗鱼稚鱼生长与存活的影响[J].海洋与湖沼,2014,46(2):265-273.
[29]李大鹏,庄平,严安生,等.光照、水流和养殖密度对史氏鲟稚鱼摄食、行为和生长的影响[J].水产学报,2004,28(1):54-61.
[30]李大鹏,庄平,王明学,等.史氏鲟稚鱼的趋光性及不同光照周期对其生长的影响[J].华中农业大学学报,2001,20(6):564-567.
[31]高露姣,陈立侨,宋兵.饥饿和补偿生长对史氏鲟幼鱼摄食、生长和体成分的影响[J].水产学报,2004,28(3):279-284.
[32]李秀明.运动训练对中华倒刺鳃幼鱼生长的影响[D].重庆:西南大学,2013.
[33]Pitt T K.Changes in abundance and certain biological characters of Grand Bank American plaice,Hippoglossoides plaslessoides[J].J fish res board Can,1975,32 (8):1383-1398.
[34]温海深,林浩然.环境因子对硬骨鱼类性腺发育成熟及其排卵和产卵的调控[J].应用生态学报,2001,12(1):151-155.
[35]林浩然.鱼类生理学[M].广州:中山大学出版社,2011:148.
[36]王吉桥.应激刺激对养殖鱼类繁殖的影响[J].北京水产,2002,19(2):12-14.
[37]翟中和,王喜忠,丁明孝.细胞生物学[M].北京:高等教育出版社,2007:455.
[38]刘义保,陈树德,陈家森.电磁场对细胞的作用[J].自然杂志,1999,21(2):88-91.
[39]Kazuo S,Yuzo K,Masahiko H.Direct and indirect effects of electrical stimulation on the motility of human sperm[J].Int J Urol,1999,6(4):196-199.
[40]Gaylor D C,Prakah-Asantea K,Leea R C.Significance of cell size and tissue structure in electrical trauma[J].J Theoret Biol,1988,133(2):223-237.
(责任编辑:张红林)
Effects of larval electrical stimulation on the gonadal development and reproduction of Gobiocypris rarus
CHEN Dong-ming,LIU Xiao-hong,HUANG Zi-hao,WANG Zhi-jian
(KeyLaboratoryofFreshwaterFishReproductionandDevelopment,MinistryofEducation/ChongqingKeyLaboratoryofAquaticScience/SchoolofLifeScience,SouthwestUniversity,Chongqing400715,China)
Abstract:After the artificial control of waterborne electrical stimulation (75v,280mA,5500ms) performed to one month old larvae,which made the fish to be shock or coma,and can be revived in a few minutes,we detected the later effects of electrical stimulation on the gonadal development and reproduction of Gobiocypris rarus,in order to provide basic data for the fishery department to evaluate the behavior of electric fishing.The results showed that electrical stimulation of once and electrical stimulation of three times and electrical stimulation of five times could promote the growth and gonadal development of larvae.The continuous electrical stimulation had no effect on male fish,but restrained the growth and gonadal development of female.Electrical stimulation of once and electrical stimulation of three times and electrical stimulation of five times performed to larvae had no effect on the reproduction of both male and female fish.The continuous electrical stimulation had no effect on the reproduction of male fish, but caused female un-spawned or laying of unfertilizable white eggs.The spawning period of spawnable femalefish was equally prolonged to 4.5 days,and the egg amount was equally decreased to 36,and the fertilization rate was equally reduced by 9.2%.After electrical stimulation of once and electrical stimulation of three times and electrical stimulation of five times to larvae,no effect was observed on the female ovary by histological method,while the continuous cyclical electrical stimulation injured the large egg cells of female ovary.No effect of larval stimulation on the structure of testis was observed.
Key words:electrical stimulation;gonadal development;growth;reproduction;Gobiocypris rarus
中图分类号:S917.45
文献标识码:A
文章编号:1000-6907-(2016)02-0020-09
作者简介:第一陈冬明(1989-),男,硕士研究生,专业方向为资源动物学。E-mail:18883251881@163.com通讯作者:王志坚。E-mail:wangzj1969@126.com
收稿日期:2015-04-14;
修订日期:2015-07-20
资助项目:公益性行业(农业)科研专项(201203086),重庆市科委重点实验室专项经费
