滇池金线鲃、西畴金线鲃及其杂交F1代抵抗小瓜虫与车轮虫能力的探究
2016-04-23赵婷怡潘晓赋陈小勇杨君兴
赵婷怡,潘晓赋,陈小勇,杨君兴
(1.中国科学院昆明动物研究所遗传资源与进化国家重点实验室,昆明 650223;
2.中国科学院研究生院,北京 100049))
滇池金线鲃、西畴金线鲃及其杂交F1代抵抗小瓜虫与车轮虫能力的探究
赵婷怡1,2,潘晓赋1,陈小勇1,杨君兴1
(1.中国科学院昆明动物研究所遗传资源与进化国家重点实验室,昆明650223;
2.中国科学院研究生院,北京100049))
摘要:用小瓜虫(Ichthyophthirius multifiliis)和车轮虫(Trichodina spp.)对滇池金线鲃(Sinocyclocheilus grahami)和西畴金线鲃(S.xichouensis)及其杂交F1代分别进行了两次人工感染实验。18月龄的杂交F1代、滇池金线鲃(Sinocyclocheilus grahami)和西畴金线鲃(S.xichouensis)感染小瓜虫后平均死亡率分别为(50.00±11)%、(56.70±23)%、(80.0±18)%。经方差检验杂交F1代死亡率显著低于父本西畴金线鲃。6月龄杂交F1代、滇池金线鲃、西畴金线鲃感染车轮虫后的平均死亡率分别为(40.56±13)%、(56.11±5)%、(42.78±13)%。经方差检验杂交F1代死亡率显著低于母本滇池金线鲃。在感染小瓜虫和车轮虫后,三种鱼的死亡量均呈现激增后又显著回落的趋势,死亡高峰在第4天至第7天。本次感染实验的小瓜虫和车轮虫主要分布于病鱼体表:躯干分布最多57%~79%,其次为鳍12%~28%,头部分布较少4%~15%。与本研究中车轮虫几乎于鳃丝无分布(0%~3%)不同,有大约10%~20%的小瓜虫分布于鳃丝上。
关键词:杂交;滇池金线鲃(Sinocyclocheilus grahami);西畴金线鲃(S.xichouensis);小瓜虫(Ichthyophthirius multifiliis);车轮虫(Trichodina spp.)
滇池金线鲃(Sinocyclocheilusgrahami)隶属于鲤形目(Cypriniformes)鲤科(Cyprinidae)鲃亚科(Barbinae)金线鲃属(Sinocyclocheilus),是滇池流域的特有种[1],国家II级保护动物,且被列入《中国濒危动物红皮书(鱼类)》[2]。西畴金线鲃(S.xichouensis)是新近描述的第一种采自红河水系的金线鲃属鱼类新种[3]。以往对金线鲃属鱼类的研究主要以分类学为主,向传统分类和系统进化两个方向发展[4]。近年来,对金线鲃属鱼类的研究逐渐扩大到保护生物学、生态学、生理学以及水产养殖技术研究等方面。
小瓜虫(Ichthyophthiriusmultifiliis)是一种主要寄生在鱼类的皮肤、鳍、鳃、头、口腔及眼等部位的寄生虫,治疗困难,可导致鱼类67.9%~80.2%的死亡率[5],对渔业养殖有很大危害,所以一直是国内外鱼病专家研究的热点。目前研究内容集中于小瓜虫形态分类、病原学、病理学、免疫学以及防治方法等[6-7],研究对象多集中于常见经济鱼类或观赏鱼类[8]。车轮虫(Trichodinaspp.)是一类常见寄生/共栖生缘毛类纤毛虫原生动物,寄生在多种淡水水生动物鳃和皮肤上,主要危害苗种,严重感染时可引起苗种47.3%~70.8%的死亡率[9]。对车轮虫的研究国内外也有很多报道,研究内容多为车轮虫的形态分类[10-12]或是车轮虫对经济鱼类的感染及危害[9]。
目前,虽然对金线鲃属的研究已从分类学逐步扩大,但是在人工养殖环境下对常见寄生虫病抗病力的基础研究尚未见报道。且专门利用小瓜虫和车轮虫人工感染经驯化的云南土著鱼类,并对其抗病力进行比较的研究也未见报道,所以本研究选用小瓜虫和车轮虫这两种养殖鱼塘常见鱼类寄生虫来人工感染滇池金线鲃和西畴金线鲃及其杂交F1代,以探究三者在小水体养殖条件下的抗病能力。
1材料与方法
1.1实验鱼的准备
滇池金线鲃母本和西畴金线鲃父本及其杂交F1代系在中国科学院昆明动物研究所珍稀鱼类保育研究基地养殖获得。小瓜虫感染实验用鱼为18月龄,车轮虫感染实验用鱼为6月龄,均健康、体型正常,无小瓜虫、车轮虫病史。实验前均分别暂养于水族缸里72 h,使其适应缸养环境。
为了能在同一个实验缸里将体型和花色上相似的18月龄的杂交F1代,滇池金线鲃和西畴金线鲃区分开,实验前使用Visible Implant Elastomer Color (Northwest Marine Technology 公司生产)对三者进行标记:杂交F1为代右侧眼睛下方,滇池金线鲃为左侧眼睛下方,西畴金线鲃为头顶。
1.2实验方法
小瓜虫的感染方法:在测量并记录了实验个体的全长(Total Length,TL)与体重(Weight,W)后,参考文献[13]将病鱼和健康鱼同缸养殖进行小瓜虫感染实验的方法,把自然感染小瓜虫的病鱼(滇池金线鲃,TL:(74.07±6.02) mm,W:(4.4±0.82) g)与18月龄健康实验鱼(杂交F1代、滇池金线鲃和西畴金线鲃)共同养殖于规格为60 cm×60 cm×40 cm水族缸中,待感染30 h后将病鱼捞出开始观察并记录数据。实验组共三个缸,每个水族缸包含杂交F1代(TL:(83.55±1.69) mm,W:(6.51±0.36) g)、滇池金线鲃(TL:(84.06±3.41) mm,W:(6.98±0.83) g)、西畴金线鲃(TL:(81.23±4.51) mm,W:(5.76±0.82) g)各5条。空白对照一个缸,含有健康的未感染小瓜虫的杂交F1代(TL:(80.53±1.39) mm,W:(5.96±0.26) g),滇池金线鲃(TL:(83.32±4.51) mm,W:(6.93±0.62) g)和西畴金线鲃(TL:(82.47±1.65) mm,W:(6.62±0.26) g) 各5条。
车轮虫的获得及感染方法:在研究基地发生车轮虫病的鱼塘里采集到携带有车轮虫的病鱼若干(滇池金线鲃,TL:(72.8±2.68) mm,W:(2.76±0.49) g),刮取其携带车轮虫的体液放入事先准备好的三个容积为2 L的大烧杯中,于显微镜下检验车轮虫密度大约为4.01×105个/L,随后分别放入6月龄杂交F1代(TL:(29.93±0.88) mm,W:(0.32±0.04) g)、滇池金线鲃(TL:(29.15±1.05) mm,W:(0.24±0.12) g)和西畴金线鲃(TL:(29.67±1.34) mm,W:(0.25±0.08) g)幼鱼进行感染,感染时间为1 h。然后将三种幼鱼连同大烧杯中的水一同放入9个规格为25 cm×40 cm×25 cm的水族缸里。每种鱼设三个平行实验,每个实验缸含有30条幼鱼。在另外三个同规格的水族缸里分别放入30条健康的杂交F1代(TL:(30.33±0.58) mm,W:(0.34±0.03) g),滇池金线鲃(TL:(28.75±1.25) mm,W:(0.23±0.02) g)和西畴金线鲃(TL:(29.34±1.44) mm,W:(0.24±0.03) g)幼鱼作为空白对照。
小瓜虫感染实验和车轮虫感染实验均以同样的方法进行了两次。实验期间使用增氧机泵氧,经YSIDO200溶解氧测量仪(美国维赛仪器公司)检测平均溶氧量为(6.85±0.37) mg/L,水温控制在20.3~21.5 ℃。
1.3数据收集
记录每天感染小瓜虫和车轮虫的实验个体的死亡数量。使用解剖针刮取躯干体表,头部(包括眼、鼻、口等部位)的体液,并使用手术剪剪取鱼鳍(尾鳍、背鳍、胸鳍、臀鳍、腹鳍)和鳃丝制作压片在Stemi2000-C显微镜下计数小瓜虫数量,并拍照(物镜5×目镜10×),在OlympusCX21显微镜下观察计数车轮虫数量(物镜4×目镜10×)并拍照(物镜100×目镜10×)。
1.4数据处理
实验数据使用SPSS 13.0统计软件进行处理分析,使用Sigma Plot 10.0作图。
2结果
2.1感染小瓜虫和车轮虫后病鱼的死亡率
杂交F1代感染小瓜虫后死亡率(Mortality Rate,MR)最低,西畴金线鲃死亡率最高(表1)。经方差分析,杂交F1代与滇池金线鲃的死亡率差异不显著(P>0.05),与西畴金线鲃的死亡率相比差异显著(P<0.05)。滇池金线鲃的死亡率与西畴金线鲃的死亡率相比差异显著(P<0.05)。车轮虫感染实验中杂交F1代的死亡率最低,滇池金线鲃死亡率最高。经方差分析,杂交F1代与西畴金线鲃的死亡率差异不显著(P>0.05),与滇池金线鲃的死亡率相比差异显著(P<0.05)。滇池金线鲃的死亡率与西畴金线鲃的死亡率相比差异显著(P<0.05)。

表1 感染小瓜虫和车轮虫的杂交F1代,滇池金线鲃,西畴金线鲃的死亡率
注:表中同列数字右上角具有相同字母的代表方差检验差异不显著(P>0.05),具有不同字母的表示差异显著(P<0.05)
在小瓜虫染病实验中观察到杂交F1代,滇池金线鲃以及西畴金线鲃不同的染病速度:西畴金线鲃2 d内出现明显病症(体表粘液增多,游动困难,时常浮头等),第四天即达到死亡高峰期,杂交F1代和滇池金线鲃第四天出现明显病症,约第七天才达到死亡高峰期(图1a,b)。再加上经方差检验杂交F1代的死亡率显著低于西畴金线鲃,综合不同的染病速率和死亡率可以说18月龄的杂交F1代对小瓜虫的耐受性明显优于其父本。在感染车轮虫的实验中则可看出6月龄的杂交F1代对车轮虫的耐受力则明显优于其母本。
2.2感染小瓜虫和车轮虫后病鱼的死亡规律
两次实验结果均表明(图1)在感染小瓜虫和车轮虫后,个体死亡量均呈现激增后又明显回落的趋势。个体死亡量于感染小瓜虫后第五到第七天达到高峰,西畴金线鲃的死亡高峰期稍提前于杂交F1代和滇池金线鲃(图1a,b)。感染车轮虫的个体死亡量在感染后第四天达到高峰(图1c,d)。
2.3小瓜虫和车轮虫在鱼体的分布
如图2(a)、(b)可以看到病鱼体表粘液以及鳃丝上都已经有成熟小瓜虫存在,图2(c)为从病鱼体表采集到的车轮虫。如图3(a)、(b)所示,小瓜虫和车轮虫多分布于三种鱼类的体表,分布情况大致相似的部位是:分布数量最多的躯干(57%~79%),其次为鳍(12%~28%),头部分布较少(4%~15%)。二者于鳃丝的分布差异较大,车轮虫在三种鱼鳃丝的分布百分比为0%~3%,实际上在显微镜下只有极少数个体的鳃丝上可以观察到1~3个车轮虫分布。而小瓜虫于鳃丝的分布比例则达到10%~20%。
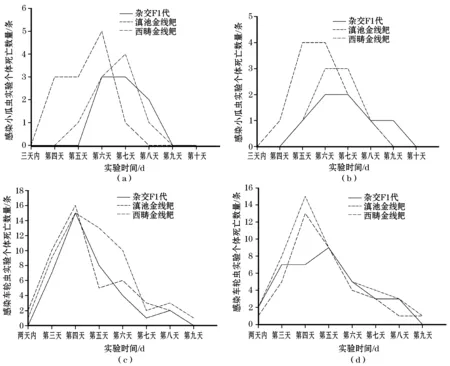
图1 感染小瓜虫和车轮虫后杂交F1代,滇池金线鲃,西畴金线鲃的死亡趋势
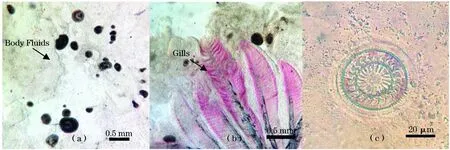
图2 显微镜下的小瓜虫和车轮虫
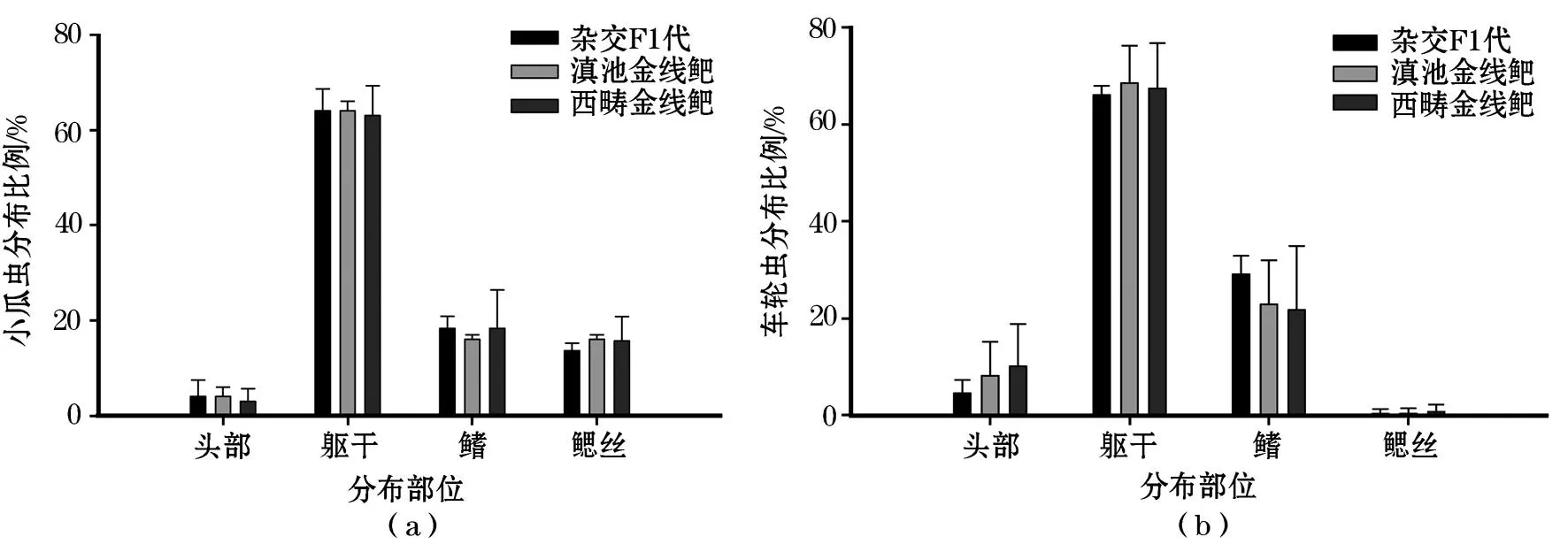
图3 车轮虫和小瓜虫在鱼体的分布
3讨论
3.1小瓜虫寄生部位及对鱼类的危害
本研究与倪达书等[13]对小瓜虫寄生部位的研究结果相似,小瓜虫多寄生于鱼类体表以及鳍条等运动较多的部位;一部分寄生在鳃上的虫体,多数靠近出鳃静脉一边的组织中,这可能与小瓜虫的好氧习性有关[13]。寄生在鳃丝上的小瓜虫对鱼类的呼吸造成严重的阻碍,是造成鱼类死亡率较高的原因之一。
小瓜虫病是水产养殖上的一大顽症,水温15~25 ℃时,是小瓜虫流行的高峰期,因为该水温区间最适宜小瓜虫繁殖。本研究中体长范围为8~9 cm的杂交F1代、滇池金线鲃和西畴金线鲃的死亡率都较高,但是其中杂交F1代和滇池金线鲃的死亡率低于鲑鱼(SalmoSalar)感染小瓜虫后的死亡率(平均60%~70%)[14]。滇池金线鲃、西畴金线鲃及其杂交F1代死亡率均低于体长为7~10 cm感染小瓜虫的革胡子鲇(Clariasgariepinus)在两到三天内80%~90%的死亡率[8]。另据报道小瓜虫对乌鳢(体长7~10 cm)的感染率只有30%~40%,并且当感染率达到100%时也只有少数个体死亡[15]。而小瓜虫对草鱼(Ctenopharyngodonidellus)(体长10.4~12.8 cm)感染率仅为3%[16]。革胡子鲇体表光滑无鳞,鲑鱼、乌鳢和杂交F1代,滇池金线鲃、西畴金线鲃体表均具有细小的鳞片(侧线鳞数60以上),而草鱼则具有较大的鳞片(侧线鳞数39~44)[1],可见鳞片对小瓜虫起到了一定抵御作用,光滑无鳞或者鳞片细小的鱼类更易被小瓜虫侵袭,死亡率也较高。另外杂交F1代(侧线鳞数58~62)死亡率低于滇池金线鲃(侧线鳞数61~69)[1]并显著低于西畴金线鲃(侧线鳞数74~88)[3],也支持这一结论。
3.2车轮虫寄生部位及对鱼类的危害
车轮虫种类繁多,形态各异,生活习性以及寄生部位因种而异。本研究观察到的车轮虫主要分布于鱼类体表和鳍条,鳃丝上几乎未见分布,这与Obiekezie等[17]研究的多寄生于寄主的鳃上,鲜少在鳍条上和体表分布的车轮虫(Trichodinamaritinkae)很不相同。扇贝外寄生车轮虫(Trichodinajadranica)在鳗鱼身上的分布以皮肤上居多,鱼鳍上次之[18],这个与本研究观察到的相似。但是在鳗鱼的鳃上同时发现有占10%左右的分布,这说明扇贝外寄生车轮虫既可寄生体表也可侵袭鳃丝。据国内的研究报道,侵袭鳃瓣的有卵形车轮虫、微小车轮虫、球形车轮虫及眉溪小车轮虫等,主要在皮肤寄生的有显著车轮虫、粗棘杜氏车轮虫、中华杜氏车轮虫[19]。至于车轮虫繁多的种类和形态影响其生活习性以及寄生部位的机制是什么,有待在今后的研究中进一步考证。
车轮虫是水产养殖中的一大疾患,需要特别关注并加以防范。在养殖场的仔稚鱼很容易受到车轮虫的侵袭[17,20],而且人工孵化的仔稚鱼比起野外捕获后又放养到鱼池养殖的仔稚鱼更容易感染车轮虫,死亡率也更高[21]。这与池塘管理不善致使幼鱼营养不良或者野外捕获的幼鱼入塘后产生的应激反应等因素而导致仔稚鱼抵抗力下降,车轮虫更容易侵袭仔稚鱼鳃丝有关[18]。另外仅仅寄生于体表的车轮虫对幼鱼危害也较大,遭到主要寄生在体表皮肤上的显著车轮虫侵袭的草鱼、鲮(Cirrhinamolitorella)、鲢、鳙的夏花鱼种死亡率可达到70%左右[9]。在一般情况下,鱼体表上寄生个别车轮虫不会导致鱼死亡,但是一旦有大量车轮虫侵袭鱼体时,就有可能造成较大的死亡率[22],这是因为车轮虫侵袭幼鱼后,幼鱼抵抗力下降,容易遭受外界环境压力的二次伤害。车轮虫的侵袭不仅使幼鱼皮肤受到刺激后分泌大量粘液影响其活动,还会造成体表皮肤组织损伤;车轮虫侵入鱼鳃,造成鱼鳃分泌大量粘液,影响其呼吸对其发育生长造成不利,这些都更加容易使鱼体损伤部位受到细菌和霉菌感染而增加其死亡率[23]。在受到大量车轮虫侵袭的线鳢(Ophicephalusstriatus)的幼鱼中(全长3.5 cm左右)流行性溃疡综合征(Epizootic Ulcerative Syndrome,EUS)更容易传播和感染,且导致死亡率大幅度增加[24]。不仅如此,幼鱼在受到车轮虫侵扰后如果还存在其他如养殖过程中不当移动、装卸、养殖密度过大、水里氨含量较高、溶氧量较低、幼鱼营养不良等不利因素均会造成较高死亡率[22]。所以对仔稚鱼的危害程度不仅和车轮虫造成的直接伤害有关(如侵袭鳃丝阻碍鱼类正常呼吸,大量车轮虫不停运动对幼鱼体表造成损伤等),还和车轮虫对鱼类造成的间接伤害有很大关系。而本研究中受到相同车轮虫侵袭的幼鱼死亡率却不相同,这可能是因为幼鱼自身对外界环境的二次伤害的抵抗力不同的反应。杂交F1代的死亡率均低于母本和父本,并显著低于母本滇池金线鲃的死亡率,说明杂交F1代在受到车轮虫侵扰后有较好的耐受力。
3.3小瓜虫和车轮虫生活周期与病鱼死亡规律的关系
小瓜虫从形成胞囊开始至幼虫破囊而出,一般须经过23~25 h,幼虫破囊24 h内感染率最高[13];车轮虫无性繁殖以24 h为一周期[25]。从本研究结果来看,感染小瓜虫后最初3 d内没有鱼死亡,感染车轮虫后最初2 d内只有两到三条幼鱼死亡,说明这段时间内还没有大量虫体侵袭寄主,虫体处于繁殖阶段,当繁殖达到一定数量的虫体侵袭寄主后夺取宿主营养逐渐发育至成熟,到第4天左右寄主死亡量才达到高峰,这与小瓜虫和车轮虫的生活周期相吻合。之后死亡量逐渐回落,这可能是因为寄主大量死亡后,寄主资源缺乏,寄生虫之间竞争增大,虫体开始死亡,危害也逐渐减少。与池塘养殖的情况相似,小瓜虫和车轮虫常在仔稚鱼下塘后一周内爆发式的发生,对养殖鱼类造成较大危害,但不同的是,在大塘养殖中死亡量高峰期不止一两天,特别是养殖密度过大时,所以在鱼苗下塘前用硫酸铜或生石灰对池塘进行彻底的消毒处理尤显重要。
参考文献:
[1]禇新洛,陈银瑞.云南鱼类志:上册[M].北京:科学出版社,1989:169-176.
[2]乐佩奇,陈宜瑜.中国濒危动物红皮书(鱼类)[M].北京:科学出版社,1998:104-105.
[3]潘晓赋,李列,杨君兴,等.云南红河水系金线鲃属鱼类一新种—西畴金线鲃[J].动物学研究,2013,23(2):149-154.
[4]赵亚辉,张春光.中国特有金线鲤属鱼类研究的回顾与展望(鲤形目鲤科)[J].动物分类学报,2006,31(4):769-777.
[5]夏艳洁,黄权,赵文,等.小瓜虫病发生与越冬池水质、底质关系的探讨[J].吉林农业大学学报,1993,15(2):71-74.
[6]邓永强,汪开毓,黄小丽.鱼类小瓜虫病的研究进展[J].大连水产学院学报,2005,20(2):149-153.
[7]黄琪琰.中国水产动物疾病学研究进展[J].水产学报,1996,20(1):52-57.
[8]庞显炳.淡水名优鱼小瓜虫病病因分析及防治探讨[J].科学养鱼,2000,26(9):17-18.
[9]英鸿.车轮虫的流行及其防治方法[J].动物学杂志,1964,7(1):32-35.
[10]李海波.四川宜宾地区几种经济鱼类外寄生车轮虫研究[D].重庆:重庆师范大学,2012.
[11]韩小燕.四川岷江流域中段常见经济鱼类外寄生车轮虫的研究[D].重庆:重庆师范大学,2012.
[12]于莎莎.浙江宁波地区部分海、淡水经济鱼类外寄生车轮虫的研究[D].重庆:重庆师范大学,2012.
[13]倪达书,李连祥.多子小瓜虫的形态生活史及其防治方法和一新种的描述[J].水生生物学集刊,1960,6(2):197-225.
[14]Valtonen E T,Keränen A L.Ichthyophthiriasis of Atlantic salmon,Salmosalar[J].J Fish Dis,1981,4(5):405-411.
[15]钱龙,艾涛,谢恒修.乌鳢苗小瓜虫病治疗方法[J].淡水渔业,1999,29(12):28-29.
[16]陈啓鎏.青、鲩、鳙、鲢等家鱼寄生原生动物的研究I.寄生鲩鱼的原生动物[J].水生生物学集刊,1955,1(2):123-164.
[17]Obiekezie A,Ekanem D.Experimental infection ofHeterobranchuslongijilis(Teleostei,Clariidae) withTrichodinamaritinkae(Ciliophora,Peritrichida)[J].Aquat Living Resour,1995,8(4):439-443.
[18]Hans C K M,Buchmann K,Mellergaard S.Trichodinasp.(Ciliophora:Peritrichida) in eelAnguillaanguillainrecirculation systems in Denmark:host-parasite relations[J].Aquaculture,2000.186(3):221-231.
[19]张剑英,邱兆祉,丁雪娟.鱼类寄生虫与寄生虫病[M].北京:科学出版社,1999:100-101.
[20]倪达书,汪建国.草鱼生物学与疾病[M].北京:科学出版社,1999:194-196.
[21]Khan R A.Disease outbreaks and mass mortality in cultured Atlantic cod,GadusmorhuaL,associated withTrichodinamurmanica(Ciliophora)[J].J Fish Dis,2004,27(3):181-184.
[22]Mohamed A E H H.Trichodiniasisin Farmed FreshwaterTilapiain Eastern Saudi Arabia[J].J King Abdulaziz Univ:Mar Sci,1999,10(1):157-168.
[23]Evans J J,Klesius P H,Pasnik D J,et al.Influence of naturalTrichodinasp.parasitism on experimentalStreptococcusiniaeorStreptococcusagalactiaeinfection and survival of young channel catfishIctaluruspunctatus(Rafinesque)[J].Aquacult Res,2007,38(6):664-667.
[24]Subasinghe R P.Effects of controlled infections ofTrichodinasp.on transmission of epizootic ulcerative syndrome (EUS) to naive snakehead,OphicephalusstriatusBloch[J].J Fish Dis,1993,16(2):161-164.
[25]冯淑娟.显著车轮虫无性繁殖生物学研究[J].水生生物学报,1985,30(4):331-342.
(责任编辑:张潇峮)
Resistibility of Sinocyclocheilus grahami,S.xichouensis and their hybrid F1 to Ichthyophthirius multifiliis and Trichodina spp.
ZHAO Ting-yi1,2,PAN Xiao-fu1,CHEN Xiao-yong1,YANG Jun-xing1
(1.StateKeyLaboratoryofGeneticResourcesandEvolution,KunmingInstituteofZoology,ChineseAcademyofSciences,Kunming650223China;2.UniversityofChineseAcademyofSciences,Beijing100049,China)
Abstract:Sinocyclocheilus grahami, S.xichouensis and their hybrid F1 (S.grahami ♀×S.xichouensis♂) were infected twice by Ichthyophthirius multifiliis and Trichodina spp.artificially to conduct a investigation of their resistibility.The mean mortality rate of one and half a year′s hybrid F1, S.grahami and S.xichouensis which infected by I.multifiliis was (50.00±11)%,(56.70±23)%,(80.0±18)% respectively.The mortality rate of hybrid F1 was significantly lower than that of S.xichouensis by analysis of variance (P<0.05),it showed that the resistibility of hybrid F1 was obviously higher than its male parent.The mean mortality rate of half of a year′s hybrid F1, S.grahami and S.xichouensis which infected by Trichodina spp.was (40.56±13)%,(56.11±05)%,(42.78±13)% respectively.As a result of analysis of variance, mortality rate of hybrid F1 was significantly lower than that of S.grahami ,it showed that resistibility of hybrid F1 was higher than its female parent apparently.Hybrid F1, S.grahami and S.xichouensis showed the similar tendency in mortality,it rose significantly in the first 3 days and reached the top during the 4(th) to 7(th) day,and then had a gradual fall,finally it dropped to 0. Trichodina spp. which was used to infect fish in this experiment appear mainly on skin of body surface:there are about 57%~79% on trunk,12%~28% on fins and fewer on head 4%~15%.There are 10%~20% I.multifiliis which was found on gills,different with I.multifiliis there are rarely Trichodina spp.be found on gills in this research 0%~3%.
Key words:hyprid;Sinocyclocheilus grahami; S.xichouensis; Ichthyophthirius multifiliis; Trichodina spp.
中图分类号:S941.5
文献标识码:A
文章编号:1000-6907-(2016)02-0033-07
作者简介:第一赵婷怡(1988-),女,硕士研究生,专业方向为湿地生物的进化与保护。E-mail:ginsheery@126.com.通讯作者:陈小勇。E-mail:chenxy@mail.kiz.ac.cn;杨君兴。E-mail:yangjx@mail.kiz.ac.cn
收稿日期:2014-05-14;
修订日期:2015-12-10
资助项目:中国科学院昆明动物研究所“一三五”重大专项;云南省应用基础研究面上项目(2012FB183);中国科学院西部之光(292006312D11033);云南省社会发展科技计划(2012CA014)
