铜掺杂聚L-赖氨酸膜修饰电极的制备及其用于橙汁饮品中抗坏血酸的测定
2016-04-23胡文娜武佳佳
胡文娜,武佳佳
(1.蚌埠学院 应用化学与环境工程系,安徽 蚌埠 233000;
2.蚌埠学院 化工应用技术开发研究所,安徽 蚌埠 233000)
铜掺杂聚L-赖氨酸膜修饰电极的制备及其用于橙汁饮品中抗坏血酸的测定
胡文娜1,2,武佳佳1
(1.蚌埠学院应用化学与环境工程系,安徽蚌埠233000;
2.蚌埠学院化工应用技术开发研究所,安徽蚌埠233000)
摘要:利用循环伏安法制备铜掺杂聚L-赖氨酸修饰玻碳电极,并对抗坏血酸的电化学行为进行研究。建立用循环伏安法测定抗坏血酸的新方法。在pH=2.5的磷酸盐缓冲溶液中,扫描速率为180 mV/s,抗坏血酸在修饰电极上产生一灵敏的氧化峰,响应峰电位为0.364 V,抗坏血酸的浓度峰电流在8.0×10(-5)~8.0×10(-3) mol/L的范围内有良好的线性关系,检出限为8.0×10(-7)mol/L。对橙汁饮品进行测定,结果满意。
关键词:L-赖氨酸;循环伏安法;修饰电极;铜掺杂;抗坏血酸
抗坏血酸即维生素C(vitamin C),是一种水溶性维生素,其存在着双烯醇结构,具有一定的酸性并且还原性较强,容易被氧化转变成脱氢抗坏血酸(DAA)[1]。抗坏血酸是维生素C在人体内的活性形式,是结缔组织,人体骨骼、血管、韧带等的重要组成物质,维护了人体正常机能。是人体和少数动物不能自身合成的维生素,只能从外界摄取。新鲜水果和蔬菜中含有极其丰富的维生素C[2],尤其是橘子、番茄、橙子和猕猴桃等含量最丰富。全球维生素的需求量大,现在市场上维生素C产品种类众多,品质参差不齐,含量未知。因此能够快速、便捷、灵敏地检测样品中的抗坏血酸含量,在日常生活、保健和医药方面的应用具有重要意义。
对于抗坏血酸的测定,国内外已有很多研究。常见的方法有分光光度法[3]、碘量法[4]和电化学分析法等[5-7]。其中电分析法因操作便捷等优点被广泛使用,但有些方法的灵敏度依旧较低。为了让修饰电极能有更高的灵敏度,将银、铂等贵金属掺杂在修饰膜中,可使灵敏度明显提高。但因在某些条件下掺杂过多的银导致检测的灵敏度不足,银峰产生干扰且银、铂等价格高等因素,所以研究廉价且电化学视窗宽以及具有催化活性的金属掺杂具有重要意义。本文使用的是铜这种常见、来源广的金属,其具有导电性好,稳定性好等特点。采用循环伏安法在玻碳电极的表面上聚合制备得到了铜掺杂聚L-赖氨酸修饰电极,详细研究了抗坏血酸在该修饰电极上的电催化氧化,并优化了测定条件,建立了测定抗坏血酸的新方法。该方法操作简单,灵敏度高,重现性好,用于橙汁饮品中抗坏血酸的测定,结果准确,效果满意。
1材料与方法
1.1实验仪器及试剂
CHI660E电化学工作站,上海辰华仪器有限公司;pH计,雷磁,PHS-3C,上海今迈仪器仪表有限公司;三电极系统:玻碳电极(GCE)或修饰电极为工作电极,饱和甘汞电极为参比电极,铂丝为对电极的预处理:先用湿润的金相砂纸将修饰电极(Φ=3.0 mm)磨光,再用粒度为0.05 μm的Al2O3悬浮液抛光成镜面,依次用HNO3(1+1),无水乙醇与水1 ∶1,用二次水清洗,晾干,待用。
抗坏血酸(AA):1.0×10-2mol/L,避光放置,需要时稀释至所需浓度使用。聚L-赖氨酸:1.0×10-2mol/L,硝酸:4.0mol/L,硝酸钾:1.0mol/L,硝酸铜:1.0×10-2mol/L,磷酸缓冲溶液(PBS):pH 2.5~pH 11.0,用0.1 mol/L磷酸溶液、磷酸二氢钠溶液、磷酸氢二钠溶液、磷酸钠溶液配制,在pH计上校准。
1.2修饰电极的制备
电极进行预处理后,在含有0.05 mol/L Cu(NO3)2、0.10mol/L KNO3、5.0×10-4mol/L L-赖氨酸、0.16 mol/L HNO3的聚合液中,以玻碳电极为工作电极,饱和甘汞电极为参比电极,铂丝电极为对电极,静置2 s,在2.5~0.9 V电位范围内,以80 mV/s的扫描速率扫描12周,即制得铜掺杂聚L-赖氨酸修饰电极(Cu-PLL/GCE),取出用二次水清洗,晾干,备用。
1.3抗坏血酸的测定
移取一定量的AA溶液,用PBS(pH 2.5)稀释。以Cu-PLL/GCE为工作电极,饱和甘汞电极为参比电极,铂丝电极为对电极,静置2 s,在电位0~0.9 V内,扫描速度180 mV/s扫描,记录循环伏安曲线(CV图)及峰电流和峰电位。在扫描结束后,用亚沸水清洗,滤纸吸干,可进行下次测定。
2结果与分析
2.1铜掺杂聚L-赖氨酸修饰电极的聚合循环图
图1是铜和L-赖氨酸在最佳修饰条件下聚合的循环伏安曲线图。图中可看出,在0.2 V左右出现一明显氧化峰,这可能是铜峰[8],在0.9 V和-0.5 V左右,出现了较宽的赖氨酸氧化峰和还原峰[9]。随着扫描周次的增加,响应峰电位不变,响应峰电流缓慢增大,增大的幅度随着周次的增加而越来越小,是因为随着修饰过程的进行,电极表面的聚合物薄膜渐趋向完整,聚合、沉积速度变慢。

图1 铜和L-赖氨酸修饰过程的循环伏安曲线
2.2抗坏血酸在Cu-PLL/GCE上的循环伏安特性

图2 AA在裸电极(1)和Cu-PLL/GCE(2)上的循环伏安曲线
空白对比实验结果表明,空白液在修饰电极上没有任何峰,而加了AA的溶液则在修饰电极上于0.364V处,有明显氧化峰,故而确定此峰为AA的氧化峰。图2为5.0×10-4mol/L 的AA于pH 2.5 PBS中分别在裸电极和Cu-PLL/GCE电极上的循环伏安曲线。由图可知,在同一扫描电位区间内,AA在裸电极上响应不明显,在0.272 V处有一弱氧化峰;而在Cu-PLL/GCE电极上,AA氧化峰较明显,峰电位为0.364 V,且峰电流明显增大。说明Cu-PLL/GCE对抗坏血酸有较强的催化作用,AA在修饰电极上的响应灵敏度较佳。同时,由于修饰电极膜内掺杂金属铜,该修饰电极的充电电流明显减小。
2.3测定抗坏血酸最佳条件的选择
2.3.1底液PBS的pH对抗坏血酸测定的影响依据实验方法,改变底液PBS的pH进行实验。如图3所示,随着pH的增加,抗坏血酸氧化峰电位负移,说明抗坏血酸的氧化过程中,有质子参加。在pH 2.5~4.5内,峰电位与pH有良好的线性关系,如图3中插图所示,其回归方程为:Epa(V)=0.3182-0.046 pH,r=0.9943。随着pH的增加,AA的峰电流逐渐减小,pH>4.5,AA的氧化峰峰型变钝,pH>7.0,氧化峰逐渐平缓至消失。pH 2.5时,AA的峰电流达到最大值。考虑的检测的灵敏度,选择pH2.5为底液最佳pH值。

图3 不同pH底液中AA的CV曲线和Epa与pH值的关系曲线
2.3.2电位范围的影响在确定最佳的PBS底液pH后,先固定低电位-0.1 V,在0.3~1.0 V范围内改变高电位,进行试验。结果表明,高电位在0.9 V时,AA氧化峰峰电流值最大,响应最好。设置高电位为0.9 V不变,低电位在-0.5~0 V范围内变化,实验得出,低电位在0 V时,AA的响应电流最好。所以确定最佳测定电位范围为0~0.9 V。
2.3.3扫描速度对测定AA的影响控制已优化的条件,改变扫描速度对5.0×10-4mol/L AA进行测定。由图4可知,在20~600m V/s范围内,随扫描速度的增加,AA的氧化峰电流逐渐增大,在60~600 mV/s之间,氧化峰电流与扫描速率的平方根成正比,其线性回归方程为:IPa(μA)=5.627+0.0889v1/2(mV/s),r=0.9967(如图4插图)。说明AA在电极表面的电催化氧化过程主要受扩散控制。同时,随着扫描速度的增加,AA氧化峰电位逐渐正移,充电电流增加,峰型变差。综合考虑,确定180 mV/s为最佳扫描速度。

图4 不同扫描速度下的AA循环曲线和Ipa与υ0.5的关系曲线
2.3.4静置时间对测定AA的影响在2~30 s范围内,改变静置时间进行实验。实验表明,随着静置时间变长,Cu-PLL/GCE的电极对AA的峰电流无明显变化,故确定2 s为最佳静置时间。
2.3.5工作曲线、检出限和电极的重现性

图5 不同浓度的抗坏血酸的CV曲线和工作曲线
在最佳的测定条件下,采用CV法对一系列的AA进行测定。如图5,随着浓度不断增大,AA的氧化峰电位不断正移,峰电流不断增大。如图5插图,在8.0×10-5~8.0×10-3mol/L范围内,氧化峰电流与其浓度有良好的线性关系,线性回归方程为I(μA)= 4.280+2.5823×104CAA(mol/L),r=0.9964,检出限为8.0×10-7mol/L。对5.0×10-4mol/L的AA进行60次的平行测定,其结果的平均标准偏差(RSD)的值为4.72%。
2.3.6其他离子或者物质的干扰在优化的实验条件下,用Cu-PLL/GCE测定5.0×10-4mol/L的AA溶液,允许相对误差为±5%。实验发现,多巴胺、肾上腺素、对苯二酚、Cu2+、K+、Ca2+、Na+、Al3+、Zn2+、Sr2+、Cr2+、Cl-、Mg2+、Fe3+(均≤0.5 mg)对AA的氧化峰电流几乎无影响;Pb2+、Bi2+、Cd2+、Ag+(均为0.1 mg),抗坏血酸的峰电流有所变化,对测定有干扰。
2.3.7样品分析取市售橙汁饮料,参照文献[10]中样品处理的方法进行处理,用草酸和氢氧化钠调节处理液的酸度到pH=5.0,分别装入250 mL的棕色容量瓶,摇匀定容。静置10 min后,各取一定量的溶液,按照优化条件,对AA进行测定。结果见表1。
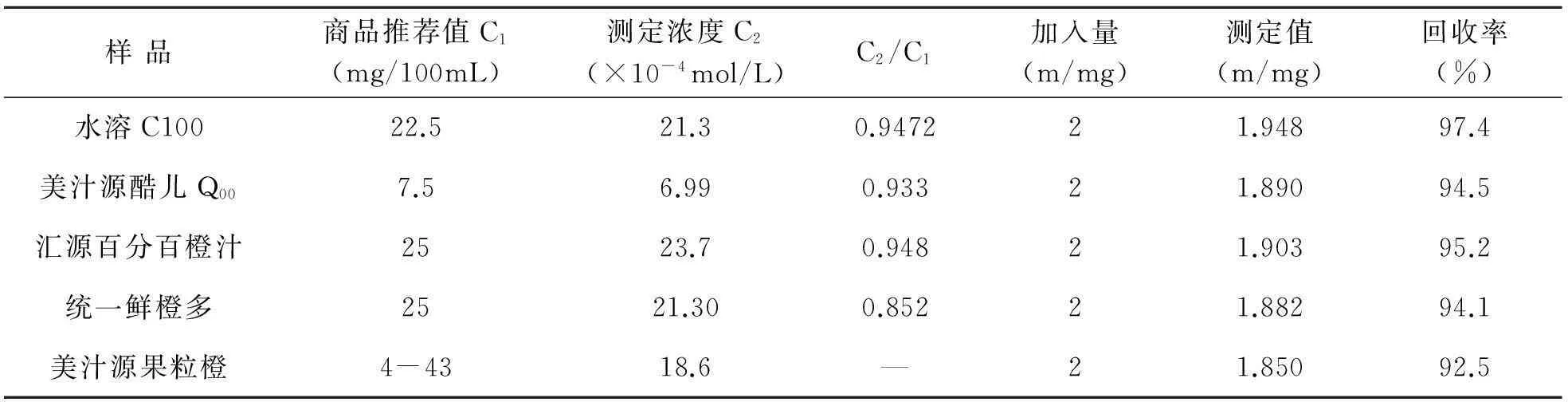
表1 市售橙汁饮品中AA含量分析
3结论
本文探究了铜掺杂聚L-赖氨酸修饰电极(Cu-PLL/GCE)的聚合条件,成功制备Cu-PLL/GCE电极。该修饰电极对抗坏血酸的氧化过程具有较强的催化作用,AA在该修饰电极上的测定响应信号明显增强。将Cu-PLL/GCE用于橙汁饮品中AA的测定,具有选择性高,重现性好等特点,建立了修饰电极测定饮料中的AA含量的新方法。
参考文献:
[1]MEISTER A. GLUTATHIONE ASCORBIC-ACID ANTIOXIDANT SYSTEM IN ANIMALS[J]. Journal of Biological Chemistry, 1994, 269(13): 9397-9400.
[2]许全宝,别之龙,刘朋义,等.三种薄膜对温室光温环境及甜瓜果实生长和品质的影响[J].安徽科技学院学报,2014,28(4):21-24.
[3]张小倩,时维静,邓家胜,等.乙醇浓度对滁菊多类成分提取率影响[J].安徽科技学院学报,2013,27(6):44-47.
[4]库尔班江,赛丽曼.碘量法测水果蔬菜中维生素C的含量[J].伊犁师范学院学报:自然科学版,2007(3):28-32.
[5]杨芳芳.抗坏血酸的测定方法综述[J].甘肃科技纵横,2005,34(6):208-209.
[6]邹明珠,杨海泉,李宏扬.聚乙烯二茂铁修饰电极测定抗坏血酸[J].高等学校化学学报,1985,6(2):123-125.
[7]王长发,马俊义,王敏.硅钼杂多酸示波极谱法测定抗坏血酸[J].分析化学,1992,20(6):710-713.
[8]马伟,田相星,孙登明.铜掺杂聚L-酪氨酸修饰电极同时测定尿酸、多巴胺和抗坏血酸[J].分析试验室,2011,30(12):45-50.
[9]赵雯,吴霞琴,陆中庆.氯过氧化物酶-聚L-赖氨酸/GC电极的电化学特性平[J].电化学,2010,16(1):65-69.
[10]刘根,赵庆侠,孙登明.化学修饰电极循环伏安法测定药物和果蔬中抗坏血酸[J].淮北师范大学学报:自然科学版,2013,34(1):22-27.
(责任编辑:马世堂)
Preparation of Copper-doped Poly-L-lysine Film Modified Electrode and determination of Ascorbic Acid in the Juice Drinks
HU Wen-na1,2, WU Jia-jia1
(1.Department of Applied Chemistry and Environmental Engineering,Bengbu University,Bengbu 233000,China;2.Institute of Chemical and Applied Technology,Bengbu University,Bengbu 233000,China)
Abstract:The copper doped poly L-lysine modified electrode was prepared by cyclic voltammetry. The voltammetric behavior of ascorbic acid on the modified electrode was studied and the method was established. In pH=2.5 phosphate buffer solution, the scanning speed of 180 mV/s, ascorbic acid produced a sensitive oxidation peak on the modified electrode, the peak potential of 0.364 V. And the peak current of ascorbic acid in the range from 8×10(-5 )to 8×10(-3 )mol/L showed a good linear relationship. The detection limit was 8×10(-7)mol/L. Measured for orange juice beverage with satisfactory results.
Key words:L-lysine; Cyclic voltammetry; Modified electrodes; Copper doping; Ascorbic acid
中图分类号:O657.15
文献标识码:A
文章编号:1673-8772(2016)01-0047-05
作者简介:胡文娜(1981-),女,安徽省寿县人,硕士,讲师,主要从事电分析化学和光电催化研究。
基金项目:安徽省高校自然科学研究项目(113052015kj03);蚌埠学院自然科学研究项目(2011ZR07);蚌埠学院应用化学重点学科项目。
收稿日期:2015-09-01
