蛋白酶体抑制剂MG132对胆囊癌细胞杀伤作用的实验研究
2016-04-23朱卫平詹棣华赵一鸣王鲁解宏伟王会鹏程志俭复旦大学附属上海市第五人民医院普外科上海0040复旦大学附属肿瘤医院肝脏外科上海0003
朱卫平,詹棣华,赵一鸣,王鲁,解宏伟,王会鹏,程志俭(.复旦大学附属上海市第五人民医院 普外科,上海 0040;.复旦大学附属肿瘤医院 肝脏外科,上海0003)
蛋白酶体抑制剂MG132对胆囊癌细胞杀伤作用的实验研究
朱卫平1,2,詹棣华2,赵一鸣2,王鲁2,解宏伟1,王会鹏1,程志俭1
(1.复旦大学附属上海市第五人民医院普外科,上海200240;2.复旦大学附属肿瘤医院肝脏外科,上海200032)
[摘 要]目的 研究蛋白酶体抑制剂MG132抑制胆囊癌细胞增殖及诱导凋亡的机制。方法 采用CCK8和流式细胞术检测胆囊癌细胞增殖及凋亡情况;采用Western blotting和RT-PCR检测凋亡相关基因Caspase-8、Caspase-3和DR5的mRNA和蛋白质表达;建立荷瘤裸鼠模型,观察MG132干预下裸鼠瘤重及瘤体积的变化。结果 在本研究中发现MG132能有效抑制体外和体内胆囊癌细胞的增殖,其作用呈剂量依赖性(P<0.01)。MG132能促使胆囊癌细胞发生G2/M期阻滞及诱导细胞凋亡。MG132诱导胆囊癌细胞凋亡主要通过激活外源性凋亡通路中DR5、Caspase-8和Caspase-3过表达。结论 MG132能对胆囊癌细胞起杀伤作用,其机制可能通过影响细胞周期阻滞及诱导细胞凋亡起作用。
[关键词]胆囊癌;蛋白酶体抑制剂;增殖;凋亡
Experimental study of the killing effect of proteasome inhibitor MG132 on gallbladder cancer cells
ZHU Wei-ping1,2,ZHAN Di-hua2,ZHAO Yi-ming2,Wang Lu2,Xie Hong-wei1,Wang Hui-peng1,Cheng Zhi-jian1.1Department of General Sugery,the Fifth People’s Hospital of Shanghai,Fudan University,Shanghai 200240,China;2Department of Hepatic Surgery,Fudan University Shanghai Cancer Center,Shanghai,200032,China
Abstract objectiveTo investigate the mechanism of proteasome inhibitor MG132 in inhibiting proliferation and inducing apoptosis of gallbladder cancer cells.MethodsThe anti-tumor activity of MG132 on gallbladder cancer cells was assessed by the CCK8 assay.Apoptosis changes were detected by flow cytometric analysis.The protein and mRNA expression of Caspase-8,Caspase-3 and DR5 were examined using Western blotting and RT-PCR.Gallbladder cancer xenografts in athymic nude mice were established and the tumor weight and volume were measured after the intervention of MG132.ResultsThe results showed that MG132 inhibited the proliferation of gallbladder cancer cells in a dose-dependent manner both in vivo and in vitro(P<0.01).Exposure of tumor cells to MG132 induced cell cycle arrest at G2/M phase and apoptosis in a dose- dependent manner(P<0.01).In addition,analysis of apoptotic pathways indicated that MG132 significantly enhanced the activation of Caspase-8,Caspase-3 and DR5 in extrinsic signaling pathway(P<0.05).ConclusionProteasome inhibitor MG132 can effectively kill gallbladder cancer cells and its mechanism involves the cell cycle arrest and apoptosis induction.
Key words gallbladder carcinoma; proteasome inhibitor; proliferation; apoptosis
胆囊癌是高度恶性的胆道系统肿瘤,目前虽然随着诊断技术和治疗手段的提高使得患者预后有所改善,但5年生存率仍然低于5%[1]。因此,积极探索胆囊癌治疗的新策略成为目前研究的重点。泛素-蛋白酶体通路(ubiquitin-proteasome pathway,UPP)是调控真核细胞中内源性蛋白质选择性降解的关键途径,与肿瘤细胞的周期运转、增殖、凋亡等生物学行为密切相关[2]。MG132是一种可逆性醛基肽类特异性蛋白酶体抑制剂,能通过抑制26S蛋白酶体对泛素结合蛋白的降解,阻断UPP介导的蛋白质的降解,影响细胞周期进程和诱导细胞凋亡[3]。本实验主要探讨蛋白酶体抑制剂MG132抑制胆囊癌细胞增殖及诱导凋亡的可能机制。
1 材料和方法
1.1实验材料
人胆囊癌细胞株(GBC-SD)购自复旦大学肿瘤研究所。MG132(Z-Leu-Leu-Leu-al)、Caspase-8、Caspase-3、DR5购自Sigma公司;CCK8试剂盒购自日本同仁化学研究所;酶标仪(TECAN公司);FACScan型流式细胞仪(Becton Dickinson公司)。
1.2实验方法
1.2.1细胞增殖检测:GBC-SD细胞传代培养于含10%胎牛血清(FBS)的DMEM,37 ℃、5% CO2培养箱。予以不同浓度MG132(0、2.5、5、10、20 μmol/L)作用24、48及72 h。酶标仪450 nm波长下检测吸光度并绘制细胞存活率曲线。根据检测的细胞存活率,选择合适后续实验的处理浓度和处理时间。
1.2.2细胞周期分析:收集对数生长期GBC-SD细胞,予以预设MG132浓度(0、2.5、5、10 μmol/L)处理72 h,调整细胞数量至1×106个/mL。4%多聚甲醛固定。100 μL碘化丙啶(PI)工作液(0.5 mg/mL的PI,0.2 mg/mL的RNaseA),4 ℃避光染色30 min。转至流式检测管,上机检测。
1.2.3细胞凋亡检测:取对数生长期细胞,不同预设浓度MG132作用72 h。消化、离心细胞,弃上清(重复两次);预冷无水乙醇固定后重悬于0.5 mL的PI染液(含有10 μg/mL pI和50 μg/mL Rnase A),37 ℃30 min。用凋亡试剂盒对上述细胞进行染色处理,流式上机检测上述细胞凋亡情况。
1.2.4蛋白表达检测:采用Western blotting法在6孔板中接种1×106个/mLGBC-SD细胞,贴壁培养12 h。予以预设不同浓度MG132作用72 h。使用RIPA裂解液提取各组蛋白,8%聚丙烯酰胺凝胶电泳后,转PVDF膜。用10%胎牛血清4 ℃封闭过夜后,一抗结合孵育2 h。TBST洗2遍后加入荧光二抗,37 ℃摇床孵育1 h。红外激光成像系统进行蛋白质分析。
1.2.5mRNA表达检测:采用RT-PCR法不同浓度MG132作用GBC-SD细胞72 h后,检测细胞Caspase-8、 Caspase-3、DR5 mRNA的表达。反应引物序列如表1。Trizol试剂提取细胞总RNA,根据RNA逆转录试剂盒说明反转录cDNA。使用即时荧光定量PCR仪(7300,ABI)进行扩增反应。取PCR产物6 μL,2%琼脂糖凝胶电泳。应用Quantity One software(Bio-Rad Inc)分析电泳结果并进行灰度扫描。

表1 RT-PCR反应引物序列
1.2.6荷瘤裸鼠实验:取对数生长期GBC-SD细胞,建立裸鼠胆囊癌皮下模型。将实验模型随机分为4组:对照组(生理盐水),MG132低剂量组(5 mg/kg),MG132中剂量组(10 mg/kg),MG132高剂量组(15 mg/kg)。成模后第10天开始连续腹膜腔注射至3周。每3 d观察各小鼠的肿瘤体积,第22天处死实验小鼠,观察瘤重。
1.3统计学分析
2 结果
2.1细胞存活率观察
从图1可知,MG132能明显抑制胆囊癌细胞GBCSD的存活率,呈浓度和时间依赖关系(P<0.01)。当浓度区间在0~10 μmol/L时,随着MG132浓度增大,GBC-SD细胞存活率下降最明显,故后继实验选择较低浓度MG132(0、2.5、5、10 μmol/L)在72 h进行实验观察。
2.2细胞周期分析
从图2可知,不同浓度MG132作用GBC-SD细胞72 h后,GBC-SD细胞发生G2/M期阻滞并且凋亡细胞数明显增加,其效应在10 μmol/L组最明显,呈量效关系(P<0.01)。
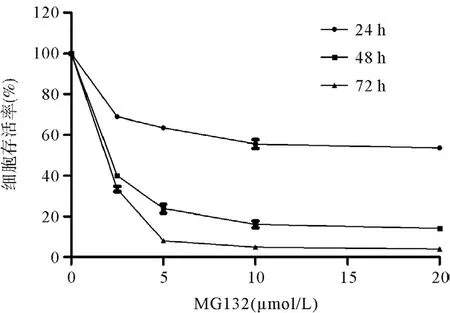
图1 不同浓度MG132在不同时间对胆囊癌细胞存活率的影响
2.3细胞凋亡分析
流式结果显示,MG132能浓度依赖性的诱导胆囊癌细胞GBC-SD发生凋亡,差异具有统计学意义(P<0.01)(图3)。在细胞凋亡信号通路检测中,Western blotting结果显示随着MG132浓度的增加,胆囊癌细胞表达凋亡蛋白DR5、Caspase-8、Caspase-3水平出现明显增强,呈剂量依赖性(P<0.05)(图4)。RTPCR结果显示MG132能明显增强GBC-SD细胞中外源性凋亡通路DR5、Caspase-8、Caspase-3 mRNA表达,差异有统计学意义(P<0.05)。
2.4荷瘤裸鼠体内实验分析
体内实验发现,MG132能剂量依赖性的抑制胆囊癌GBC-SD的生长。胆囊癌移植瘤重量从(1.132± 0.125)g(对照组)、(0.876±0.132)g(5 mg/kg组)、(0.706±0.123)g(10 mg/kg组)逐渐减少至(0.424± 0.032)g(15 mg/kg组),组间差异具有统计学意义(P <0.01)。同时,移植瘤的体积也随MG132处理剂量的逐渐增大而逐渐缩小,呈剂量依赖性(P<0.01)。
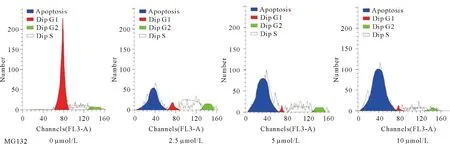
图2 不同浓度MG132对胆囊癌细胞周期的影响

图3 不同浓度MG132对胆囊癌细胞凋亡的影响
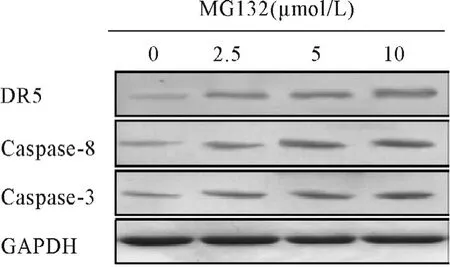
图4 不同浓度MG132对胆囊癌细胞凋亡蛋白表达影响
3 讨论
目前研究发现,泛素-蛋白酶体通路(UPP)可高效并高度选择性降解与细胞周期、凋亡等相关的各种蛋白质,启动相关信号通路对细胞蛋白的调节,是极有潜力的控制细胞凋亡的靶点[4-5]。蛋白酶体抑制剂MG132可以通过阻断UPP对异常蛋白的降解,影响细胞周期,诱导细胞凋亡,增强药物敏感性[6-7]。MG132在消化道肿瘤中的研究已逐渐成为研究热点。已有文献报道在结直肠癌、肝癌细胞株中,蛋白酶体抑制剂MG132能以时间和剂量依赖性的方式抑制细胞增殖,诱导细胞凋亡[8-9]。然而,蛋白酶体抑制剂在胆囊癌中的研究没有得到足够重视,研究的数据也非常有限。在本实验中,我们通过体内外实验发现在不同浓度MG132干预下,胆囊癌细胞存活率呈现剂量依赖性。这提示在胆囊癌细胞中,MG132也能通过阻断UPP途径抑制细胞增殖。
在进一步研究中,我们发现MG132能剂量依赖性地促进胆囊癌细胞发生G2/M期阻滞及诱导细胞凋亡,这些结果提示MG132对胆囊癌细胞的杀伤作用主要是通过影响细胞周期阻滞及诱导细胞凋亡起作用。杨洋等[10]的研究也证明,MG132在食管鳞癌中也能通过抑制肿瘤细胞增殖,促进凋亡,提高顺铂的杀伤作用。细胞凋亡主要通过内源性凋亡途径和外源性凋亡途径。既往研究发现在细胞凋亡过程中,细胞膜上死亡受体DR5和DR4能与TRAIL配体结合启动外源性凋亡信号通路,发挥促凋亡的作用[11]。目前,DR5 和DR4已成为细胞凋亡调控研究中的热点。外源性TRAIL通过与肿瘤细胞膜上DR5和DR4受体结合发挥强大的肿瘤细胞杀伤作用已被较多实验所证实,显示出较大的临床应用价值,但同时也发现部分肿瘤细胞存在耐药现象。有文献报道UPP途径能通过影响死亡受体介导的细胞凋亡通路调控细胞凋亡[12]。在本研究中,我们观察到不同浓度MG132作用下,胆囊癌细胞内DR5蛋白及基因表达出现明显的增强,同时DR5下游凋亡通路中关键分子caspase-8及caspase-3表达水平也出现明显上调,说明MG132可通过阻断UPP途径影响DR5介导的外源性凋亡通路发挥肿瘤细胞杀伤作用。随着DR5及DR4成为抗肿瘤治疗及耐药机制研究的焦点,本实验机制的阐明将为联合用药克服抗肿瘤耐药提供新的思路。在后期实验中,我们将在现已探明的MG132作用机制基础上进一步探索MG132与TRAIL联合运用增强TRAIL抗胆囊癌疗效的作用及具体机制。这些作用机制的阐明将为TRAIL联合治疗抗肿瘤,克服肿瘤细胞耐药提供新的方向。
综上所述,蛋白酶体抑制剂MG132能有效抑制胆囊癌细胞的增殖,其作用呈剂量-时间依赖关系。MG132对胆囊癌细胞的化疗杀伤作用,其过程涉及细胞周期阻滞及DR5介导的外源性凋亡通路。
参考文献:
[1]BIZAMA C,GARCIA P,ESPINOZA J A,et al.Targeting specific molecular pathways holds promise for advanced gallbladder cancer therapy[J].Cancer Treat Rev,2015,41(3):222-234.
[2]DING F,XIAO H,WANG M,et al.The role of the ubiquitinproteasome pathway in cancer development and treatment[J].Front Biosci(Landmark Ed),2014,19:886-895.
[3]GUO N,PENG Z.MG132,a proteasome inhibitor,induces apoptosis in tumor cells[J].Asia Pac J Clin Oncol,2013,9(1):6-11.
[4]VAN KERKHOF P,ALVES DOS SANTOS C M,SACHSE M,et al.Proteasome inhibitors block a late step in lysosomal transport of selected membrane but not soluble proteins[J].Mol Biol Cell,2001,12(8):2556-2566.
[5]NALEPA G,ROLFE M,HARPER J W.Drug discovery in the ubiquitin-proteasome system[J].Nat Rev Drug Discov,2006,5(7):596-613.
[6]YUAN B Z,CHAPMAN J,DING M,et al.TRAIL and proteasome inhibitors combination induces a robust apoptosis in human malignant pleural mesothelioma cells through Mcl-1 and Akt protein cleavages[J].BMC Cancer,2013,13:140.
[7]ZANOTTO-FILHO A,DELGADO-CANEDO A,SCHRODER R,et al.The pharmacological NFkappaB inhibitors BAY117082 and MG132 induce cell arrest and apoptosis in leukemia cells through ROS-mitochondria pathway activation[J].Cancer Lett,2010,288(2):192-203.
[8]DING W X,NI H M,CHEN X,et al.A coordinated action of Bax,PUMA,and p53 promotes MG132-induced mitochondria activation and apoptosis in colon cancer cells[J].Mol Cancer Ther,2007,6(3):1062-1069.
[9]CERVELLO M,GIANNITRAPANI L,LA ROSA M,et al.Induction of apoptosis by the proteasome inhibitor MG132 in human HCC cells:Possible correlation with specific caspasedependent cleavage of beta-catenin and inhibition of betacatenin-mediated transactivation[J].Int J Mol Med,2004,13(5):741-748.
[10]杨洋,樊玉霞,刘东雷,等.蛋白酶体抑制剂MG132增加顺铂对食管鳞癌细胞的杀伤作用[J].中华实验外科杂志,2014,31(5):1042-1044.
[11]PAN G,O’ROURKE K,CHINNAIYAN A M,et al.The receptor for the cytotoxic ligand TRAIL[J].Science,1997,276(5309):111-113.
[12]SONG J J,SZCZEPANSKI M J,KIM S Y,et al.c-Cbl-mediated degradation of TRAIL receptors is responsible for the development of the early phase of TRAIL resistance[J].Cell Signal,2010,22(3):553-563.
(本文编辑:张海燕,鲁翠涛)
·论著 基础研究·
[通讯作者简介]王鲁,教授,博士生导师,E-mail:wang.lu@zs-hospital.sh.cn。
作者简介][第一朱卫平(1980-),男,江苏常州人,主治医师,博士。
[基金项目]国家自然科学基金项目(81372314,81272393);上海市卫生局青年基金项目(20134Y089);上海市闵行区自然科学基金项目(2012MHZ025);复旦大学附属上海市第五人民医院院内课题(2010QJ05)。
[收稿日期]2015-12-09
[中图分类号]R735.8
[文献标识码]A
doi:10.11952/j.issn.1007-1954.2016.02.008
