棘胸蛙出血病病原鉴定及药敏试验
2016-04-22郑卫军宋婷婷郑善坚郑荣泉
郑卫军宋婷婷郑善坚郑荣泉
(1浙江省野生动物生物技术与保护利用重点实验室 浙江金华 321004;2浙江金华市婺城区农林局 321000)
棘胸蛙出血病病原鉴定及药敏试验
郑卫军1,2宋婷婷2郑善坚2郑荣泉2
(1浙江省野生动物生物技术与保护利用重点实验室浙江金华321004;2浙江金华市婺城区农林局321000)
摘要:从患病棘胸蛙(Quasipaa spinosa)中分离到三株细菌,将分离株制备的菌液分别采用口服、肌肉注射、皮肤损伤浸泡、皮肤不损伤浸泡4种方式回归感染棘胸蛙,结果显示,除口服方式外,其他各种感染途径均能使棘胸蛙发病并导致死亡,且对蛙有较强的致病性。通过形态学、生理生化试验、16S rDNA序列等方法鉴定该致病菌株为鲍曼不动杆菌(Acinetobacter baumannii)。同时,通过抑菌圈法研究了该菌株对12种抗生素的敏感性。结果显示:该菌对亚胺培南、阿米卡星、奈替米星高度敏感,对青霉素、新霉素、林可霉素、先锋霉素、氯霉素、吡哌酸、头孢哌酮、庆大霉素、红霉素不敏感。
关键词:棘胸蛙;鲍曼不动杆菌;药敏试验
棘胸蛙(Quasipaa spinosa)营养价值高,肉质细嫩鲜美,自上世纪八十年代开展人工养殖以来逐渐形成规模,而高密度集约化养殖模式以及种质衰退等原因导致了各种病害的发生日益频繁,其中以细菌性疾病最为严重。成为困扰棘胸蛙养殖业发展的一个重要因素[1]。国内已有学者相继报道了牛蛙、美国青蛙等的腹水病[2]、脑膜炎[3]、白内障病[4]、肝肿大病[5]、爱德华氏菌病[6]等蛙类疾病,在棘胸蛙中的疾病虽然报道较少,但目前已发现了红腿病、烂皮病以及一种肝脏发黑囊肿的新类型疾病等多种细菌性疾病[7-9]。
2013年6月在丽水市某养殖场,发生了棘胸蛙成蛙大面积死亡,病蛙的特征与已报道的其它棘胸蛙发病症状不同:蛙体腹面均充血红色,均不摄食,应激能力差,行动迟缓,体态臃肿。经解剖后发现腹腔内大量腹水,伴有水肿现象。据初步调查,此病的流行季节为5-9月份,对棘胸蛙养殖业的危害较大。为了达到控制该病的目的,我们进行了该病的病原研究,对致病菌株进行了鉴定,并初步筛选了对致病病原敏感的药物,以期为该病的防治和诊断提供实验依据。
1 材料和方法
1.1试验材料
由浙江省遂昌县棘胸蛙养殖场提供的自然发病蛙,规格150~200g /只。健康棘胸蛙来自金华沙畈棘胸蛙养殖场,规格100~120g/只,置于自然水温22℃的水族箱中暂养3d备用。
1.2致病菌的分离
按无菌操作从病蛙的病变肝脏取材,划线接种于普通营养琼脂平板,在28℃下培养24h,平板上出现了许多形态一致的小菌落;选取单个菌落,再进行平板划线分离,直至获得纯培养物,供试验用[10]。
1.3人工感染试验
1.3.1菌液制备
将纯培养物接种在普通营养液体培养基中,置于200r/s的摇床中振荡培养18h,用灭菌生理盐水,采用比浊管法稀释,置4℃环境中贮存备用。
1.3.2人工感染
将分离得到的3株菌制备的菌液采用肌注注射方式感染健康棘胸蛙,每组选取5只健康棘胸蛙,先对蛙体背部皮肤消毒后,将菌液按0.2ml/只进行肌注感染试验,对照组注射等剂量的生理盐水,感染试验观察期为15天,并记录试验棘胸蛙的病症及死亡数目,计算其死亡率。同时,对人工感染发病濒死的棘胸蛙进行病原菌再分离,检查所分离的菌株与原分离菌株在形态与理化特性等方面是否一致。
1.4菌落观察及生理生化特性的测定
对致病菌菌落进行大小、形态、颜色等观察,细菌的革兰氏染色及生理生化的鉴定,参照有关文献[10]所述方法进行。
1.516S rDNA鉴定
采用TaKaRa公司的16S rDNA Bacterial Identi f ication PCR Kit试剂盒提取菌株的基因组DNA,以PCR法获取其16S rDNA扩增产物,将PCR反应扩增出的16S rDNA片断送至上海生工生物技术公司,先进行PCR产物的纯化后再进行测序。使用NCBI网站对致病菌的16S rDNA序列与数据库中各种菌的16S rDNA序列进行比对,最终鉴定目的菌的种类[8-10]。
1.6药物敏感试验
对该致病菌株进行药物敏感试验,按文献[8-9]所述方法进行。分离菌株接种营养肉汤培养基,28℃培养24 h,无菌生理盐水稀释菌液至(1~2)×105CFU/mL,取100 ug/mL涂布于营养琼脂,取内径6 mm牛津杯置于培养基表面,加入100 ug/mL抗生素200 uL,28℃培养24 h后测定抑菌圈。每种抗生素做3个重复。同时,对该病的防治措施进行初步的探究。
2 结果与分析
2.1病原分离结果
从病蛙病变肝脏内组织液接种至营养琼脂培养,进一步划线培养直至得到单菌落,取3个单菌落,纯化后暂标记为S-1、S-2、S-3。
2.2回归感染试验
将S-1、S-2、S-3三个菌株用生理盐水制成菌液,对健康蛙进行肌注感染试验。结果显示,S-1、S-2、S-3三个菌株感染试验组蛙在5d内60%发病死亡,其症状表现与自然发病基本相同,均为蛙体腹面均呈红色,均不摄食,应激能力差,行动迟缓,体态臃肿。经解剖后发现腹腔内大量腹水,伴有水肿现象(图1)。对照组全部存活,感染试验见表1,表明三株菌株为致病菌。
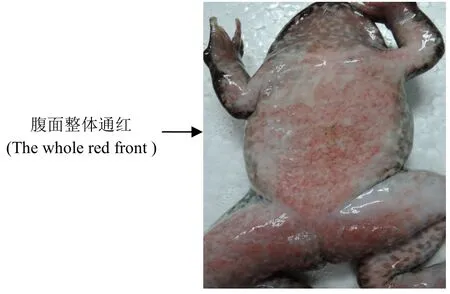
图1 病变棘胸蛙腹部特征Figure 1 Abdom inal characteristics of lesions of Quasipaa spinos
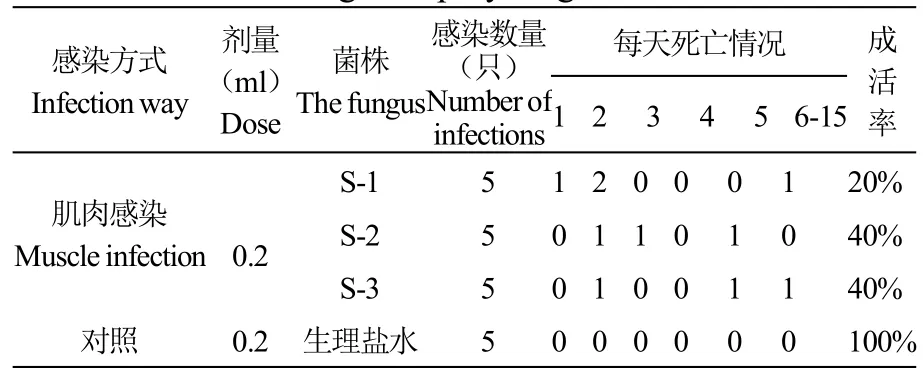
表1 分离菌对实验棘胸蛙的感染结果Table 1 Isolated bacteria infection results of experimental giant spiny frogs
2.3菌落观察及生理生化试验
对回归感染的病蛙作细菌分离,获得与S-1、S-2、S-3三个菌株相同形态特征的菌株,纯化后暂标记为S-1’、S-2’、S-3’。根据细菌的形态特征,并通过系统的生理生化鉴定试验,证明六株菌理化性质的一致性。
三株分离菌和三株回感菌均成对排列或单个存在,菌体大小为1.5-2.5μm,有荚膜,无芽孢,无鞭毛。专性需氧,普通培养基上生长良好,能在麦康凯琼脂培养基上生长。革兰氏染色均为革兰氏阴性杆菌。对分离菌的生化鉴定见表2。根据《常见细菌系统鉴定手册》[11]鉴定均为鲍曼不动杆菌(Acinetobacterbaumannii)。
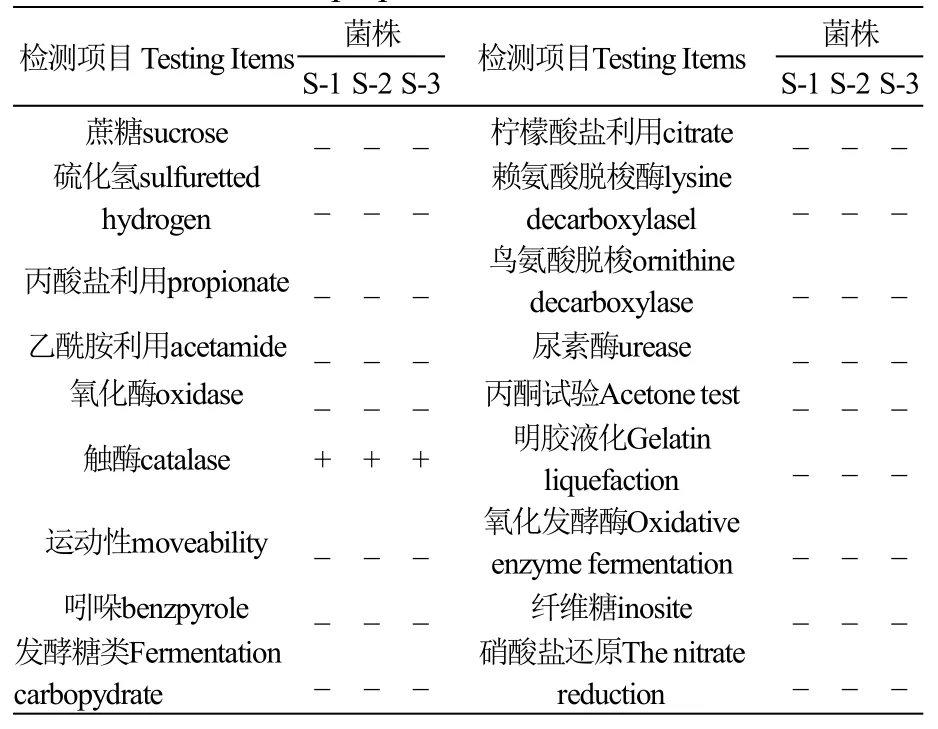
表2 三株分离菌生化鉴定结果Table2 Biochemicalpropertiesof isolated strain S-1,S-2,S-3
2.416S rDNA测序、鉴定结果
对该致病菌的16SrDNA经PCR扩增,并将扩增产物进行测序。测得16S rDNA大部分序列为1501bp(图2)。

图2 致病菌的16S rDNA碱基序列Figure 2 16S rDNA sequence

通过NCBI网站对致病菌的16S rDNA序列与数据库中各种菌的16S rDNA序列进行比对。所得结果中同相似性最高的前9个菌株比较结果如表3。
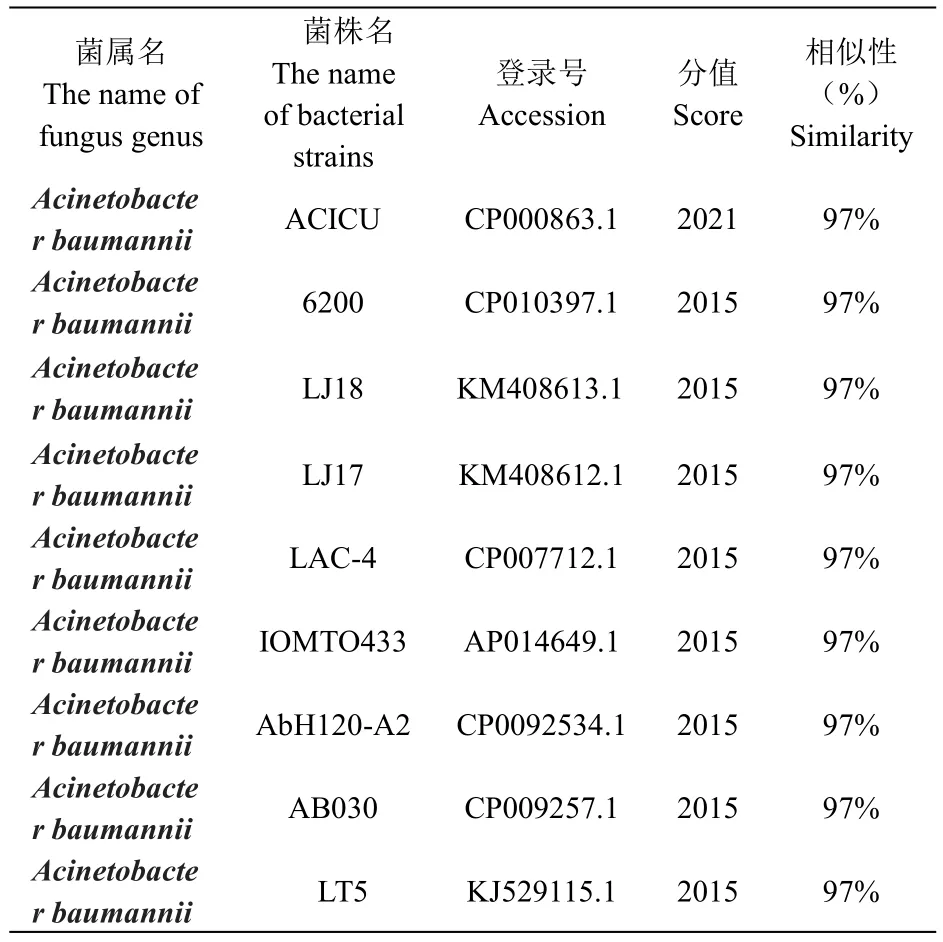
表3 菌株16S rDNA序列同GeneBank中细菌菌株同源性比较Table 3 Homology comparisons of 16S rDNA sequence between strains and some bacteria in GeneBank
从3可以看出,通过16S rDNA序列同源性比较,菌株与GeneBank中9株鲍曼不动杆菌的16S rDNA序列相似性均达到97%以上,鉴定结果进一步确认引起该病的病原菌为鲍曼不动杆菌。
2.5药敏试验
药敏试验结果如表4所示:该菌对亚胺培南、阿米卡星、奈替米星高度敏感,对青霉素、新霉素、林可霉素、先锋霉素、氯霉素、吡哌酸、头孢哌酮、庆大霉素、红霉素不敏感。

表4 分离菌对抗菌药敏感性Table 4 Isolated bacteria to antibiotic sensitivity
3 讨论
鲍曼不动杆菌(Acinetobacter baumannii)为广泛存在于自然界的一种条件致病菌,由于其能很好的耐受较宽泛的温度和酸碱度,所以能长期存在于各种物品的表面。鲍曼不动杆菌感染一般为医院获得性感染,临床分离率仅次于铜绿假单胞菌的非发酵菌,通过人与人的接触造成院内的交叉传播。随着抗生素的大量使用,鲍曼不动杆菌的耐药率逐渐升高,在世界各地多重耐药菌株(MDR)的陆续报道[12],已引起全球对鲍曼不动杆菌的广泛关注。给养殖业及人类健康带来了巨大危害,因此研究鲍曼不动杆菌具有重要生物学意义。
药敏实验表明,许多抗菌药物对该菌有较好的抗菌作用,一旦有上述特征疾病的症状发生,可采用对本菌敏感的药物进行治疗。另外,在疾病的防治上,应该是防重于治。我们认为,应该加强野生动物的保护和管理,从野外捕捞或不明来历的棘胸蛙,应先做好消毒和隔离暂养,安全后进入养殖场进行养殖。与此同时,养殖场应加强棘胸蛙饲养管理,保持水体流动及水质清新,加强水质的消毒及降温保洁工作,且放养密度要适当,切勿放养过密。这对于预防该种疾病的大面积蔓延具有切实有效的作用。
参考文献:
[1]马有智.棘胸蛙嗜水气单胞菌的生物被膜形成特性[J].浙江农业科学,2013,(7): 894-896.
[2]贺路,艾晓辉.牛蛙腹水病病原研究[J].淡水渔业,1995,25(3): 16-18.
[3]叶雪平,杨广智,罗毅志.牛蛙脑膜炎(歪脖子病)病原分离及防治技术研究[J].浙江水产学报,1996,15(4): 301-304.
[4]纪荣兴,邹文政,莫英军.牛蛙“白内障”病病原的初步研究[J].集美大学学报(自然科学版),2003,8(1): 8-11.
[5]陈晓凤,陈祈辉,王好镇,等.牛蛙“肝肿大病”病原的研究[J].厦门水产学院学报(自然科学版),1995, 17(2): 32-36.
[6]肖克宇,黄志坚,金燮理,等.牛蛙爱德华氏菌病病原菌的鉴定和致病因素的研究[J].水产学报,1997,21(3): 316-320.
[7]苏雪红,张正江,纪任宗.棘胸蛙病害调查及药敏试验初报[J].福建水产, 2001, 3(1): 32-37.
[8]王瑞君,熊筱娟.棘胸蛙烂皮病奇异变形杆菌的分离、鉴定及对药物敏感性研究[J].淡水渔业, 2012, 42 (4): 36-37.
[9]宋婷婷,郑荣泉,张俊美,等.一种棘胸蛙新类型疾病病原分析[J].福建水产,2014,36⑸:344-350.
[10]马有智,舒妙安.一种中华鳖穿孔病病原菌的分离和特性研究[J].浙江大学学报:农业与生命科学版,2000,26(4): 414-416.
[11]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社, 2001: 80—81, 364—386.
[12]叶有娣,谢家政.多重耐药不动杆菌治疗药物研究进展[J].中国临床药理学与治疗学,2016,21 (1):116-120.
Pathogen identification and drug Sensitivity of the hemorrhagic disease in Quasipaa spinosa
Abstract:Three pathogenic bacteria was isolated from diseased giant spiny frog (Quasipaa spinosa), which were used to microbial regression experimental infection. The frogs were infected by soaking in the oral, intramuscular injection, skin lesions, and skin does not damage soak ways, results showed that in addition to the oral way, various other infection ways can cause disease and death of giant spiny frogs. Moreover, the bacteria have strong pathogenicity to frogs. The is1olated strain was identified as Acinetobacter baumannii by its morphological, biochemical properties and 16S rDNA sequence analysis. At the same time, the susceptibility of isolated strains to antibiotics was studied by zone of inhibition testing. Results showed: it was sensitive to netilm icin, amikacin, m ipenem. However, it was not sensitive to penicillin, neomycin, clindamycin, cephalothin, chloramphenicol, pipemidic acid, cefoperazone, gentam icin, erythromycin.
Key words:Quasipaa spinosa; Acinetobacter baumannii; drug Sensitivity
收稿日期:2015-12-12
中图分类号:Q958
文献标识码:A
文章编号:1004-7743(2016)01-0042-04
项目资助:浙江省公益性项目(2016C32057),浙江省重大科技专项(2010C12008)
