诱骗受体3的二级结构及B细胞表位预测
2016-04-20刘晓梁
刘晓梁
山西医科大学汾阳学院科技中心 山西吕梁 032200
诱骗受体3的二级结构及B细胞表位预测
刘晓梁
山西医科大学汾阳学院科技中心山西吕梁032200
[摘要]①目的预测诱骗受体3(Dcr3)蛋白的二级结构及B细胞表位。②方法通过NCBI蛋白数据库检索到Dcr3蛋白的氨基酸序列,以此为基础,通过SOPMA在线服务器预测其二级结构,利用Lasergene软件预测其亲水性、表面可及性、柔韧性区域及抗原性指数,综合分析,预测其可能的B细胞表位。③结果Dcr3的二级结构由无规则卷曲(43.00%)、β折叠(10.33%)、 α螺旋(36.33%)和β转角(10.33%)构成,其可能的B细胞表位位于56-67(TFVQRPCRRDSP), 93-101(VLCGEREEE),56-167(GTFSASSSSSEQ), 255-261(LKLRRRL), 286-293(PGLERSVR)。④结论此结果为制备Dcr3表位特异性抗体肽段选择提供了依据。
[关键词]Dcr3二级结构B细胞表位
诱骗受体3(Dcr3)是近年发现的肿瘤坏死因子受体超家族(TNFRSF)成员[1],其基因位于人20号染色体20q13.3[2],可编码300个氨基酸的蛋白质,其中包含29个信号肽序列,经加工处理后,分泌到细胞外发挥作用。成熟Dcr3相对分子量约为33kd[3],结构上与其他TNFRSF成员类似,含有4个半胱氨酸富集区形成的结构域[4]。在该家族中,Dcr3是唯一能够同时结合肿瘤坏死因子配体FasL、LIGHT和TL1A,并中和其效应的成员。此外,Dcr3还能够通过其C端的粘多糖结合结构域与多种类型细胞表面的硫酸乙酰肝素蛋白多糖(HSPG)结合,从而在免疫调节,细胞粘附以及抗原提呈细胞的分化等方面发挥作用[5,6]。生理状态下,在健康人的组织中可以检测到Dcr3低水平的mRNA[7],常规的检测手段并不能检出Dcr3蛋白的表达,但在某些自身免疫性疾病、肿瘤性疾病中其表达水平增高[4]。
Dcr3与肿瘤的研究表明,在消化系统、呼吸系统、泌尿生殖系统、血液淋巴系统等多种类型肿瘤中,Dcr3高表达[6,8~12]。除了肿瘤细胞,免疫细胞以及间质细胞等都可以作为Dcr3的来源。Dcr3与肿瘤的发生发展及预后判断密切相关。在神经胶质瘤、胰腺癌、肝细胞肝癌中,Dcr3可以抑制FasL介导的凋亡;Dcr3还可通过阻断血管内皮细胞分泌的TL1A而促进肿瘤血管的形成;可以介导单核巨噬细胞向肿瘤灶的迁移浸润,并诱导巨噬细胞向肿瘤相关巨噬细胞(TAMs)分化,进而逃避免疫监视,发挥促进肿瘤生长的作用。此外,肿瘤组织或血浆中Dcr3浓度升高往往与肿瘤分期较高、容易发生淋巴结浸润以及远处转移相关,从而被视为肿瘤预后的不良指标。
在Crohn病、溃疡性结肠炎、系统性红斑狼疮、风湿性关节炎等自身免疫性疾病中,Dcr3表达升高[10,13,14]。TL1A、LIGHT、 FasL等在胶原诱导的风湿性关节炎发病中具有重要作用。Dcr3 可以通过其“诱骗”作用,减缓关节炎的发病,改善病情;Dcr3可以介导Th2细胞的免疫漂移,从而使得NOD小鼠对1型糖尿病具有一定的抵抗性[15]。另外一方面,Dcr3通过竞争性结合FasL可使增强免疫系统的活化程度,而加剧某些自身免疫病的发展[4]。
鉴于Dcr3蛋白在肿瘤、自身免疫性疾病中的病理生理意义,制备其单克隆抗体不仅可为疾病的病情判断提供有效工具,而且有望为疾病的生物治疗提供新的思路。在本研究中,我们利用计算机辅助技术,预测Dcr3蛋白的B细胞表位,期望为研制其表位特异性抗体肽段的选择提供依据。
1材料与方法
1.1人Dcr3的一级结构根据NCBI提供的蛋白数据库(NP_003814.1)获得人Dcr3的氨基酸序列。序列如图1。

图1 人Dcr3的氨基酸序列
1.2人Dcr3二级结构的预测采用较为流行的SOPMA法(Improvedself-optimized prediction method,https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.htm)对 Dcr3的二级结构进行预测[16]。
1.3人Dcr3亲水性、可及性、柔韧性区域的预测通常预测蛋白质的亲水性、可及性、柔韧性具有多种不同的方案可供选择,各种方案各有优劣。本研究中,我们分别采用Hopp&Woods亲水性方案、Emini方案、Karplus-Schulz方案对Dcr3的亲水性、可及性和柔韧性进行预测[17]。
1.4人Dcr3抗原位点的预测及B细胞优势抗原表位采用Jameson-wolt方案对Dcr3抗原性位点进行预测。综合各种分析方法的结果,亲水性强,表面可及性,柔韧性高,抗原指数高的肽段有可能是B细胞优势抗原表位[17]。
2结果
2.1人Dcr3的二级结构预测结果用SOPMA方法预测的Dcr3的二级结构见图2。预测结果显示,Dcr3的二级结构由无规则卷曲(43.00%)、β折叠(10.33%)、α螺旋(36.33%)和β转角(10.33%)构成。β转角和无规则卷曲主要在第18-26,30-40,41-44,59-77,143-174,186-191,195-208,237-249,266-269,297-300区段。

图2 预测的人Dcr3蛋白结构
2.2Dcr3的亲水性、可及性及柔韧性区域的预测结果采用Hopp&Woods的氨基酸亲水性标准对Dcr3的亲水性进行分析,所得结果如图3所示。氨基酸亲水性较高的区域包括2-5,33-36,43-52,64-72,90-94,99-108,112-120,166-177,209-219,229-235,241-244,250-254,259-267,285-300。采用Emini方法对Dcr3的表面可及性区域进行预测,所得结果如图4。其可及性较高的区域包括37-48,65-70,78-85,101-106,112-115,146-153,165-177,189-193,231-236,243-253,260-265,294-299。采用Karplus-Schulz方案对Dcr3的柔韧性进行预测,预测结果如图5所示。其中,1-8,31-35,39-46,53-77,96-102,133-136,141-165,183-189,202-211,238-249,258-263,286-295。
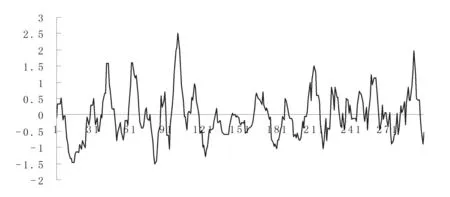
图3 Dcr3的亲水性预测

图4 Dcr3的可及性预测

图5 Dcr3的柔韧性预测
2.3Dcr3的抗原位点预测及B细胞优势表位分析采用Jameson-Wolf方案对Dcr3抗原性位点进行预测,结果如图6。Dcr3可能的抗原位点是2-8, 31-46, 59-77, 86-91, 95-103, 109-116, 131-135, 143-150, 160-173, 184-190, 204-211, 225-230, 238-250, 256-261, 284-295。虽然上述各方案预测的区间不同,但存在一些共同的区间,如56-67(TFVQRPCRRDSP), 93-101(VLCGEREEE), 156-167(GTFSASSSSSEQ), 255-261(LKLRRRL), 286-293(PGLERSVR),这些肽段有可能是B细胞优势抗原表位。

图6 Dcr3抗原性预测
3讨论
肿瘤坏死因子及其受体超家族对哺乳动物免疫系统具有重要的调节作用。TNFRSF至少有19个成员,大多数成员通过与配体特异性结合而介导增生/凋亡等重要的生理反应。Dcr3是TNFRSF中重要成员,它与“配体”的结合不具有严格的特异性[18]。由于Dcr3是一种可溶性蛋白,不具有信号转导功能,因而当其结合“配体”后,可以阻断“配体”的作用,具有广泛的病理生理学用。研究表明,Dcr3与肿瘤、自身免疫病等炎性疾病密切相关[4]。为了明确Dcr3的功能特性,以及通过基因工程的方法人工制备其变异体可能用于相关疾病的治疗,有必要确定其与“配体”结合的残基。而表位特异性的抗体是实现此目标的重要工具之一。表位是抗原分子中能特异性结合抗原的特殊化学基团。一个蛋白质中的氨基酸残基能否诱导机体产生抗体与它是否在蛋白质表面、是否具有与抗体结合的空间有关。近年来,计算机技术的发展,使得人们可以预测蛋白中的B细胞表位。目前,有多种方案可以预测蛋白质的B细胞表位,主要有二级结构、亲水性、表面可及性、柔韧性、抗原性等[19]。
由于α螺旋和β折叠化学键的键能比较高, 对于蛋白质高级结构的维持起重要作用, 同时它们与抗体嵌合比较困难, 并且它们经常处于蛋白质的内部, 因而该区域几乎不可能成为抗原表位;而β 转角及无规则卷曲结构等柔韧性比较松散,容易发生扭曲,大多盘旋并展示在蛋白质的表面,易与抗体嵌合,所以它们成为抗原表位的可能性比较大[20]。由SOMPA方法预测的 Dcr3 的二级结构中,无规则卷曲与β 转角占大约53%,表明其可能存在多个抗原表位。
根据Hopp&Woods亲水性方案, Emini蛋白质的表面可能性方案和Karplus-Schulz柔韧性方案,Jameson-Wolf抗原性指数方案预测结果,进行综合评判,提示在Dcr3蛋白的56-67(TFVQRPCRRDSP) ,93-101(VLCGEREEE), 156-167(GTFSASSSSSEQ) ,255-261(LKLRRRL), 286-293(PGLERSVR)可能存在B细胞表位,且这些区域位于无规则卷角或β 转角区或其附近。
计算机辅助技术大大减少了制备单克隆抗体肽段选择的盲目性,但其预测的肽段是否是B细胞表位,尚有待进一步验证。本研究中,我们根据NCBI提供的Dcr3蛋白的氨基酸序列,利用生物信息网络资源与软件,对Dcr3的二级结构和B细胞表位就行了预测,为人工制备Dcr3表位特异性单克隆抗体肽段的选择提供了线索。
参考文献
[1]Pitti R.M,Marsters S.A,Lawrence D.A,et al.Genomic amplification of a decoy receptor for Fas ligand in lung and colon cancer[J].Nature,1998,396(6712):699-703
[2]Bai C,Connolly B,Metzker M.L,et al.Overexpression of M68/DcR3 in human gastrointestinal tract tumors independent of gene amplification and its location in a four-gene cluster[J].Proc Natl Acad Sci U S A,2000,97(3):1230-1235
[3]Takahama Y,Yamada Y,Emoto K,et al.The prognostic significance of overexpression of the decoy receptor for Fas ligand (DcR3) in patients with gastric carcinomas[J].Gastric Cancer,2002,5(2):61-68
[4]Lin W.W,Hsieh S.L.Decoy receptor 3:a pleiotropic immunomodulator and biomarker for inflammatory diseases, autoimmune diseases and cancer[J].Biochem Pharmacol,2011,81(7):838-847
[5]Chang Y.C,Chan Y.H,Jackson D.G,et al.The glycosaminoglycan-binding domain of decoy receptor 3 is essential for induction of monocyte adhesion[J]. J Immunol,2006,176(1):173-180
[6]You R.I,Chang Y.C,Chen P.M,et al.Apoptosis of dendritic cells induced by decoy receptor 3(DcR3)[J].Blood,2008,111(3):1480-1488
[7]Zhan C,Patskovsky Y,Yan Q,et al.Decoy strategies: the structure of TL1A:DcR3 complex[J].Structure,2011,19(2):162-171
[8]Chang P.M,Chen P.M,Hsieh S.L,et al.Expression of a soluble decoy receptor 3 in patients with diffuse large B-cell lymphoma predicts clinical outcome[J].Int J Oncol,2008,33(3):549-554
[9]Connor J.P,Felder M.Ascites from epithelial ovarian cancer contain high levels of functional decoy receptor 3 (DcR3) and is associated with platinum resistance[J].Gynecol Oncol,2008,111(2):330-335
[10]Lee C.S,Hu C.Y,Tsai H.F,et al.Elevated serum decoy receptor 3 with enhanced T cell activation in systemic lupus erythematosus[J].Clin Exp Immunol,2008,151(3):383-390
[11]Macher-Goeppinger S,Aulmann S,Wagener N,et al.Decoy receptor 3 is a prognostic factor in renal cell cancer[J].Neoplasia,2008,10(10):1049-1056
[12]McKimmie C.S,Fraser A.R,Hansell C,et al.Hemopoietic cell expression of the chemokine decoy receptor D6 is dynamic and regulated by GATA1J. J Immunol,2008,181(5):3353-3363
[13]Bamias G,Kaltsa G,Siakavellas S.I,et al.High intestinal and systemic levels of decoy receptor 3 (DcR3) and its ligand TL1A in active ulcerative colitis[J].Clin Immunol,2010,137(2):242-249
[14]Funke B,Autschbach F,Kim S,et al.Functional characterisation of decoy receptor 3 in Crohn's disease[J].Gut,2009,58(4):483-491
[15]Wang Y.L,Chou F.C,Sung H.H,et al.Decoy receptor 3 protects non-obese diabetic mice from autoimmune diabetes by regulating dendritic cell maturation and function[J].Mol Immunol,2010,47(16):2552-2562
[16]Pollastri G,Martin A.J,Mooney C,et al.Accurate prediction of protein secondary structure and solvent accessibility by consensus combiners of sequence and structure information[J].BMC Bioinformatics,2007,8:201
[17]Yao W,Li Y,Yuan J,et al.[Structure, Immunogenicity and Clinical Value of Chlamydiaphage Capsid Protein 3][J].Bing Du Xue Bao,2015,31(4):420-424
[18]Bodmer J.L,Schneider P,Tschopp J.The molecular architecture of the TNF superfamily[J].Trends Biochem Sci,2002,27(1):19-26
[19]徐凤全,王利磊.刚地弓形虫重要蛋白(或酶)的生物信息学研究进展[J].中国病原生物学杂志,2015(9):858-862
[20]高巧艳,李燕,周密,等.人白细胞介素37的二级结构及B细胞表位预测[J].中国免疫学杂志,2014(5):648-650-653
(岳静玲编辑)
读者·作者·编者
计量资料中有效数字的确定

Prediction of secondary structure and B-cell epitope of decoy receptor 3
LIUXiaoliang
(ShanxiMedicalUniversityFenyangCollege,ShanxiLvliang032200,China)
[ABSTRACT]ObjectivePrediction the secondary structure and B-cell epitope of Dcr3(decoy receptor 3).MethodsThe amino acid sequence of Dcr3 protein was retrieved by NCBI protein database.Based on this,the secondary structure was predicted by online service SOPMA;We use software of Lasergene for hydrophilicity,flexibility,accessibility index.Combined the results,we predicted the B cell epitopes of Dcr3.ResultsThe second structure of Dcr3 contained random coil(43.00%),extended strand(10.33%),alpha helix(36.33%),beta turn(10.33%),and the most possible epitopes of Dcr3 were located in 56-67(TFVQRPCRRDSP),93-101(VLCGEREEE),156-167(GTFSASSSSSEQ),255-261(LKLRRRL),286-293(PGLERSVR).ConclusionThese results provide a theory basis for developing epitope-specific monoclonal antibodies against Dcr3.
[KEYWORDS]Dcr3.Secondary structure.B-cell epitope
[中图分类号]R 392
[文献标识码]A
[文章编号]2095-2694(2016)02-92-04
【作者简介】刘晓梁(1985-),男,医学硕士,助教。研究方向:肿瘤免疫。
