中国移植器官保护专家共识(2016版)
2016-04-20中国医师协会器官移植医师分会
中国医师协会器官移植医师分会
中华医学会外科学分会器官移植学组
中国肝移植注册中心科学委员会
·专家共识·
中国移植器官保护专家共识(2016版)
中国医师协会器官移植医师分会
中华医学会外科学分会器官移植学组
中国肝移植注册中心科学委员会
1 前 言
器官移植是目前治疗终末期脏器功能衰竭最为有效的手段。研究表明,供器官获取、保存及移植后缺血再灌注损伤是影响移植预后的重要因素[1]。自20世纪中期起,各研究中心不断研发、改进器官保存液,如Collins液、UW(the University of Wisconsin)液、HTK(histidine-tryptophan-ketoglutarate)液等相继问世,促进了基于器官保存液的静态冷保存(static cold storage,SCS)技术的迅速发展,使器官保存进一步摆脱了时间及地域限制,器官保护技术进入崭新的纪元,极大推动了器官移植事业的进步[2]。SCS仍是目前器官保存最常用的技术,为全球多数器官移植中心广泛使用。目前,公民逝世后器官捐献已成为我国器官移植供器官的主要来源。然而捐献器官本身以及较长的热缺血、冷缺血时间,导致缺血再灌注损伤(ischemic reperfusion injury,IRI)更为严重,显著影响移植预后。因此,如何改善供器官质量尤为重要[3]。近年来,新兴的机械灌注技术应用于器官保存与修复,但受压力、灌流速度、氧合情况等参数综合影响,其广泛应用还需大量多中心临床试验验证[4]。
目前,国内外各移植中心对不同器官保护的流程标准不一,器官保护技术方法的应用缺乏统一的规范、指南,在国家卫生和计划生育委员会支持下,中国医师协会器官移植医师分会、中华医学会外科学分会器官移植学组及中国肝移植注册中心科学委员会组织专家,基于国内外移植器官保护的基础与临床实践,编写《中国移植器官保护专家共识(2016版)》,重点介绍肝脏、肾脏、胰腺、小肠、心脏、肺脏器官保护相关技术及方法的共识,旨在更规范、有效、安全地指导器官移植工作。本共识依据的循证医学证据分级,主要参考2009 年牛津循证医学中心证据分级,推荐意见强度主要参考“推荐分级的评估、制定与评价(Grades of Recommendation, Assessment, Development, and Evaluation,GRADE)”系统[5-6](见表1)。
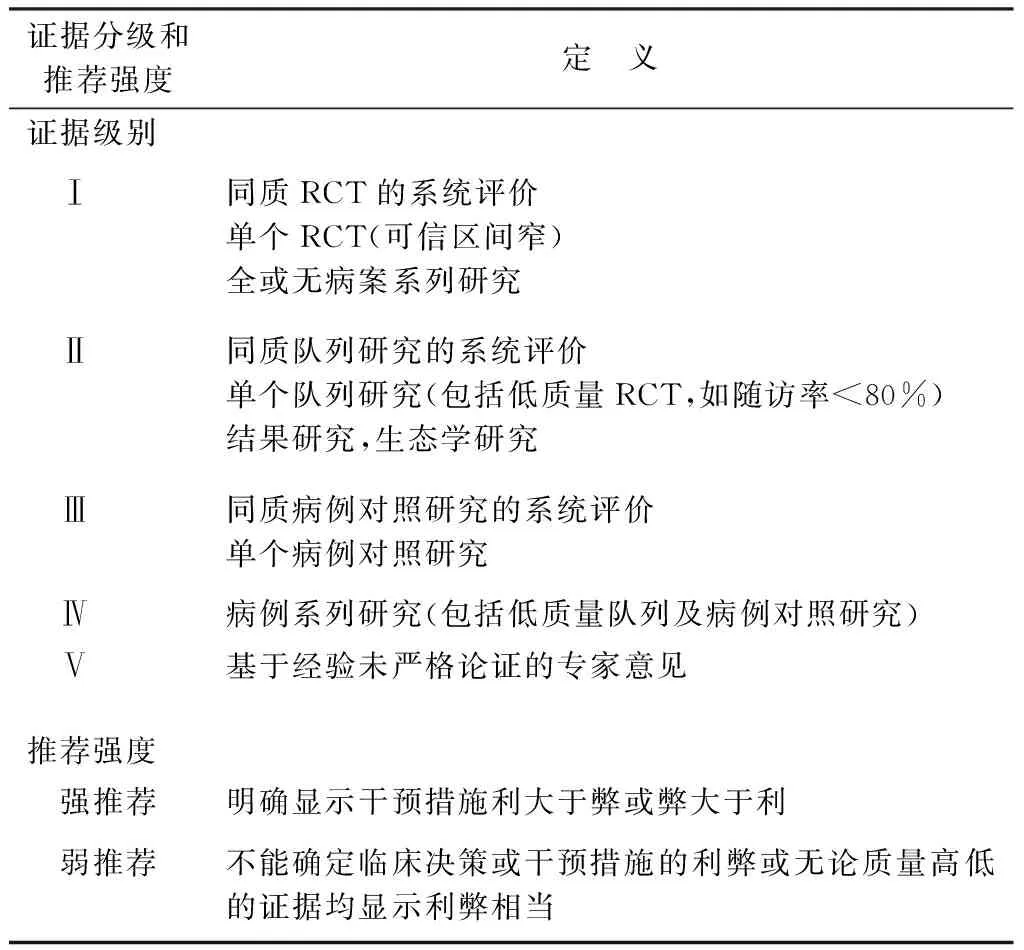
表1 循证医学证据分级和推荐强度
注: RCT. 随机对照试验
2 腹部器官获取与供器官保护
热缺血损伤与供器官质量密切相关,而热缺血时间是衡量热缺血损伤最直接的指标。热缺血时间延长会继发术后移植物失功和肝移植后胆道狭窄等并发症[7],故器官获取时须尽量减少热缺血时间。目前热缺血时间普遍定义为,从功能性热缺血[收缩压持续(至少2 min)低于50 mmHg(1 mmHg=0.133 kPa,下同)或血红蛋白氧饱和度低于70%]开始直至冷保存液开始灌洗[8-9]。各个脏器对热缺血时间耐受程度略有不同,一般认为供肝<30 min,供肾<60 min[10-11]。
腹部供器官获取一般采用基于原位冷灌注的快速腹部器官获取技术,特点是降温迅速可靠,主要步骤为:在器官表面冷却的同时行主动脉插管,后采用2~4 ℃保存液进行器官灌洗。各器官灌洗技术具有一定差异,如肝脏获取时需行门静脉和主动脉灌洗,小肠获取保存时需行血管和肠管双重灌洗。器官获取后将其置入盛有冷保存液的无菌袋中,由器官转运箱转运。器官获取过程应尽可能迅速,尽量缩短热缺血时间,必要时保存液内加入肝素、地塞米松以及抗生素等[12]。此外,获取及修整器官时,操作需轻柔细致避免机械损伤,供肝获取时要注意保护胆管血供,对胆总管周围组织不宜游离过多避免术后胆道缺血性损伤等并发症发生[13]。对于心脏死亡器官捐献(donation after cardiac death,DCD)及脑死亡器官捐献(donation after brain death,DBD),此类器官获取涉及供者生命支持撤除,部分移植中心采用在体体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)支持可改善移植预后[12];其后续器官获取的方法与前述类似,但更强调抗凝,灌洗液需预冷,可加入肝素和纤维蛋白溶解剂如链激酶、重组组织型纤维蛋白酶原激活剂[14]。
2.1 肝脏保存修复
供肝质量的优劣直接关系到受者移植手术的成功率及预后。目前一般通过供者年龄、体质量、肝脏酶学指标、胆红素水平、肝脏影像学检查、血清钠、血清肌酐、ICU停留时间、冷/热缺血时间及病理学检查如脂肪变性等参数综合评价供肝质量[15]。
供肝的保存效果直接影响供肝质量,目前SCS和机械灌注两种方式均应用于肝脏获取后的保存及修复。SCS是目前肝脏保存应用最广泛的方法,UW液和HTK液是目前国际上应用最广泛的冷保存液,两种溶液对于供肝短时间保存效果相当[16]。其他保存液如IGL(Institute Georges Lopez)-1液,Leeds液、Polysol液和Celsior液等虽各有优点,但临床效果有待进一步评价[17-18]。理论上UW液可保存供肝20~24 h,但SCS过程中存在冷保存损伤,冷保存时间过长即冷缺血时间延长可以引起胆道并发症、移植物失功甚至受者死亡。理想供肝冷保存时间不超过8 h,临床实践中供肝的保存时间一般不超过12~15 h[11, 19]。机械灌注是新兴的供肝保存与修复技术,其通过器官固有血管系统插管予以连续动态灌注输送养分供给,同步实现器官保存与修复。该项技术对延长器官保存时限、改善器官质量具有重要价值。根据灌注过程中维持温度不同,可以分为低温(4~6 ℃)机械灌注(hypothermic machine perfusion, HMP)[20]、亚低温(20 ℃)机械灌注[21]和常温(32~37 ℃)机械灌注(normothermic machine perfusion,NMP)[22],根据是否携带氧气可分为携氧灌注系统与非携氧灌注系统。目前低温非携氧机械灌注有Lifeport肝脏修复系统(美国Organ Recovery Systems公司),NMP有OrganOx系统(英国OrganOx公司)及多功能机械灌注Liver Assist系统(荷兰Organ Assist公司),多处于临床前阶段,国内相关设备尚处于研发阶段[23]。国外已有基于体外器官获取系统(Extra-Corporal Organ Procurement System,ECOPS)设备(荷兰Organ Assist公司)的低温携氧灌注系统(hypothermic oxygenated perfusion,HOPE)应用于临床肝移植的报道,证实其对DCD供肝有保护作用[20]。Ⅰ期临床试验证实NMP能有效改善肝移植术后7 d肝功能[22]。机械灌注为供肝保存修复提供了新思路,且保存及转运过程中可实时监测肝功能、胆汁分泌等指标,动态评价供肝质量。随着研发技术的进步与完善,机械灌注将具有重要的临床应用前景[20]。腹部器官获取及肝脏保存修复共识推荐意见见表2。
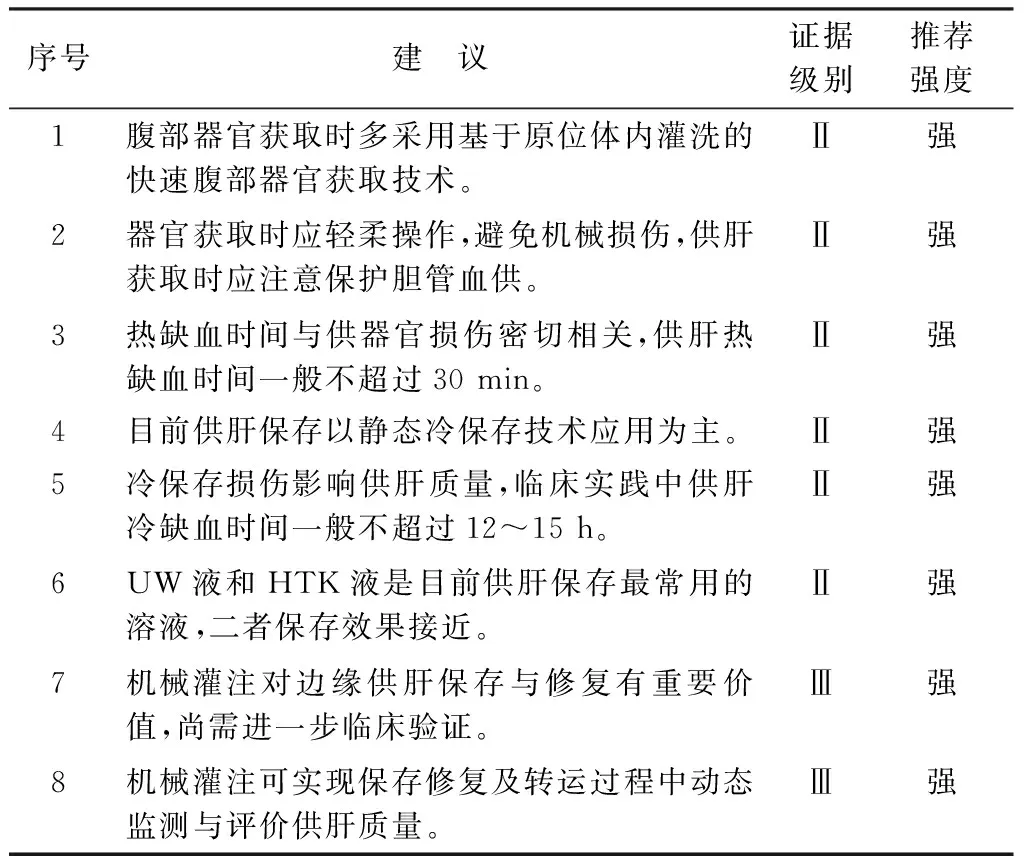
表2 腹部器官获取及肝脏保存修复共识推荐意见
2.2 肾脏保存修复
目前,临床常用的供肾保存方式有:SCS和HMP,两种保存方式各有利弊,在器官保存效果方面也有争论[24-25]。最先尝试使用HMP是在20世纪60年代[26],之后由于UW液的出现,加之对HMP优势存在争议,HMP在肾移植中的应用研究陷入低谷。然而,随着器官短缺成为移植医学亟待解决的首要问题,边缘供肾包括DCD与扩大标准供者供肾逐渐应用于临床,与DBD供肾比较,其术后并发症发生率增高,功能恢复较差,移植肾长期生存率较低[27]。因此,常规冷保存已不能满足边缘供肾质量修复的需求,供肾机械灌注再次成为研究热点。目前,HMP在边缘供肾中应用的有效性已得到初步证实[28-29]。近年来,NMP的出现可能为边缘供肾的修复和保存提供新的途径,与SCS比较,术后受者移植肾功能延迟恢复(delayed graft function,DGF)发生率明显降低,提示其在改善热缺血损伤和抗氧化反应方面有一定价值[30]。
应用专用器官保存液,在2~4 ℃的容器中进行SCS是目前供肾保存的主要方法[31-32]。理论上,UW液可保存肾脏72 h,但由于DGF发生率与冷缺血时间直接相关,在准备充分的条件下,尽量减少冷缺血时间可提高移植效果[12, 33]。
目前,移植肾冷保存液主要包括UW液、HTK液和高渗枸橼酸盐嘌呤(hypertonic citrate adenine,HCA)液。对于长时间的供肾保存,UW液与HTK液的保存效果存在争议,有研究认为UW液优于HTK液,也有文献认为二者保存效果相近[34-36]。HCA液具有配置简单、价格便宜等特点,可安全保存肾脏24 h,而其更新换代产品HCA-2保存液可保存肾脏48 h[37]。
肾脏HMP主要包括Lifeport肾脏修复系统(美国Organ Recovery Systems公司)、脉冲式灌注泵RM3系统(美国Waters Medical Systems公司)和Kidney Assist设备(荷兰Organ Assist公司)。自HMP问世以来,肾脏保存方式的选择一直是争论的焦点[38-40]。理论上,HMP具有保持血管通畅、提供部分能量和氧气、清除代谢废物等优势[26]。大量基础与临床研究证实,HMP可显著降低肾移植术后DGF的发生率,减少受者住院费用并减轻医疗痛苦与负担,然而DGF的发生与受者长期生存时间无直接相关。目前,尚无肾脏携氧HMP的临床报道。
肾脏低温机械灌注液主要为KPS-1(kidney preservation solution-1,即UW-G)液和HTK液。KPS-1为国际公认、规范、标准的肾脏机械灌注液,在国内也得到广泛使用[41]。灌注压、流量、阻力系数和温度是肾脏HMP系统的主要参数,可作为评价供肾质量的部分依据。Lifeport肾脏修复系统中,高阻力系数为肾脏质量低的独立危险因素,单肾灌注压为30~50 mmHg的情况下,灌注流量应大于40 mL/min;高灌注压较低灌注压更有可能对肾脏产生灌注损伤。研究表明,肾脏平均流量大于1.56 mL/min,阻力系数低于0.27 mmHg·mL-1·min-1时(按100 g肾脏质量计算),可能提示移植肾术后无DGF的发生。但是,不能单纯依据这些参数决定供肾的使用或废弃,应结合临床综合考虑[42-43]。尽管HMP修复移植肾机制未完全明晰,但诸多研究证实,在灌注充分的情况下(流量、阻力系数符合标准,灌注参数稳定),尽量减少冷缺血时间及灌注压力对移植肾术后功能恢复有积极作用[44-45]。肾脏保存修复共识推荐意见见表3。
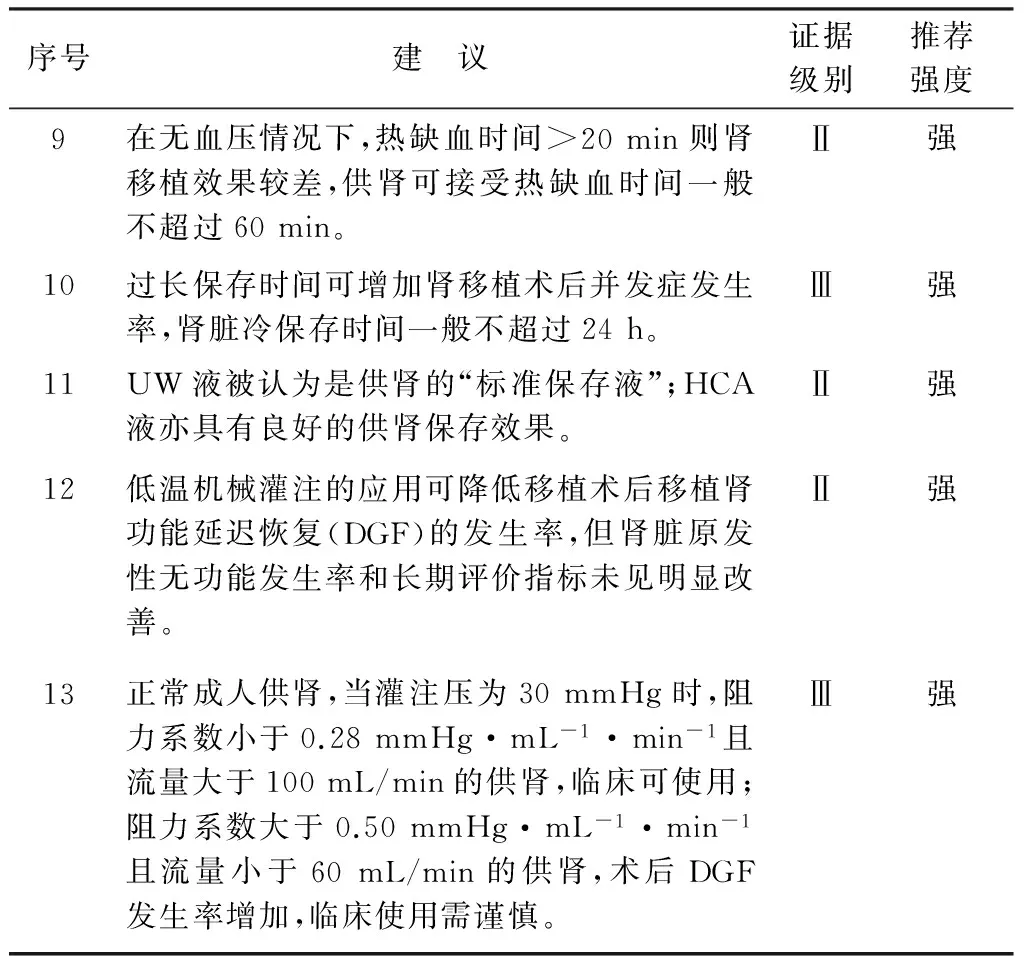
表3 肾脏保存修复共识推荐意见
注: 1 mmHg=0.133 kPa
2.3 胰腺保存修复
目前胰腺移植和胰岛移植手术主要应用于Ⅰ型及部分Ⅱ型糖尿病患者[46-47]。胰腺对热缺血极为敏感,热缺血时间与移植后并发症发生率呈正相关,当热缺血时间超过30 min,胰腺功能显著降低[48]。故器官获取时应尽量减少胰腺热缺血时间[49],做到迅速、细致游离[50],控制近、远端腹主动脉和肾动脉后行插管进行在体低温、低压原位灌注[44-45]。胰腺获取后主要采用4℃左右SCS[51-52],其冷缺血时间应<12 h以保证胰腺功能[53-54]。器官保存液的选择种类较多[55-56],目前应用较多的是UW液和HTK液[57-59]。研究发现HTK液可能导致胰腺细胞水肿[60],且与移植后早期胰腺失功和移植后胰腺炎相关[61]。保存液目前首选UW液,经UW液保存的胰腺在移植术后具有较好的胰岛素分泌功能[62]。有学者采用双层法[63]或吹入法[64]提高保存液携氧能力,研究表明其可部分改善离体胰腺功能。
体外胰腺机械灌注保存与修复仍处于临床前阶段。与肝脏、肾脏相比,胰腺更易受到灌注液的压力损伤[65]。随着胰腺机械灌注技术的研发改进,其灌注效果将逐步改善。研究表明,采用低温、低流量与压力(灌注流量保持20~30 mL/min)进行灌注可取得较好的效果[66]。NMP能更好地保持体外器官的活力,但是其代谢与耗氧大大高于HMP,对灌注液的压力与携氧能力要求较高,仍有待进一步研究[67]。在胰腺体外灌注过程中,应动态监测血管阻力和相关生化指标来评价离体胰腺功能[68]。HMP胰腺最长保存时间可延长至24 h以上[68-69]。胰腺机械灌注的灌注液选择目前尚缺乏相应的对比研究报道,研究多采用通用的静态冷保存液或者血液制品进行灌注,专用机械灌注液有待于进一步的研发[68]。
胰岛移植研究表明,胰岛应在4 ℃ UW液中低温保存[70]。有学者认为,采用双层法保存胰腺或在分离胰岛时使用含氧的全氟化碳都可显著增加胰岛获取量[65],获得更好的组织功能,但依然存在争议[51],有待更多研究验证。胰腺保存修复共识推荐意见见表4。

表4 胰腺保存修复共识推荐意见
2.4 小肠保存修复
小肠移植在欧美发达国家已经成为治疗肠功能衰竭最有效的方法[71]。小肠对缺血损伤尤为敏感[72]。缺血损伤可致肠黏膜受损,肠道细菌移位至肝脏、脾脏等肠外器官导致全身感染[73],且作为一种非特异性损伤会提高移植物免疫原性,加重急、慢性排斥反应[74]。供器官保护在小肠移植中尤其重要。
目前低温灌洗及SCS是小肠获取及转运中减少小肠损伤的最重要手段[75]。与其他实质性器官不同,由于肠腔内含有大量消化酶、细菌及毒素,小肠保存时需行血管和肠管双重灌洗。小肠获取时第1次血管灌洗是有益的,不推荐保存结束前第2次血管灌洗[76]。在供肠获取时应尽量缩短热缺血时间,最长一般不超过60 min[77]。
在血管灌洗液及保存液的选择上,目前UW液应用最广泛[78],近年来HTK液的使用日益增多[79]。HTK液与UW液相比,移植术后早期生存率、肠道功能、并发症发生率无明显差异[80]。HTK液价格较UW液低,并且粘度低,更利于微血管的灌洗[81]。有研究发现,以HTK液、Celsior液和Polysol液保存的小肠,在能量代谢及病理上与UW液相比具有一定的优势[82]。但目前何种保存液更利于小肠保存仍无定论。冷保存时间是影响小肠移植预后的重要因素,目前小肠移植冷保存时间尽量控制在9 h以内[83]。临床及动物实验证实,多数小肠保存液可有效保存小肠6~8 h[84]。
体外机械灌注在小肠移植领域目前仍处于临床前阶段。1979年,Toledo等[85]首次报道了离体搏动血管灌注应用于小肠保存。2003年,Zhu等[86]开展了首例低温氧合肠腔机械灌注,发现与SCS相比能更好地保存小肠。2015年,耶鲁大学报道了一项新型的小肠保存装置,首次采用了血管与肠腔双腔灌注,使供肠病理学表现得到进一步改善[87]。小肠保存修复共识推荐意见见表5。

表5 小肠保存修复共识推荐意见
3 胸部器官获取及供器官保护
3.1 心脏保存修复
目前心脏移植供者主要选择DBD供者和脑-心双死亡器官捐献(donation after brain death awaiting cardiac death,DBCD)(中国Ⅲ类)供者,单纯的DCD供心多局限于动物实验阶段和个别临床报道。供心获取过程与供心质量密切相关,供者在确认为脑死亡或脑-心双死亡后,选择正中切口,劈开胸骨,剪开心包,阻断升主动脉后主动脉根部加压灌注4~8 ℃心肌保存液1 000 mL,表面置冰屑使心脏快速降温,同时迅速剪开右上肺静脉和下腔静脉,心脏减容减压,然后依次切断肺静脉、上下腔静脉、主肺动脉和主动脉,灌注压维持于50~70 mmHg水平。如心肺联合获取,则建议心肺胸内整体获取,不离断肺静脉,获取后根据需要整体移植或在体外行心肺分离后分别使用。研究发现供心质量与冷缺血时间相关,冷缺血时间一般不超过6 h[88]。循环稳定的DBD或DBCD供心热缺血时间相对可控,理论上热缺血时间可忽略;DCD供心热缺血时限尚无定论。
离体供心保存与修复技术有SCS、HMP和不停跳NMP保存3种。SCS在供心保存中应用广泛,离体心脏浸泡于含4 ℃保存液的容器中,在低温条件下保存并转运[88]。HMP应用机械将心肌保护液以微流量灌注冠脉系统,为心肌组织供应代谢所需营养物质,带走代谢产物,给心肌提供充足的氧供,有效地保护冠状血管内皮细胞,并使心脏均匀降温。但是Brant等[89]研究表明,无论经主动脉顺行还是经冠状静脉窦口逆行机械灌注,对供心的保存效果与Celsior液0~4 ℃ SCS类似。此外,长时间低温灌注引起的心肌组织水肿问题限制了该方法在临床中的应用。不停跳NMP是一种接近生理状态的保存方法,可使离体供心保存时间达到12 h[90]。目前,进入临床试验的不停跳NMP系统有美国的Organ Care System和LifeCradle® Heart Perfusion System。但最新的一项前瞻性随机对照试验比较了不停跳NMP和传统低温保存技术,发现在术后30 d两组受者存活和移植物功能上并无显著差别[91]。因此,不停跳NMP系统还需要进一步的研究和评估。
虽然国内外的供心保存液层出不穷,但应用最普遍的还是UW液、HTK液以及Celsior液。UW液钾浓度高,目前临床应用广泛,组织水肿发生率在机械灌注中较Celsior液低[92],但可导致心脏血管收缩;HTK液的特点是低钠、低钙、微高钾,富含的组氨酸具有较强大的缓冲能力,当长时间保存供心时,HTK液防止心肌细胞水肿效果更好;Celsior液兼具UW液的渗透功效和HTK液的缓冲能力,长时间保存供心易导致心肌水肿。目前尚无一种心肌保存液有绝对的优势[93-96]。近来出现的心肌保存液或改良保存液,如细胞外液型保存液Somah、在Celsior液基础上发展起来的CRMB(Center for Magnetic Resonance in Biology and Medicine)液以及HTK液基础上发展而来的Custodiol-N液,虽然从理论上有着更多的优势和心肌保护效果,但目前仍处于实验研究阶段,需进一步得到临床验证[3, 97-98]。心脏保存修复共识推荐意见见表6。

表6 心脏保存修复共识推荐意见
注: DBD. 脑死亡器官捐献; DBCD. 脑-心双死亡器官捐献
3.2 肺保存修复
肺移植作为治疗终末期肺部疾病的唯一有效手段,其技术已趋于成熟,但相比其他实体器官移植,临床疗效仍不理想。供肺的获取和保存直接影响供肺的质量,关系着移植成败,多种因素导致供肺利用率仅为供肾的20%[99]。近年来,随着肺移植需求日益增加和保存修复技术的发展,越来越多的边缘供肺应用于临床,并取得与理想供肺相似的效果[100-102]。
严格的供肺质量评估有助于提高移植成功率,须判定供肺是否符合移植要求以及是否行供肺离体修复。供者评估主要包括:年龄、胸部影像、动脉血气分析、支气管镜病原学检查,以及供肺切取后的直视检查和同时予以供者各系统的支持措施[103]。此外,供者死亡原因直接影响移植预后,其中以心脏外伤死亡供者供肺预后最差[102]。
供肺获取直接影响供肺质量。在供肺获取过程中尽量缩短热缺血时间,目前认为安全时间在35 min内[100]。如果为DCD供肺,在供者心跳完全停止后的10~20 min应开始灌注[104]。合理的流程和熟练的技术尤其重要,在判定供者死亡后,可快速实施机械通气、胸外按压、胸腔内灌注降温等措施,帮助缩短热缺血时间[100, 104],可同时进行支气管镜检查进一步评估供者。
充分的保存液灌注可最大限度地保护供肺。肺动脉顺行灌注加肺静脉逆行灌注方便可行,肺动脉的灌注压力10~15 mmHg,灌注量60 mL/kg;肺静脉逆行灌注每根肺静脉灌注量250 mL,灌注液温度4~8 ℃,6 h后予以再次灌注[103]。灌注时予以呼吸机维持通气,吸入氧浓度50%,呼气末正压通气 5 cmH2O(1 cmH2O=0.098 kPa,下同),压力<20 cmH2O,潮气量10 mL/kg,供肺离体保存时需维持约50%的肺充气膨胀状态[103, 105]。
供肺冷缺血时间影响预后,目前认为相对安全的冷缺血时间为<10 h,个别情况可以延长至12 h,甚至更久[106-107]。供肺离体时推荐保存温度4~8 ℃。
SCS技术作为目前广泛应用的离体肺保存技术,多种保存液已经取得较满意的效果,可分为细胞内液型(如Collins液、UW液)和细胞外液型(棉籽糖低钾右旋糖酐液、Perfadex液、Celsior液、EP-TU液等)保存液[107-109]。相比细胞内液型保存液,细胞外液型保存液中钾浓度低,避免了肺动脉收缩,可延长冷缺血时间,有更佳的氧合指数、更短的机械通气时间及术后ICU入住时间,故目前首选细胞外液型供肺保存液,其中最常用的为Perfadex液[103, 106, 109]。
供肺离体机械灌注已开始应用于临床,该技术能修复、改善供肺质量、扩大边缘供者的应用,已显示出其广阔的应用前景。目前主要为离体常温、不含红细胞的肺灌注保存修复技术,较有代表性的有EVLP(exvivolung perfusion)、OCSTMLung(Organ Care System Lung)、NRP(normothermic regional perfusion)技术。有研究表明,上述技术可以使高风险的供肺取得与理想供肺同样的效果[110-113],但仍需多中心、大样本的临床数据进一步证实。此外,低温、含红细胞等其他的肺保存修复技术亦有待进一步的基础及临床研究验证。肺保存修复共识推荐意见见表7。

表7 肺保存修复共识推荐意见
注: 1 mmHg=0.133 kPa; 1 cmH2O=0.098 kPa; DCD. 心脏死亡器官捐献; PEEP. 呼气末正压通气; R-LPD. 棉籽糖低钾右旋糖酐
《中国移植器官保护专家共识(2016版)》
编审委员会成员名单
组 长: 郑树森
副组长: 叶啟发
成 员(按姓氏汉语拼音排序):陈 实 陈静瑜 陈孝平 丁义涛 杜国盛 范晓礼
傅志仁 郭 华 耿 磊 高 峰 韩威力 何晓顺
霍 枫 贺 强 景鸿恩 李建辉 李启勇 李幼生
李玉民 李 宁 卢实春 吕国悦 吕 毅 刘永锋
刘振文 门同义 彭承宏 彭贵主 秦运升 齐海智
沈 岩 沈中阳 石炳毅 时 军 宋朋红 孙军辉
孙玉岭 屠振华 王伟林 王彦峰 王正昕 温 浩
吴 健 吴建永 吴李鸣 吴应盛 吴忠均 夏 强
夏伟良 谢海洋 徐 骁 薛武军 严 盛 严律南
杨 扬 杨富春 杨广顺 杨家印 叶啟发 叶少军
俞 军 张 峰 张 珉 张水军 张 毅 章茫里
臧运金 赵海格 赵闻雨 郑树森 周 琳 周 俭
朱继业 朱有华 朱志军 曾宪鹏
执 笔: 李建辉 徐 骁 谢海洋 王彦峰 范晓礼 贾俊君
曾宪鹏 赵海格 泮 辉 徐鸿飞 彭一帆 俞 浩
周燕飞 屠振华 陈俊杰
1 Matsuno N, Uchida K, Furukawa H. Impact of machine perfusion preservation of liver grafts from donation after cardiac death[J]. Transplant Proc, 2014,46(4):1099-1103.
2 Collins GM, Bravo-Shugarman M, Terasaki PI. Kidney preservation for transportation. Initial perfusion and 30 hours′ ice storage[J]. Lancet, 1969,2(7632):1219-1222.
3 Lowalekar SK, Cao H, Lu XG, et al. Sub-normothermic preservation of donor hearts for transplantation using a novel solution, Somah: a comparative pre-clinical study[J]. J Heart Lung Transplant, 2014,33(9):963-970.
4 Jia JJ, Li JH, Jiang L, et al. Liver protection strategies in liver transplantation[J]. Hepatobiliary Pancreat Dis Int, 2015,14(1):34-42.
5 Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies[J]. BMJ, 2008,336(7653):1106-1110.
6 Brozek JL, Akl EA, Jaeschke R, et al. Grading quality of evidence and strength of recommendations in clinical practice guidelines: Part 2 of 3. The GRADE approach to grading quality of evidence about diagnostic tests and strategies[J]. Allergy, 2009,64(8):1109-1116.
7 Taner CB, Bulatao IG, Willingham DL, et al. Events in procurement as risk factors for ischemic cholangiopathy in liver transplantation using donation after cardiac death donors[J]. Liver Transpl, 2012,18(1):100-111.
8 Ho KJ, Owens CD, Johnson SR, et al. Donor postextubation hypotension and age correlate with outcome after donation after cardiac death transplantation[J]. Transplantation, 2008,85(11):1588-1594.
9 中华医学会器官移植学分会, 中华医学会外科学分会移植学组, 中国医师协会器官移植医师分会. 中国心脏死亡捐献器官评估与应用专家共识[J/CD]. 中华移植杂志:电子版, 2014,8(3):117-122.
10 de Vera ME, Lopez-Solis R, Dvorchik I, et al. Liver transplantation using donation after cardiac death donors: long-term follow-up from a single center[J]. Am J Transplant, 2009,9(4):773-781.
11 Hong JC, Yersiz H, Kositamongkol P, et al. Liver transplantation using organ donation after cardiac death: a clinical predictive index for graft failure-free survival[J]. Arch Surg, 2011,146(9):1017-1023.
12 Reich DJ, Mulligan DC, Abt PL, et al. ASTS recommended practice guidelines for controlled donation after cardiac death organ procurement and transplantation[J]. Am J Transplant, 2009,9(9):2004-2011.
13 Kubal C, Mangus R, Fridell J, et al. Optimization of perioperative conditions to prevent ischemic cholangiopathy in donation after circulatory death donor liver transplantation[J]. Transplantation, 2016,100(8):1699-1704.
14 Hashimoto K, Eghtesad B, Gunasekaran G, et al. Use of tissue plasminogen activator in liver transplantation from donation after cardiac death donors[J]. Am Journal Transplant, 2010,10(12):2665-2672.
15 Xia W, Ke Q, Wang Y, et al. Donation after cardiac death liver transplantation: Graft quality evaluation based on pretransplant liver biopsy[J]. Liver Transpl, 2015,21(6):838-846.
16 Pokorny H, Rasoul-Rockenschaub S, Langer F, et al. Histidine-tryptophan-ketoglutarate solution for organ preservation in human liver transplantation-a prospective multi-centre observation study[J]. Transpl Int, 2004,17(5):256-260.
17 Corps CL, Ahmed I, McKenzie S, et al. Functional and histological comparison of rat liver preserved in University of Wisconsin solution compared with tissue preserved in a novel solution[J]. Transplant Proc, 2010,42(9):3427-3430.
18 Yagi S, Doorschodt BM, Afify M, et al. Improved preservation and microcirculation with POLYSOL after partial liver transplantation in rats[J]. J Surg Res, 2011,167(2):e375-e383.
19 Jay C, Ladner D, Wang E, et al. A comprehensive risk assessment of mortality following donation after cardiac death liver transplant- an analysis of the national registry[J]. J Hepatol, 2011,55(4):808-813.
20 Dutkowski P, Schlegel A, de Oliveira M, et al. HOPE for human liver grafts obtained from donors after cardiac death[J]. J Hepatol, 2014,60(4):765-772.
21 Bruinsma BG, Yeh H, Ozer S, et al. Subnormothermic machine perfusion forexvivopreservation and recovery of the human liver for transplantation[J]. Am J Transplant, 2014,14(6):1400-1409.
22 Ravikumar R, Jassem W, Mergental H, et al. Liver transplantation afterexvivonormothermic machine preservation: A phase 1 (first-in-man) clinical trial[J]. Am J Transplant, 2016,16(6):1779-1787.
23 贾俊君, 李建辉, 姜骊, 等. 肝移植供肝保存新途径:机械灌注[J/CD]. 中华移植杂志:电子版, 2014,8(3):164-168.
24 Moers C, Smits JM, Maathuis MH, et al. Machine perfusion or cold storage in deceased-donor kidney transplantation[J]. N Engl J Med, 2009,360(1):7-19.
25 Watson CJ, Wells AC, Roberts RJ, et al. Cold machine perfusion versus static cold storage of kidneys donated after cardiac death: a UK multicenter randomized controlled trial[J]. Am J Transplant, 2010,10(9):1991-1999.
26 Belzer FO, Ashby BS, Dunphy JE. 24-hour and 72-hour preservation of canine kidneys[J]. Lancet, 1967,2(7515):536-538.
27 Locke JE, Segev DL, Warren DS, et al. Outcomes of kidneys from donors after cardiac death: implications for allocation and preservation[J]. Am J Transplant, 2007,7(7):1797-1807.
28 曾宪鹏, 叶啟发, 王彦峰, 等. 低温机械灌注与冷保存应用于心脏死亡器官捐赠供肾效果的荟萃分析[J]. 中华器官移植杂志, 2015,36(4):225-230.
29 Jiao B, Liu S, Liu H, et al. Hypothermic machine perfusion reduces delayed graft function and improves one-year graft survival of kidneys from expanded criteria donors: a meta-analysis[J]. PloS One, 2013,8(12):e81826.
30 Hosgood SA, Nicholson HF, Nicholson ML. Oxygenated kidney preservation techniques[J]. Transplantation, 2012,93(5):455-459.
31 Ploeg RJ, van Bockel JH, Langendijk PT, et al. Effect of preservation solution on results of cadaveric kidney transplantation. The European Multicentre Study Group[J]. Lancet, 1992,340(8812):129-137.
32 Suntharalingam C, Sharples L, Dudley C, et al. Time to cardiac death after withdrawal of life-sustaining treatment in potential organ donors[J]. Am J Transplant, 2009,9(9):2157-2165.
33 Bernat JL, D′Alessandro AM, Port FK, et al. Report of a National Conference on Donation after cardiac death[J]. Am J Transplant, 2006,6(2):281-291.
34 Roels L, Coosemans W, Donck J, et al. Inferior outcome of cadaveric kidneys preserved for more than 24 hr in histidine-tryptophan-ketoglutarate solution. Leuven Collaborative Group for Transplantation[J]. Transplantation, 1998,66(12):1660-1664.
35 de Boer J, De Meester J, Smits JM, et al. Eurotransplant randomized multicenter kidney graft preservation study comparing HTK with UW and Euro-Collins[J]. Transpl Int, 1999,12(6):447-453.
36 Belzer FO, Southard JH. Principles of solid-organ preservation by cold storage[J]. Transplantation, 1988,45(4):673-676.
37 Sui M, Zhang L, Yang J, et al. A new HC-A Ⅱ solution for kidney preservation: A multi-center randomized controlled trial in China[J]. Ann Transplant, 2014,19:614-620.
38 Halloran P, Aprile M. A randomized prospective trial of cold storage versus pulsatile perfusion for cadaver kidney preservation[J]. Transplantation, 1987,43(6):827-832.
39 Rosenthal JT, Herman JB, Taylor RJ, et al. Comparison of pulsatile machine perfusion with cold storage for cadaver kidney preservation[J]. Transplantation, 1984,37(4):425-426.
40 Jaffers GJ, Banowsky LH. The absence of a deleterious effect of mechanical kidney preservation in the era of cyclosporine[J]. Transplantation, 1989,47(4):734-736.
41 Polyak MM, Arrington BO, Stubenbord WT, et al. The influence of pulsatile preservation on renal transplantation in the 1990s[J]. Transplantation, 2000,69(2):249-258.
42 钟自彪, 叶啟发, 范林, 等. 应用机械灌注保存心脏死亡器官捐献供肾的效果分析[J/CD]. 中华移植杂志:电子版, 2013,7(1):1-5.
43 Nyberg SL, Baskin-Bey ES, Kremers W, et al. Improving the prediction of donor kidney quality: deceased donor score and resistive indices[J]. Transplantation, 2005,80(7):925-929.
44 Vaziri N, Thuillier R, Favreau FD, et al. Analysis of machine perfusion benefits in kidney grafts: a preclinical study[J]. J Transl Med, 2011,9:15.
45 Irish WD, Katz E. Cold machine perfusion or static cold storage of kidneys: why the debate continues[J]. Am J Transplant, 2010,10(9):1955-1956.
46 Kerr HR, Hatipoglu B, Krishnamurthi V. Pancreas transplant for diabetes mellitus[J]. Cleve Clin J Med, 2015,82(11):738-744.
47 Orlando G, Stratta RJ, Light J. Pancreas transplantation for type 2 diabetes mellitus[J]. Curr Opin Organ Transplant, 2011,16(1):110-115.
48 Tanioka Y, Hering BJ, Sutherland DE, et al. Effect of pancreatic warm ischemia on islet yield and viability in dogs[J]. Transplantation, 1997,64(12):1637-1641.
49 Fridell JA, Powelson JA, Kubal CA, et al. Retrieval of the pancreas allograft for whole-organ transplantation[J]. Clin Transplant, 2014,28(12):1313-1330.
50 Taylor MJ, Baicu S, Greene E, et al. Islet isolation from juvenile porcine pancreas after 24-h hypothermic machine perfusion preservation[J]. Cell Transplant, 2010,19(5):613-628.
51 Baertschiger RM, Berney T, Morel P. Organ preservation in pancreas and islet transplantation[J]. Curr Opin Organ Transplant, 2008,13(1):59-66.
52 Squifflet JP, LeDinh H, de Roover A, et al. Pancreas preservation for pancreas and islet transplantation: a minireview[J]. Transplant Proc, 2011,43(9):3398-3401.
53 Vrakas G, Arantes RM, Gerlach U, et al. Solitary pancreas transplantation: a review of the UK experience over a period of 10 yr[J]. Clin Transplant, 2015,29(12):1195-1202.
54 Alexander M, Krishnan R, Buder B, et al. Impact of hypothermic preservation on tissue yield and viability in pig pancreata[J]. Transplant Proc, 2014,46(6):1975-1977.
55 Fridell JA, Mangus RS, Powelson JA. Organ preservation solutions for whole organ pancreas transplantation[J]. Curr Opin Organ Transplant, 2011,16(1):116-122.
56 Noguchi H, Naziruddin B, Onaca N, et al. Comparison of modified Celsior solution and M-kyoto solution for pancreas preservation in human islet isolation[J]. Cell Transplant, 2010,19(6):751-758.
57 Schneeberger S, Biebl M, Steurer W, et al. A prospective randomized multicenter trial comparing histidine-tryptophane-ketoglutarate versus University of Wisconsin perfusion solution in clinical pancreas transplantation[J]. Transpl Int, 2009,22(2):217-224.
58 Paushter DH, Qi M, Danielson KK, et al. Histidine-tryptophan-ketoglutarate and University of Wisconsin solution demonstrate equal effectiveness in the preservation of human pancreata intended for islet isolation: a large-scale, single-center experience[J]. Cell Transplant, 2013,22(7):1113-1121.
59 Becker T, Ringe B, Nyibata M, et al. Pancreas transplantation with histidine-tryptophan-ketoglutarate (HTK) solution and University of Wisconsin (UW) solution: is there a difference?[J]. JOP, 2007,8(3):304-311.
60 Potdar S, Malek S, Eghtesad B, et al. Initial experience using histidine-tryptophan-ketoglutarate solution in clinical pancreas transplantation[J]. Clin Transplant, 2004,18(6):661-665.
61 Alonso D, Dunn TB, Rigley T, et al. Increased pancreatitis in allografts flushed with histidine-tryptophan-ketoglutarate solution: a cautionary tale[J]. Am J Transplant, 2008,8(9):1942-1945.
62 Esmaeilzadeh M, Fonouni H, Golriz M, et al. Evaluation of the modified HTK solution in pancreas transplantation-An experimental model[J]. Asian J Surg, 2016,39(2):66-73.
63 Li X, Zhang J, Sang L, et al. Influence of the two-layer preservation method on human pancreatic islet isolation: a meta-analysis[J]. Int J Artif Organs, 2015,38(3):117-125.
64 Scott WE 3rd, Weegman BP, Ferrer-Fabrega J, et al. Pancreas oxygen persufflation increases ATP levels as shown by nuclear magnetic resonance[J]. Transplant Proc, 2010,42(6):2011-2015.
65 Iwanaga Y, Sutherland DE, Harmon JV, et al. Pancreas preservation for pancreas and islet transplantation[J]. Curr Opin Organ Transplant, 2008,13(4):445-451.
66 Leeser DB, Bingaman AW, Poliakova L, et al. Pulsatile pump perfusion of pancreata before human islet cell isolation[J]. Transplant Proc, 2004,36(4):1050-1051.
67 Valero R, Cabrer C, Oppenheimer F, et al. Normothermic recirculation reduces primary graft dysfunction of kidneys obtained from non-heart-beating donors[J]. Transpl Int, 2000,13(4):303-310.
68 Kuan KG, Wee MN, Chung WY, et al. Extracorporeal machine perfusion of the pancreas: technical aspects and its clinical implications—a systematic review of experimental models[J]. Transplant Rev, 2016,30(1):31-47.
69 Taylor MJ, Baicu S, Leman B, et al. Twenty-four hour hypothermic machine perfusion preservation of porcine pancreas facilitates processing for islet isolation[J]. Transplant Proc, 2008,40(2):480-482.
70 Liu F, Tian W, Yang Y, et al. Optimal method for short-term or long-term islet preservation: comparison of islet culture, cold preservation and cryopreservation[J]. J Artif Organs, 2014,17(4):337-343.
71 Iyer KR. Surgical management of short bowel syndrome[J]. JPEN J Parenter Enteral Nutr, 2014,38(1 Suppl):53s-59s.
72 Park PO, Haglund U, Bulkley GB, et al. The sequence of development of intestinal tissue injury after strangulation ischemia and reperfusion[J]. Surgery, 1990,107(5):574-580.
73 Cicalese L, Sileri P, Green M, et al. Bacterial translocation in clinical intestinal transplantation[J]. Transplantation, 2001,71(10):1414-1417.
74 Kawai M, Kitade H, Koshiba T, et al. Intestinal ischemia reperfusion and lipopolysaccharide transform a tolerogenic signal into a sensitizing signal and trigger rejection[J]. Transplantation, 2009,87(10):1464-1467.
75 Abu-Elmagd K, Fung J, Bueno J, et al. Logistics and technique for procurement of intestinal, pancreatic, and hepatic grafts from the same donor[J]. Ann Surg, 2000,232(5):680-687.
76 Müller AR, Nalesnik M, Platz KP, et al. Evaluation of preservation conditions and various solutions for small bowel preservation[J]. Transplantation, 1994,57(5):649-655.
77 Ramisch D, Rumbo C, Echevarria C, et al. Long-term outcomes of intestinal and multivisceral transplantation at a single center in argentina[J]. Transplant Proc, 2016,48(2):457-462.
78 Abu-Elmagd K, Reyes J, Bond G, et al. Clinical intestinal transplantation: a decade of experience at a single center[J]. Ann Surg, 2001,234(3):404-416; discussion 416-417.
79 Abu-Elmagd KM, Costa G, Bond GJ, et al. Five hundred intestinal and multivisceral transplantations at a single center: major advances with new challenges[J]. Ann Surg, 2009,250(4):567-581.
80 Mangus RS, Tector AJ, Fridell JA, et al. Comparison of histidine-tryptophan-ketoglutarate solution and University of Wisconsin solution in intestinal and multivisceral transplantation[J]. Transplantation, 2008,86(2):298-302.
81 Nickkholgh A, Contin P, Abu-Elmagd K, et al. Intestinal transplantation: review of operative techniques[J]. Clin Transplant, 2013,27(Supple 25):56-65.
82 Wei L, Hata K, Doorschodt BM, et al. Experimental small bowel preservation using Polysol: a new alternative to University of Wisconsin solution, Celsior and histidine-trytophan-ketoglutarate solution?[J]. World J Gastroenterol, 2007,13(27):3684-3691.
83 Tesi RJ, Jaffe BM, McBride V, et al. Histopathologic changes in human small intestine during storage in Viaspan organ preservation solution[J]. Arch Pathol Lab Med, 1997,121(7):714-718.
84 Roskott AM, Nieuwenhuijs VB, Dijkstra G, et al. Small bowel preservation for intestinal transplantation: a review[J]. Transplant Int, 2011,24(2):107-131.
85 Toledo-Pereyra LH, Najarian JS. Human small bowel preservation: assessment of viability during storage[J]. Bol Asoc Med P R, 1979,71(9):336-341.
86 Zhu JZ, Castillo EG, Salehi P, et al. A novel technique of hypothermic luminal perfusion for small bowel preservation[J]. Transplantation, 2003,76(1):71-76.
88 Hicks M, Hing A, Gao L, et al. Organ preservation[J]. Methods Mol Biol, 2006,333:331-374.
89 Brant SM, Rosenbaum DH, Cobert ML, et al. Effects of antegrade and retrograde machine perfusion preservation on cardiac function after transplantation in canines[J]. Transplant Proc, 2014,46(5):1601-1605.
90 Hassanein WH, Zellos L, Tyrrell TA, et al. Continuous perfusion of donor hearts in the beating state extends preservation time and improves recovery of function[J]. J Thorac Cardiovasc Surg, 1998,116(5):821-830.
91 Ardehali A, Esmailian F, Deng M, et al.Ex-vivoperfusion of donor hearts for human heart transplantation (PROCEED Ⅱ): a prospective, open-label, multicentre, randomised non-inferiority trial[J]. Lancet, 2015,385(9987):2577-2584.
92 Cobert ML, Peltz M, West LM, et al. Importance of organ preservation solution composition in reducing myocardial edema during machine perfusion for heart transplantation[J]. Transplant Proc, 2010,42(5):1591-1594.
93 Lee KC, Chang CY, Chuang YC, et al. Combined St. Thomas and histidine-tryptophan-ketoglutarat solutions for myocardial preservation in heart transplantation patients[J]. Transplant Proc, 2012,44(4):886-889.
94 George TJ, Arnaoutakis GJ, Baumgartner WA, et al. Organ storage with University of Wisconsin solution is associated with improved outcomes after orthotopic heart transplantation[J]. J Heart Lung Transplant, 2011,30(9):1033-1043.
95 Ackemann J, Gross W, Mory M, et al. Celsior versus custodiol: early postischemic recovery after cardioplegia and ischemia at 5 degrees C[J]. Ann Thorac Surg, 2002,74(2):522-529.
96 Cannata A, Botta L, Colombo T, et al. Does the cardioplegic solution have an effect on early outcomes following heart transplantation?[J]. Eur J Cardiothorac Surg, 2012,41(4):e48-e52; discussion e52-e53.
97 Loganathan S, Radovits T, Hirschberg K, et al. Effects of Custodiol-N, a novel organ preservation solution, on ischemia/reperfusion injury[J]. J Thorac Cardiovasc Surg, 2010,139(4):1048-1056.
98 Desrois M, Caus T, Belles PM, et al. Limitation of myocardial and endothelial injury of the rat heart graft after preservation with Centre de Résonance Magnétique Biologique et Médicale (CRMB) solution[J]. Transpl Int, 2008,21(3):276-283.
99 Klein AS, Messersmith EE, Ratner LE, et al. Organ donation and utilization in the United States, 1999-2008[J]. Am J Transplant, 2010,10(4 Pt 2):973-986.
100 Sanchez PG, Rouse M, Pratt DL, et al. Lung donation after controlled circulatory determination of death: a review of current practices and outcomes[J]. Transplant Proc, 2015,47(6):1958-1965.
101 Levvey BJ, Harkess M, Hopkins P, et al. Excellent clinical outcomes from a national donation-after-determination-of-cardiac-death lung transplant collaborative[J]. Am J Transplant, 2012,12(9):2406-2413.
102 Cypel M, Levvey B, Van Raemdonck D, et al. International Society for Heart and Lung Transplantation Donation After Circulatory Death Registry Report[J]. J Heart Lung Transplant, 2015,34(10):1278-1282.
103 Munshi L, Keshavjee S, Cypel M. Donor management and lung preservation for lung transplantation[J]. Lancet Respir Med, 2013,1(4):318-328.
104 Levvey BJ, Westall GP, Kotsimbos T, et al. Definitions of warm ischemic time when using controlled donation after cardiac death lung donors[J]. Transplantation, 2008,86(12):1702-1706.
105 Mascia L, Pasero D, Slutsky AS, et al. Effect of a lung protective strategy for organ donors on eligibility and availability of lungs for transplantation: a randomized controlled trial[J]. JAMA, 2010,304(23):2620-2627.
106 Ganesh JS, Rogers CA, Banner NR, et al. Does the method of lung preservation influence outcome after transplantation? An analysis of 681 consecutive procedures[J]. J Thorac Cardiovasc Surg, 2007,134(5):1313-1321.
107 王振兴, 陈静瑜, 郑明峰, 等. 肺移植供肺获取100例:冷缺血时间>6 h及肺减容对预后的影响[J]. 中国组织工程研究, 2012,16(5):835-838.
108 Marasco SF, Bailey M, McGlade D, et al. Effect of donor preservation solution and survival in lung transplantation[J]. J Heart Lung Transplant, 2011,30(4):414-419.
109 Okada Y, Kondo T. Impact of lung preservation solutions, Euro-Collins vs. low-potassium dextran, on early graft function: a review of five clinical studies[J]. Ann Thorac Cardiovasc Surg, 2006,12(1):10-14.
110 Warnecke G, Moradiellos J, Tudorache I, et al. Normothermic perfusion of donor lungs for preservation and assessment with the Organ Care System Lung before bilateral transplantation: a pilot study of 12 patients[J]. Lancet, 2012,380(9856):1851-1858.
111 Oniscu GC, Randle LV, Muiesan P, et al.Insitunormothermic regional perfusion for controlled donation after circulatory death—the United Kingdom experience[J]. Am J Transplant, 2014,14(12):2846-2854.
112 Machuca TN, Mercier O, Collaud S, et al. Lung transplantation with donation after circulatory determination of death donors and the impact ofexvivolung perfusion[J]. Am J Transplant, 2015,15(4):993-1002.
113 Cypel M, Yeung JC, Liu M, et al. Normothermicexvivolung perfusion in clinical lung transplantation[J]. N Engl J Med, 2011,364(15):1431-1440.
(本文编辑:鲍夏茜)
中国医师协会器官移植医师分会, 中华医学会外科学分会器官移植学组, 中国肝移植注册中心科学委员会. 中国移植器官保护专家共识(2016版)[J/CD]. 中华移植杂志:电子版, 2016,10(3):98-106.
10.3877/cma.j.issn.1674-3903.2016.03.002
国家863青年科学家项目(2015AA020923);国家自然科学基金(815704025, 81470891)
郑树森, 310003 杭州,浙江大学附属第一医院肝胆胰外科;卫生部多器官联合移植研究重点实验室;浙江省器官移植重点实验室 (Email: zyzss@zju.edu.cn)
2016-03-24)
