臭氧氧化有机物反应速率常数的研究
2016-04-20徐祖信曹崔文
王 赟,金 伟,徐祖信,曹崔文
(同济大学 长江水环境教育部重点实验室,上海 200092)
臭氧氧化有机物反应速率常数的研究
王 赟,金 伟,徐祖信,曹崔文
(同济大学 长江水环境教育部重点实验室,上海 200092)
摘要:指出了臭氧氧化能有效去除有机微污染物质,臭氧在二级出水和天然水体中通过链式反应产生氧化性极强的羟基自由基(·OH),然而只有很少一部分·OH用于氧化MPs,多数被复杂的有机物所捕获,故测定有机物与·OH反应的速率常数以及分析有机物在臭氧链式反应中所起的作用,对预测水体对·OH捕获能力进而优化高级氧化工艺来说很关键。综合文献总结得出了结果:有机物与·OH反应的速率常数与有机物化学特性(SUVA、FI、分子量、极性)密切相关,性质不同的有机物所起的作用也有差异。
关键词:臭氧;羟基自由基;速率常数;捕获
1引言
1.1臭氧氧化有机微污染物的研究
随着人们对饮用水水质要求的不断提高,有机微污染物质(MPs)越来越受到人们的关注。MPs主要包括农药、医学活性化合物(PhACs)、内分泌干扰物(EDCs)等[1]。这些难降解的有机物排入到环境水体中,对水生生态环境会产生不良影响,如EDCs会造成鱼类雌性化等[2]。此外,饮用水水源中的有机微污染物质是产生有害消毒副产物的潜在前驱物质[3]。研究表明目前污水处理厂的生物处理工艺只能去除部分MPs[4],而臭氧氧化技术能有效去除MPs,在合理的臭氧剂量条件下,对MPs的去除效率能达到80%以上[5]。
臭氧是一种强氧化剂,广泛应用于饮用水和污水的处理,在脱色、杀菌消毒、去除无机金属离子、去除微量有机污染物以及天然有机污染物(NOM)中都起到重要的作用[6]。臭氧主要是通过直接反应和间接反应两种途径氧化有机物。直接反应指臭氧分子的亲电特性使得其易与含有双键、活泼的芳香族有机物以及去质子化胺类直接反应,故具有较强的选择性。臭氧与有机物反应通常会生成醛和羧酸,而两者都不能再与臭氧反应,使得有机物无法完全矿化,这是臭氧应用的重要局限。间接反应指臭氧分解产生氧化性极强而无选择性的·OH,反应过程仅受·OH扩散的限制[7]。
·OH的无选择性氧化作用不单单氧化去除目标污染物质(MPs),水体当中的DOM或者EfOM和无机碳也会捕获·OH。在反硝化作用很旺盛的污水中,亚硝酸盐也被视为一种捕获剂。因此,在实际情况下,只有很少一部分·OH能与目标污染物反应,大部分都被水中的非目标捕获剂所消耗[8]。Katsoyiannis[9]准确测定DOM以及EfOM和·OH反应的速率常数,直接表征了水体的·OH捕获能力。Rosario-Ortiz[10]将有机物的物理化学特性和污水处理过程参数与测定的速率常数相结合,开发一个能够预测有机物与·OH反应速率常数的模型。
这些方法极大地提高了高级氧化工艺的设计和有机微污染物质的降解预测。鉴于有机物存在对羟基自由基氧化有机微污染物的效能的影响显著,本文对此开展综述。
1.2有机物在水中臭氧分解中的作用
臭氧在水中的分解过程十分复杂,水中O3通过链式反应产·OH已经被研究了60余年,Urs Jans[11]在总结了Staehelin及前人提出的模型基础之上得出臭氧在有机物存在条件时的分解模型1.1,根据有机物在臭氧分解过程中的作用不同,将有机物划分为直接消耗剂(M)、引发剂(I)、促进剂(F)、抑制剂(Q)四种类型。
EfOM的组分包括难降解的NOM,以及在生物处理过程中外来加入的组分(微生物代谢产物SMP)和人类活动引入的污染物[10]。DOM在地表水、地下水、饮用水以及污水中无处不在,其在AOP中承担了·OH的主要捕获物质[12]。EfOM和DOM的组分复杂,其在臭氧分解产生·OH的链反应中可能同时扮演了这四种角色。由于不同来源的污水的有机物组分不同,对应的这四种作用的大小也是有差异的。因而研究有机物与·OH的反应速率常数是很有必要的。
2速率常数的测定
2.1速率常数的测定方法
文献中报道的有机物与·OH的速率常数的测定方法有电子脉冲辐射技术和竞争动力学方法。两者的区别是·OH的产生方式不同,前者是通过电子脉冲辐射水样进而产生·OH,后者是通过外加O3或者UV、H2O2等来产生·OH,间接测定有机物与·OH的速率常数。相对而言,电子脉冲辐射技术更加直接且准确,测定速率常数的同时还可以测定DOM自由基的形成,目前已大量应用到低分子量有机物与·OH反应速率常数的测定上了[12]。
2.1.1电子脉冲辐射技术
水样经电子脉冲辐射后产生·OH、水化电子、氢原子。水样用N2O气体预处理以去除DO,且将水化电子和氢原子定量的转化成·OH。Paul Westerhoff[12]利用参与·OH氧化DOM的竞争动力学的方法来测定。
可用以下方程来表示此竞争反应:
(1)
2.1.2竞争动力学
将pCBA作为测定·OH浓度的探针物质,TBA作为与DOM竞争·OH的外来捕获剂(kOH,TBA=6×108M-1S-1)。水样预酸化通超纯氮吹脱无机碳,以排除无机碳对·OH的捕获作用。实验前用NaOH调节pH至特定值,实验中改变TBA的浓度。pCBA的降解满足伪一级反应方程,其表观速率常数为:
(2)
t为紫外照射时间,[pCBA]0和[pCBA]t分别表示的是在反应开始和紫外照射t时pCBA的浓度。在该实验条件下,pCBA的直接光解作用可以忽略不计,因此·OH是pCBA降解的唯一途径。
(3)
取倒数得:
(4)
(5)
(6)
DOM与·OH反应的速率常数即可通过式来计算了:
(7)该竞争动力学方法中使用了UV/H2O2体系产生·OH,此方法也同样适用于仅仅只有臭氧存在的情况。
2.2有关速率常数的研究
Paul Westerhoff等[12]采用电子脉冲辐射技术测定不同来源DOM与·OH反应的速率常数,测得的平均值为2.23×108M-1s-1(相当于1.9×104(mgC/L)-1s-1)。Ioannis A.Katsoyiannis等[9]采用了竞争动力学方法测定了4种自然水体中DOM和·OH反应的速率常数,测定的范围是2.0×104mgC-1s-1至3.5×104mgC-1s-1。Olya S.Keen等[13]采用了电子脉冲辐射技术,测定了取自八个污水厂的水样,测得的的平均值为2.5×108M-1s-1,比的平均值3.6×108M-1s-1小了31%。Rosario-ortiz等[10]采用电子脉冲技术测定了取自不同的污水和回用点的8种EfOM水样与·OH反应的速率常数,测得的平均值为0.86(±0.35)×109MC-1s1。Lee和von Gunten[8]报道了一种二级出水的为4.1×108M-1s-1。Nothe[14]报道了自膜生物反应器(MBR)出水的为3.6×108M-1s-1。
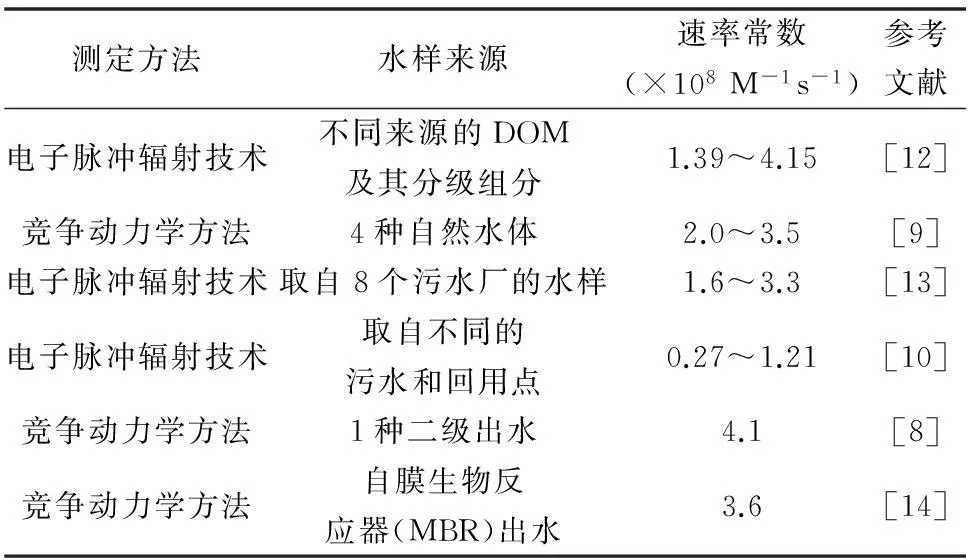
表1 速率常数根据有机物来源实验条件
因为有机物是多样化混合物,包含饱和、非饱和碳键,质子化和去质子化的羧基羟基酸、金属羰基合物、酮类、萜类、硫醇、磺酸盐酰胺等,故DOM、EfOM与·OH反应的速率数值代表的是·OH与一系列不同组分物质(具有不同的反应速率常数)的反应速率常数的平均值[12]。由表1得出不同来源的DOM、EfOM与·OH反应的速率常数存在差异,故速率常数的大小与水样的来源密切相关。
Rosario-ortiz[10]研究了八种取自不同污水处理厂和中水回用厂的二级出水。测得k·OH-EfOM与EfOM的化学特性有很强的相关性,可通过如下经验方程(包含了极性、表观分子量、荧光指数)来表示。10-9k·OH-EfOM=1.13×SUVA254+1.22×NH2RC+2.31×Fluorolndex-1.82×C18RC-0.0018×MW+4.12×d-8.90
(8)
结果k·OH,EfOM表明与SUVA254、荧光指数(FI)、重均分子量(Mw)(Da)和分散度(d)有关。此经验方程还包含两个与EfOM极性相关的指数。经过一系列的研究,结果表明分子量在预测k·OH,EfOM时起了关键作用。
Paul Westerhoff[12]分析了造成不同来源DOM速率常数差异的可能因素。研究得出k·OH,DOM与SUVA不存在关联性,而SUVA与芳香物质含量相关,故表明其研究的污水中存在的非芳香基团组分,如脂肪酸和中性组分控制了污水整体与·OH反应的速率常数值。分子量和DOM的几何构造可能造成·OH的扩散限制,因为反应中活性组分被“屏蔽”。DOM的分子量在某些情况下,会限制·OH的扩散,影响DOM与·OH的反应,降低其反应速率常数。
Dong M.M[15]研究了分子量对EfOM反应活性的影响,研究得出随着AMW的增加而减小。原水的k·OH,EfOM范围是6.32-14.1×108M-1s-1(单位是每摩尔碳每秒),分子量<1KDa组分,14.3-35.0×108M-1s-1,约是原水的2.31(±0.24)倍。分子量<3KDa、<5KDa、<10KDa的组分,对应的速率常数相对于原水的速率常数的倍数依次是1.83(±0.25)、1.32(±0.23)、1.26(±0.35)。表明EfOM中分子量较小的组分与·OH反应的活性更大。
Keen[13]分析了有机物的极性对速率常数的影响。极性疏水性部分一般含有较多的芳香基团,亲水性组分,如-OH和-COOH基团,意味着该有机物更易被氧氧化,可能很少会与·OH接触反应。该文还研究了FI值,即为Ex=370 nm处,Em=450 nm和Em=500 nm的荧光强度的比值。水样中普遍存在的化学组分(脂肪族化合物、芳香族化合物)造成的荧光信号的蓝移或者红移。来源于微生物的有机物往往包含更多的脂肪族化合物,故较高的FI值表明出现了蓝移,但是来源于植物的有机物则包含更多的芳香族化合物,FI值较低反应出现了红移,有机物来源的差异会影响k·OH,EfOM。
Dong M.M[15]指出取自不同污水处理工艺的二级出水水样,其速率常数是不同的。Keen指出[13]EfOM的主要组分SMP(微生物代谢产物)决定了EfOM与·OH反应的速率常数的大小,而泥龄会影响SMP的产生,污泥泥龄越长往往具有较高的速率常数,很可能是因为结构较大且活性不高的组分被分解成了较小的组分。故不同的污水处理工艺中特定的污水处理参数如泥龄(SRT)会影响EfOM对·OH的捕获能力。
由于污水处理工艺的不同,或天然水体的地化特性差异,导致DOM还是EfOM速率常数报道的差异性,也即是水质的差异性,如SUVA(UVA254/TOC)、分子量、荧光指数(FI)、有机物极性等,是导致EFOM和NOM在羟基自由基氧化反应中不同的活性的根本原因。
3基于有机物在臭氧分解中作用的研究
为更进一步揭示有机物(NOM和EFOM)在臭氧分解反应中的作用,Ling报道了一种测定这四种作用速率常数的方法。Ling基于有机物存在情况下水中臭氧的分解模型(图1),将·OH的瞬时模型、Rct概念以及水中臭氧分解的伪一级反应模型相结合,得到一个新的模型,则可以定量化研究有机物在臭氧分解中的作用,首先简要介绍此方法的理论背景[16]。
·OH对水中MPs的去除起了关键作用,但其瞬时稳态浓度很低,不易直接测定。Urs von Gunten[17]在1999年提出的Rct的概念,即·OH的暴露量与O3的暴露量比值随时间的变化。试验得出特定的水质条件下Rct不随时间而改变。对于给定的水质,可根据臭氧的反应动力学及Rct的概念来预测MPs经过O3直接氧化和·OH间接氧化的比例。
(9)
公式(9)为·OH的瞬间稳态模型,Ling Ping[18]将引发、促进和抑制作用结合到得到一个新的Rct表达式。该模型将臭氧反应体系中同时存在的不同种类的引发剂、促进剂和抑制剂考虑在内。
(10)
所以将(10)带入(9)中得到新的Rct公式(11)。
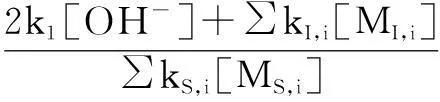
(11)
将上式取倒数,得(12)。
(12)
S指TBA,kSS指TBA与羟基自由基反应的二级速率常数(kSS=6.0×108M-1s-1[19])。根据不同浓度TBA的反应体系中Rct的不同,1/Rct与kSS[S]可以得到一条直线,斜率为1/(2k1[OH-]+kI[EfOM])截距为kS[EfOM]/2k1[OH-]+kI[EfOM],故可以得到kI和kS,即EfOM的引发和抑制速率常数。
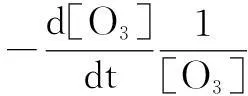
(13)
将公式(11)代入(13)中得到公式(14)。
kobs=3k1[OH-]+kD[EfOM]+kI[EfOM]+kP[EfOM]Rct
(14)
由kobs与Rct的线性关系,可得到kP,即EfOM的促进速率常数。故由上述内容,可以分别得到EfOM及其各组分的4个速率常数。
Ling[18]研究采用了上述方法测定了3种NOM(SRHA、SRFA、SAHA)四种作用的速率常数,总结如表2。由表可得,不同的NOM对应的kI值很接近,SRHA、SRFA和SAHA的kI值分别是(2.4±0.2) ×10-4、(2.0±0.6) ×10-4、(2.2±0.2) ×10-4(L(mgC)-1)s-1。说明尽管三者的化学特性和来源不同,但是每mgC/L的引发能力很相近。然而,这三者的kS值却具有较大的差异,SRHA、SRFA和SAHA的kS分别是(3.9±0.5)×103、(4.4±1.1)×103、(6.3±1.8)×103(L(mgC)-1)s-1。这表明这三种NOM在臭氧分解产生·OH的链式反应中的抑制作用有较大差异。研究表明NOM的抑制能力可能与NOM上的功能性基团如脂肪烃、羧基、酮等相关[20]。

表2 三种NOM单一组分的引发、抑制、促进、直接反应速率常数
4结语
有机物与羟基自由基反应的速率常数与有机物的来源密切相关,报道的范围是(0.27-4.15)×108M-1s-1。大量研究表明表明SUVA(UVA254/TOC)、分子量、荧光指数(FI)、有机物极性等有机物理化特性都对其有影响。根据文献中速率常数和有机物化学特性的经验公式可得,速率常数与SUVA、FI成正相关、与分子量成负相关。同时,基于有机物在臭氧分解链式反应中的作用类型,研究表明不同来源有机物所起的引发、促进、抑制作用有差异。若以提高高级氧化工艺中有机微污染物的降解效率为目标,理论上可以先对有机物进行合适的预处理,去除与·OH反应活性较大的有机物组分,或改变有机物的理化特性,因此,对于不同来源的水质,应首先确认水中有机物与臭氧反应活性及其作用类型,有针对性地选择预处理工艺或科学评估体系中有机微污染物的降解效率预测,这将有效提高高级氧化对目标有机微污染物质的降解优化污水处理工艺,优化后续臭氧氧化工艺,降低成本。
参考文献:
[1]Lee Y,Gerrity D,Lee M,et al.Prediction of Micropollutant Elimination during Ozonation of Municipal Wastewater Effluents:Use of Kinetic and Water Specific Information[J].Environmental Science & Technology,2013,47(11):5872~81.
[2]Schwarzenbach R P,Escher B I,Fenner K,et al.The challenge of micropollutants in aquatic systems[J].Science,2006,313(5790):1072~7.
[3]Kemper J M W S S,Mitch,W A.Quaternary amines as nitrosamine precursors a role for consumer products[J].EnvironSciTechnol,2010(44):1224~31.
[4]Ternes T A J,A. Human Pharmaceuticals,Hormones and Fragrances.The challenge of Micropollutants in urban water management[M].London:IWA publishing,2006.
[5]Gerrity D,Gamage S,Jones D,et al.Development of surrogate correlation models to predict trace organic contaminant oxidation and microbial inactivation during ozonation[J].Water research,2012,46(19):6257~72.
[6]Rodr Guez A,Rosal R,Perdig N-mel N J A,et al.Ozone-Based Technologies in Water and Wastewater Treatment[J].2008,5S/2(127~75).
[7]Gardoni D,Vailati A,Canziani R.Decay of Ozone in Water:A Review[J].Ozone:Science & Engineering,2012,34(4):233~42.
[8]Lee Y,Von Gunten U.Oxidative transformation of micropollutants during municipal wastewater treatment:Comparison of kinetic aspects of selective (chlorine,chlorine dioxide,ferrate(Ⅵ),and ozone) and non-selective oxidants (hydroxyl radical)[J].Water research,2010,44(2):555~66.
[9]Katsoyiannis I A,Canonica S,Von Gunten U.Efficiency and energy requirements for the transformation of organic micropollutants by ozone,O3/pO2 and UV/pO2[J].Water research,2011,45(13):3811~22.
[10]Rosario-Ortiz F L,Mezyk S P,Doud D F R,et al.Quantitative correlation of absolute hydroxyl radical rate constants with mon-isolated effluent organic matter bulk properties in water[J].Environmental Science & Technology,2008,42(16):5924~30.
[11]Jans U,Hoigne J.Activated carbon and carbon black catalyzed transformation of aqueous ozone into OH-radicals[J].Ozone-Science & Engineering,1997,20(1):67~90.
[12]Paul Westerhoff S P,Mezyk,William J.COOPER,DAISUKE MINAKATA.Electron Pulse Radiolysis Determination of Hydroxyl Radical Rate Constants with Suwannee River Fulvic Acid and Other Dissolved Organic Matter Isolates[J].EnvironSciTechnol,2007(41):4640~6.
[13]Keen O S,Mckay G,Mezyk S P,et al.Identifying the factors that influence the reactivity of effluent organic matter with hydroxyl radicals[J].Water research,2014(50):408~19.
[14]Nothe T,Fahlenkamp H,Von Sonntag C.Ozonation of Wastewater:Rate of Ozone Consumption and Hydroxyl Radical Yield[J].Environmental Science & Technology,2009,43(15):5990~5.
[15]Dong M M,Mezyk S P,Rosario-Ortiz F L.Reactivity of Effluent Organic Matter (Ef0M) with Hydroxyl Radical as a Function of Molecular Weight[J].Environmental Science & Technology,2010,44(15):5714~20.
[16]Ling Y E.WATER OZONATION AND ITS INFLUENCES ONTHE REMOVAL OF IBUPROFEN[J].2012.
[17]Elovitz M S,Von Gunten U.Hydroxyl Radical/Ozone Ratios During Ozonation Processes.I.The RctConcept[J].Ozone:Science & Engineering,1999,21(3):239~60.
[18]Yong E L,Lin Y P.Incorporation of initiation,promotion and inhibition in the Rct concept and its application in determining the initiation and inhibition capacities of natural water in ozonation[J].Water research,2012,46(6):1990~8.
[19]George V.Buxton,Clive L.Greenstock,W.Phillip Helman and Alberta B.Ross.Critical Reviewof Rate Constants for Reactions of Hydrated Electrons,Hydrogen Atoms and HydroxylRadicals (.OH/.O-) in Aqueous Solution[J].
[20]Hoignd J S A J.Decomposition of Ozone in Water in the Presence of Organic Solutes Acting as Promoters and Inhibitors of Radical Chain Reactionst[J].1985.
文章编号:1674-9944(2016)02-0080-05
中图分类号:X703
文献标识码:A
通讯作者:金伟(1970—),男,河南人,主要从事高级氧化方面的研究工作。
作者简介:王赟(1991—),女,安徽宣城人,同济大学硕士研究生。
基金项目:上海市国际科技合作基金项目(中-瑞国际合作,编号:14230710900)
收稿日期:2015-11-19
