ABCC2基因过表达细胞株的建立及鉴定
2016-04-19魏丹芸
魏丹芸,张 洪,彭 锐,张 英
(武汉大学人民医院药学部,湖北 武汉 430060)
ABCC2基因过表达细胞株的建立及鉴定
魏丹芸,张洪,彭锐,张英
(武汉大学人民医院药学部,湖北 武汉430060)
摘要:目的构建携带ABCC2基因的慢病毒载体,转染HEK293细胞,筛选出稳定过表达ABCC2基因的细胞株并进行鉴定,为体外实验确定与多药耐药相关蛋白2(MRP2)外排转运相关的底物药物及其转运机制提供细胞模型。方法根据GenBank提供的ABCC2基因cDNA序列设计引物,PCR扩增该基因并将其连接至慢病毒载体PZE-LV105,包装病毒并感染HEK293细胞。用嘌呤霉素进行筛选得到过表达ABCC2基因的稳转细胞株,通过基因测序、实时荧光定量PCR(RTQ-PCR)和蛋白免疫印迹(Western blot)对稳转细胞进行鉴定。结果测序结果证明重组慢病毒过表达载体所携带的ABCC2基因序列与GenBank提供的ABCC2序列一致;RTQ-PCR分析结果显示转染了ABCC2基因的HEK293细胞中MRP2 的mRNA相对表达比正常HEK293细胞和空白载体对照HEK293细胞高出约320倍;蛋白免疫印迹试验显示,转染了ABCC2基因的HEK293细胞中MRP2蛋白表达水平比正常HEK293细胞和空白载体对照HEK293细胞高出约150倍。结论该实验成功构建了稳定过表达ABCC2基因的细胞株,该细胞株可用于初步筛选确定MRP2的特异性外排转运底物及其转运机制。
关键词:ABCC2基因;过表达;慢病毒载体;HEK293细胞
ABCC2基因编码的蛋白质是一种ATP结合盒转运蛋白,一般称作ABCC2转运蛋白或者多药耐药相关蛋白2(MRP2)。该蛋白主要分布在肝脏、胆囊、肾脏、小肠和结肠等组织细胞[1],负责外排转运特异性底物,尤其在很多治疗性药物和有毒性外源性物质的胆汁排泄中发挥重要作用[2-4]。虽然ABCC2转运蛋白的底物化合物广泛,但其在不同的底物化合物转运中发挥作用的大小却不尽相同,因此,该转运蛋白很可能与底物药物的药效和不良反应等高度相关。目前,国内外已经有一些研究通过比较正常小鼠和ABCC2缺陷小鼠对一些药物的转运活性来确定ABCC2蛋白的特异性底物及其对药物应用的影响[5-6],然而,通过构建稳定过表达ABCC2的细胞株不仅可以直观地定量该蛋白表达水平,研究该蛋白的功能活性,减少科研成本,还可以一定程度上排除体内其他相关转运体的干扰。除此之外,构建目的基因表达沉默的重组细胞也可以从另一方面反映目的蛋白的作用。因此,本研究通过分子克隆技术,构建了稳定过表达ABCC2的HEK293细胞株,为进一步研究确定与多药耐药相关蛋白2(MRP2)外排转运相关的底物药物及其转运机制提供重要的实验工具。
1材料与方法
1.1细胞HEK293细胞(购自莱德尔生物科技有限公司);293Ta 慢病毒包装细胞系(GeneCopoeia Cat No. Clv-PK-01);GCI-L3 化学感受态细胞(GeneCopoeia Cat No. STK300-10);H1299 细胞系(ATCC Cat No.CRL-5803)。
1.2试剂PRM1640和DMEM培养基(购自美国Gibco公司);胎牛血清(Hyclone公司,Cat.No.SH30087.01);0.25%胰酶-0.125%EDTA(Gibco公司);青链霉素(Hyclone,Cat.No. SH30010);PBS磷酸钾缓冲液(Hyclone,Cat.No.SH30256.01B);嘌呤霉素(Thermo Fisher Scientific Inc公司,货号A1113802);各种限制性内切酶和T4 DNA连接酶(购自GeneCopoeia公司);Premix Prime STARHSR试剂盒、Neasy Mini Kit试剂盒和DNA凝胶回收试剂盒(购自北京全式金生物公司);HET高效转染试剂盒(深圳百恩维生物科技有限公司,货号:BW11002);SYBR Primescript RT-PCR Kit(购自大连Takara 公司);引物合成及测序(由GeneCopoeia公司完成);慢病毒载体PEZ-LV105(购自GeneCopoeia公司,Cat.No.EX-Q0603-Lv105);ABCC2抗体(购自英国ABCAM公司);二抗Rabbit Anti-Mouse IgG(H+L)-HRP (Southern biotech 货号:6170-05 );Polybrene(Sigma公司产品,Cat. No. H9268);其它化学试剂均购自国药集团化学试剂有限公司,试剂为分析纯。
1.3仪器单人超净台(AIRTECH);CB150CoZ细胞培养箱(德国Binder);CKX41倒置显微镜(Olympus);电泳仪(Power Pac Basic,美国Bio-Rad公司);高速离心机(Thermo Frescozl);Thermo落地式培养摇床Forma 481(美国Thermo公司);Odyssey infrared imaging system Odyssey双色红外激光成像系统(LI-COR);定量PCR仪(ABI PRISM 7500 Sequence Detection System);DU730核酸/蛋白分析仪(美国BECKMANCOULTER);Positive clone 测序(Genecopoeia)。
1.4重组慢病毒载体质粒的构建与鉴定
1.4.1PCR扩增人ABCC2基因根据NCBI基因库中提供的人类ABCC2基因序列(ACCESSION NO. :NM_000392)并遵照引物设计原则设计相应的引物。用于复制目的基因的PCR上游引物序列F: CTCGAG atgctggagaagttctgcaactc(大写字母代表XhoⅠ 酶切位点),下游引物序列R: TTCGAActagaattttgtgctgttcacattc(大写字母代表NSPⅤ 酶切位点)。用于检测目的基因表达的RTQ-PCR上游引物序列F:CCGTATCAGGTTTGCCAGTT,下游引物序列R:TGGAGGTGATCCAGGAAAAG。实验中作为内参的β-actin 的上游引物是:5'-ACAGAGCCTCGCCTTTGCC-3',下游引物是:5'-CATGTCGTCCCAGTTGGTG-3',引物均由GeneCopoeia公司合成。常规方法提取正常HEK239细胞中总RNA,配置反转录反应体系合成cDNA,以cDNA为模板,依照Premix Prime STARHSR试剂盒说明书配制PCR扩增体系溶液,PCR反应条件为98℃ 10 s,60℃ 10 s,72℃ 30 s,30个循环。扩增产物行1 %琼脂糖凝胶电泳,使用DNA凝胶回收试剂盒切胶回收RT-PCR产物。
1.4.2PEZ-ABCC2-LV105载体质粒的构建及鉴定用XhoⅠ和NSPⅤ 限制性内切酶对ABCC2扩增产物及PEZ-LV105质粒分别进行双酶切,酶切得到的产物通过琼脂糖凝胶电泳回收目的片段,用In-Fusion®HD EcoDryTmCloning Kit 做In-fusion连接反应,将反应体系置于37°C孵育15 min,然后50°C孵育15 min,然后置于冰上,使外源DNA片段和质粒载体进行连接。用所得连接产物转化感受态细菌GCI-L3,涂含氨苄霉素抗性平板,挑取克隆,摇菌过夜,提取质粒。重组质粒用XhoⅠ 和NSPⅤ 限制性内切酶双酶切初步鉴定后,由GeneCopoeia公司测序验证,筛选出所需的重组质粒,质粒命名为PEZ-ABCC2-LV105。
1.4.3重组慢病毒的包装与转染复苏293Ta细胞,在24孔板中以每孔2×105个细胞接种,以DMEM和胎牛血清(FBS)配制完全培养液(89%DMEM+10%FBS+1%青链霉素)。用慢病毒载体对应的慢病毒包装试剂盒将PEZ-ABCC2-LV105和包装载体共转染至293Ta细胞中。在细胞培养恒温箱中孵育48 h后吸取上清培养液,用0.45 μm 的低蛋白结合PES过滤膜过滤该培养基收集病毒上清。检测病毒滴度,分装后在-80℃冰箱保存,待用时取出融化。将人胚胎肾细胞HEK293接种于96孔板,24 h后加入包装好的重组慢病毒,再过24 h加0.25 mg·L-1的嘌呤霉素培养基于每孔,压力筛选1周,中间换液1次。1周后倒置显微镜下观察,细胞培养板上圈出每一个细胞群,标记,用0.25%胰酶消化画圈的细胞群,每一团细胞收集到新的24孔板的一个孔培养,继续用0.25 mg·L-1的嘌呤霉素压力筛选1周,做亚克隆筛选。再用倒置显微镜下观察,挑选出正常生长细胞群传代,用0.20 mg·L-1的嘌呤霉素维持1个月稳定培养,获得稳定转染重组质粒细胞株。将没有插入ABCC2基因片段的载体转染HEK293细胞后得到的细胞作为空白载体对照。
1.5ABCC2过表达细胞株的鉴定
1.5.1实时荧光定量PCR检测ABCC2 mRNA分别在6孔板中接种HEK293正常细胞、空白载体对照细胞和ABCC2过表达细胞,每孔约2×105个细胞。24 h后分别提取各自细胞组的总RNA,取1 μL RNA样品50倍稀释,在BioPhotometer plus 艾本德核酸蛋白测定仪上测定OD值,OD260/OD280的比值大于1.8,说明制备的RNA较纯,无蛋白质污染。用Primescript RT-PCR Kit将总RNA转录为cDNA。取三种细胞的cDNA 各5 μL,以之为模板进行Q-PCR,检测ABCC2 mRNA的表达量变化,确认ABCC2过表达细胞株。
1.5.2Western blotting检测MRP2蛋白的表达水平分别在6孔板中接种HEK293正常细胞、空白载体对照细胞和ABCC2过表达细胞,每孔约2×105个细胞,24 h后收集各组的细胞,分别加入RIPA裂解,并用BCA蛋白试剂盒测定样品蛋白含量。将提取好样品的蛋白溶液和上样缓冲液按2∶1混合,煮沸5 min。冷却后以12 000 rpm离心10 min(4℃)。然后在10% SDS-PAGE上电泳分离,80 V恒压50 min,120 V恒压电泳至溴酚蓝刚出胶底部止,转膜至PVDF膜上,用时120 min,电压100 mA。分别用一抗兔抗鼠ABCC2(1∶1 000)和GAPDH(1∶1 000)于4℃孵育过夜,封闭1 h,再于羊抗兔二抗中避光孵育1 h,TBST洗膜后,在奥德赛双色红外激光成像系统进行扫描分析。
2结果
2.1重组慢病毒质粒PEZ-ABCC2-LV105的鉴定RT-PCR扩增ABCC2基因开放读码框ORF序列,目的片段大小为4 638 bp,通过1%琼脂糖凝胶电泳在分子量为4 000~5 000 bp处出现清晰可见单一条带,与目的片段大小相符(图1)。用内切酶Xho Ⅰ 和NSP Ⅴ 对重组慢病毒质粒PEZ-ABCC2-LV105进行双酶切处理后,1% 琼脂糖凝胶电泳分析处理得到的产物,在分子量4 000~5 000 bp与目的片段相同位置和约8 000 bp(空载体PEZ-LV105大小8 745 bp)的位置分别出现单一条带,符合预期结果(图2)。PEZ-ABCC2-LV105经双酶切得到的目的片段经碱基测序与ABCC2 NM_000392.3序列完全一致,表明已成功构建重组慢病毒质粒PEZ-ABCC2-LV105。
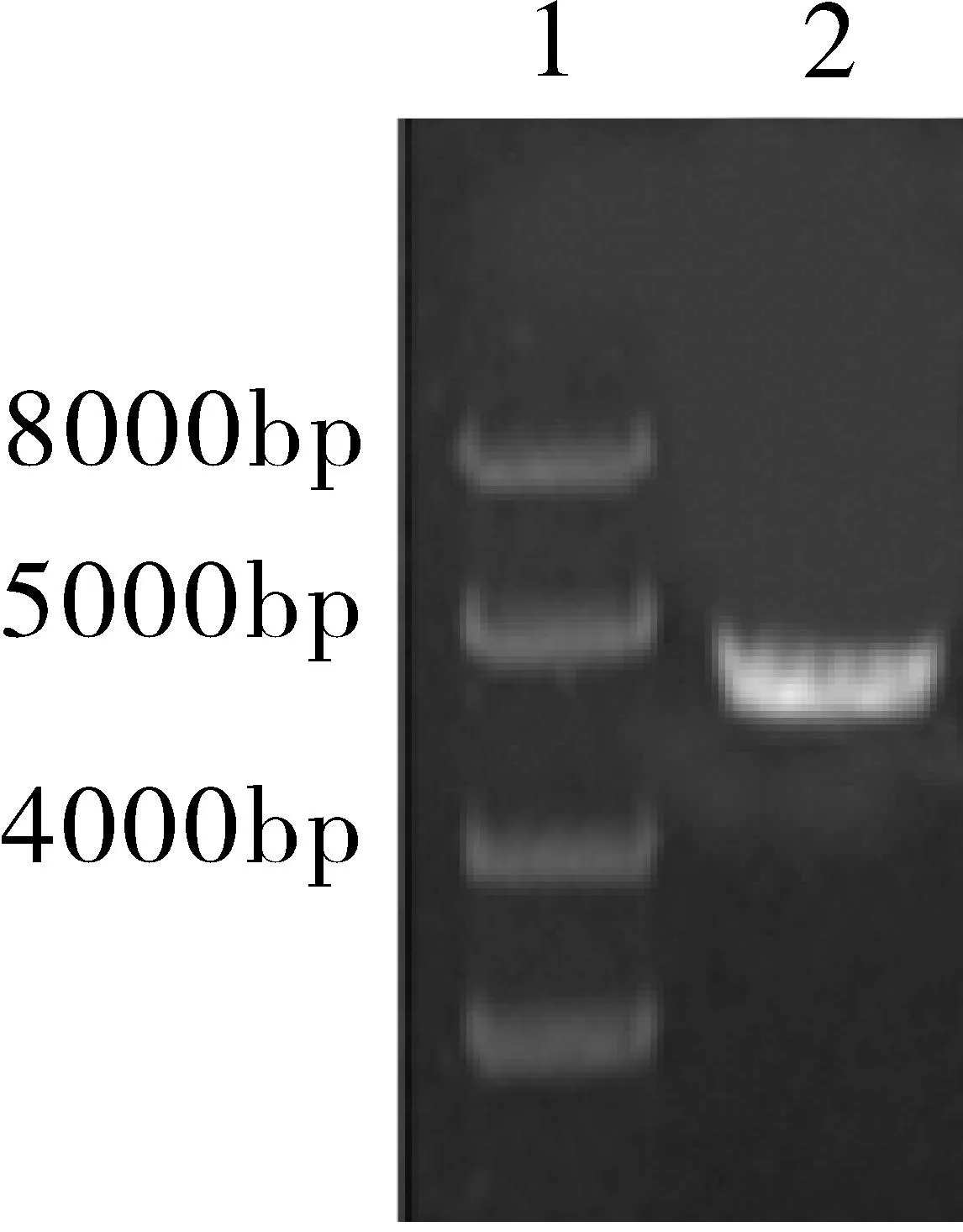
图1PCR扩增ABCC2基因电泳结果
注:1.Maker;2.ABCC2基因扩增产物。
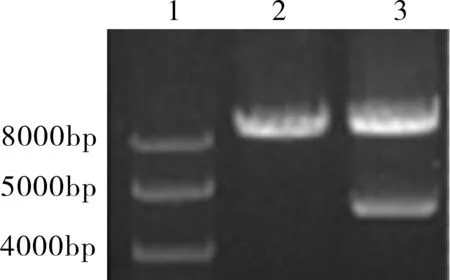
图2PEZ-ABCC2-LV105重组质粒的双酶切鉴定目的片段
注:1.Maker;2.PEZ-LV105质粒;3.PEZ-ABCC2-LV105质粒。
2.2重组质粒PEZ-ABCC2-LV105的mRNA 表达水平的检测分别从HEK293正常细胞、空白载体转染细胞和重组ABCC2过表达细胞中提取RNA,通过RT-PCR以GAPDH为内参测定ABCC2 mRNA在各细胞中的表达水平。将正常HEK293细胞的ABCC2基因表达量作为对照,数值设为1,转染了PEZ-ABCC2-LV105重组质粒的细胞中ABCC2 mRNA的表达量比正常组高出约320倍,P<0.01,结果见图3。
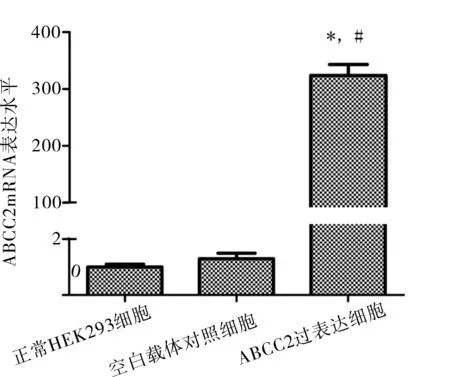
图3 RT-PCR测定各组细胞
注:与正常HEK293细胞相比,*P<0.01;与空白载体对照细胞比较,#P<0.01。
2.3Western blot检测ABCC2蛋白表达水平以GAPDH蛋白为内参,检测HEK293正常细胞、空白载体转染细胞和重组ABCC2过表达细胞中ABCC2蛋白的表达水平,结果显示转染了ABCC2基因的HEK 293细胞中ABCC2蛋白表达量相对于正常HEK293细胞显著增高(见图4a)。经归一化处理后,灰度分析结果见图4b。
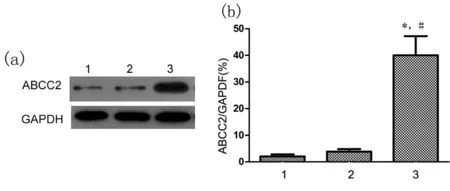
图4 Western blot检测各组
注:与正常HEK293细胞相比,*P<0.01;与空白载体对照细胞比较,#P<0.01;1.正常HEK293细胞;2.转染空载体PEZ-LV105的HEK293 细胞;3.转染PEZ-ABCC2-LV105重组质粒的HEK293细胞。
3讨论
多药耐药相关蛋白(MRP)家族是参与多相有机离子运输的主要ATP结合盒(ABC)转运蛋白家族之一[7]。虽然目前该蛋白家族为人所知的MRP1-9都被证实具有相似的蛋白序列、结构、功能和底物[8],但是因为MRP2与药物的吸收、分布和消除更为紧密相关,而且在抗癌药物耐药性产生中也扮演了重要的角色[9],所以研究其在细胞中的定位、表达和功能以及它和底物药物相互作用的机制对今后底物药物的个体化应用具有重要意义。
上述实验应用分子克隆技术构建过表达ABCC2的重组细胞,大大提高了原本在正常细胞中表达量很低的MRP2蛋白,为体外研究ABCC2的功能、底物特异性和外排转运机制等提供有效的实验手段。在构建重组细胞过程中最关键的步骤是构建重组质粒和转染HEK293细胞。因为目的基因ORF片段有4 638 bp,连接到慢病毒载体PEZ-LV105后形成12 677 bp的重组质粒,这已属于分子过大的质粒,不仅转染困难,而且还可能会影响标记基因的表达[10],因此没有再在载体质粒上连接标记绿色荧光蛋白基因,但是获得的重组慢病毒质粒转染HEK293后,通过一定浓度嘌呤霉素的筛选和单克隆,辅以碱基测序、RTQ-PCR和Western blot等实验技术的检测验证,依然可以确定稳定重组ABCC2过表达细胞株的成功构建。
目前,国内外均有应用此种技术研究ABCC2对某些特定药物转运的影响[11-13],以此进一步确定其与药物临床治疗效果(或毒性)的关联。但是转染宿主细胞多用昆虫细胞(Sf9)或者犬肾细胞(MDCK),考虑到ABCC2可能在不同物种组织细胞中表达水平和功能的差异性[14],本实验选择了人胚肾细胞(HEK293)。成功构建的稳定过表达ABCC2基因的细胞株将应用到今后体外筛选确定MRP2的特异性外排转运底物及其转运机制等研究中。
参考文献:
[1]Bandler PE,Westlake CJ,Grant CE,et al.Identification of regions required for apical membrane localization of human multidrug resistance protein 2[J].Mol Pharmacol,2008,74:9-19.
[2]Matsushima S,Maeda K,Hayashi H,et al.Involvement of multiple efflux transporters in hepatic disposition of fexofenadine[J].Mol Pharmacol,2008,73:1474-1483.
[3]Vasilyeva A,Durmus S,Li L,et al.Hepatocellular shuttling and recirculation of sorafenib-glucuronide is dependent on Abcc2,Abcc3,and Oatp1a/1b[J].Cancer Research,2015,75(13):2729-2736.
[4]Franke RM,Lancaster CS,Peer CJ,et al.Dependence of erythromycin metabolism on ABCC2 (MRP2) transport function[J].Clin Pharmacol Ther,2011,89(5):693-701.
[5]Vlaming ML,Mohrmann K,Wagenaar E,et al.Carcinogen and anticancer drug transport by Mrp2 in vivo:studies using Mrp2 (Abcc2) knockout mice[J].J Pharmacol Exp Ther,2006,318:319-327.
[6]Kranz J,Hessel S,Aretz J,et al.The role of the efflux carriers Abcg2 and Abcc2 for the hepatobiliary elimination of benzo[α]pyrene and its metabolites in mice[J].Chemico-Biological Interactions,2014,224:36-41.
[7]Keppler D.Multidrug resistance proteins(MRPs,ABCCs):importance for pathophysiology and drug therapy[J].Handb Exp Pharmacol,2011(201):299-323.
[8]Klaassen CD,Aleksunes LM.Xenobiotic,bile acid,and cholesterol transporters:function and regulation[J].Pharmacol Rev,2010,62:91-96.
[9]Perez TR.Multidrug resistance:retrospect and prospects in anticancer drug treatment[J].Curr Med Chem,2006,13:1859-1876.
[10] Yin W,Xiang P,Li Q.Investigations of the effect of DNA size in transient transfection assay using dual luciferase system[J].Analytical Biochemistry,2005,346(2):289-294.
[11] Dai PM,Zhu LJ,Yang XS,et al.Multidrug resistance-associated protein 2 is involved in the efflux of Aconitum alkaloids determined by MRP2-MDCKII cells[J].Life Sciences,2015,127:66-72.
[12] Elens L,Tyteca D,Panin N,et al.Functional defect caused by the 4544G >A SNP in ABCC2:potential impact for drug cellular disposition[J].Pharmacogenetics and Genomics,2011,21(12):884-893.
[13] Green BR,Bain LJ.Mrp2 is involved in the efflux and disposition of fosinopril[J].J Appl Toxicol,2013,33(6):458-465.
[14] Li N,Zhang YQ,Hua FM,et al.Absolute difference of hepatobiliary transporter multidrug resistance-associated protein (MRP2/Mrp2) in liver tissues and isolated hepatocytes from rat,dog,monkey,and human[J].Drug Metabolism and Disposition,2009,37:66-73.
Construction and identification of the recombinant cell line over-expressing ABCC2 gene
WEI Dan-yun,ZHANG Hong,PENG Rui,et al
(DepartmentofPharmacy,RenminHospitalofWuhanUniversity,Wuhan,Hubei430060,China)
Abstract:Objective To construct the lentiviral vecter carrying human ABCC2 gene,then to screen out the stable cell line over-expressing ABCC2 after package and transfection to HEK293 cells,thus to provide cell model to determine substrate drugs of multidrug resistance protein 2(MRP2) in vitro.Methods The primers were designed according to the cDNA sequence of ABCC2 gene from GenBank. The gene were amplified by PCR and connected to lentiviral vector PEZ-LV105. The recombined lentiviral vector was packaged and transfected to HEK293 cells. After puromycin screening,HEK293 cells over-expressing human ABCC2 gene were selected and cloned. Finally,gene sequencing,real-time quantitative PCR(RTQ-PCR)and Western blot assays were performed for identification.Results RTQ-PCR showed that the ABCC2 mRNA in HEK293 cells transfected with exogenous ABCC2 gene was about 320 times higher than that of normal HEK293 cells and blank carrier HEK293 cells. MRP2 protein level in HEK293 cells with ABCC2 gene transfection was nearly 150 times higher than that of normal HEK293 cells and blank carrier HEK293 cells according to the Western blot.Conclusions Stable recombinant cell line over-expressing ABCC2 was successfully generated. The cell line could be useful in the confirmation of substrate drugs of multidrug resistance protein 2(MRP2)and the transport mechanism in vitro.
Key words:ABCC2 gene;over-expression;lentiviral vector;HEK293 cell
(收稿日期:2015-10-09,修回日期:2015-11-23)
doi:10.3969/j.issn.1009-6469.2016.03.007
作者简介:魏丹芸,女,硕士研究生通信作者:张洪,男,教授,硕士生导师,研究方向:消化系统疾病药物的药剂学和药理学,E-mail:zhanghongwhu@163.com
