黄羽肉鸡胰蛋白酶原基因的克隆及蛋白结构预测和功能分析
2016-04-19詹湉湉许丽惠王全溪高玉云王长康
詹湉湉, 樊 倩, 张 杰, 许丽惠, 王全溪, 高玉云, 王长康
(福建农林大学动物科学学院,福建 福州 350002)
黄羽肉鸡胰蛋白酶原基因的克隆及蛋白结构预测和功能分析
詹湉湉, 樊倩, 张杰, 许丽惠, 王全溪, 高玉云, 王长康
(福建农林大学动物科学学院,福建 福州 350002)
摘要:采用分子克隆技术克隆了黄羽肉鸡胰蛋白酶原(TRY)基因,并运用多种生物信息学软件对TRY蛋白质结构和功能进行了分析和预测,研究TRY在禽类消化过程中的作用.结果表明:黄羽肉鸡TRY基因的开放阅读框全长747 bp,由248个氨基酸残基组成,其中包含15个氨基酸的信号肽(MKFLVLVAFLGVAVA)和10个氨基酸的激活肽(FPISDEDDDK);该蛋白分子质量为26.1 ku,含有信号肽,不含有糖基化位点,有11个磷酸化位点;此外,该蛋白属于疏水性蛋白,但不存在跨膜区.氨基酸序列比对的结果表明:黄羽肉鸡TRY具有丝氨酸蛋白酶的保守结构特征,如含有催化三联体氨基酸(组氨酸-64、天冬氨酸-110和丝氨酸-203);具有构成6个二硫键所需的12个半胱氨酸残基等.序列一致性分析表明,黄羽肉鸡TRY与纯种鸡的同源性最高,达98.8%.
关键词:胰蛋白酶原; 胰蛋白酶; 克隆; cDNA; 序列分析
消化与吸收是禽类获取营养物质和能量的基本途径,这一过程主要由消化酶对食物进行化学性消化来完成.消化酶的分泌直接影响动物的消化能力,限制增长率和饲料转化率[1].因而,消化酶是饲料在禽类消化道中分解和吸收的关键因素和生理基础.胰蛋白酶是属于丝氨酸蛋白家族的肽键内切酶[2],是动物消化蛋白质的重要酶类.胰蛋白酶是由一种前体物——胰蛋白酶原(trypsinogen, TRY)加工合成的[3],它是以非活性TRY的形式被合成和分泌,然后被肠激酶或已激活的TRY切割去除氨基酸的酸性激活肽,继而转变成有活性的胰蛋白酶[4].由此被激活的胰蛋白酶不仅可以激活其他胰腺消化酶,还能激活TRY本身[5-7].由此可见,TRY在消化食物中起着关键性作用.
目前对TRY的研究相对较少,主要集中在鱼类,在其他物种中还鲜有报道.家禽生长迅速,饲养成活率高,繁殖潜力大,已成为重要的世界性的家畜之一.本试验以黄羽肉鸡为研究对象,采用RT-PCR和克隆技术,成功获得了黄羽肉鸡TRY cDNA序列和氨基酸序列,并对其蛋白质结构特征、同源性与进化关系进行分析,这些结果将为深入研究黄羽肉鸡以及畜禽TRY基因的进化和生理功能提供理论基础.黄羽肉鸡TRY基因cDNA全序列的克隆,为推进家禽消化酶的研究工作,相关蛋白的诱导表达及健康养殖技术的提高提供参考.
1材料与方法
1.1材料
1.1.1试验鸡黄羽肉鸡由福建莆田广东温氏家禽有限公司提供.
1.1.2主要试剂Trizol Reagent、Universal DNA Purification Kit DNA纯化回收试剂盒、总RNA提取试剂盒、高纯度质粒小提中量提取试剂盒、2×Taq PCR MasterMix购自TIANGEN公司;GoScriptTMReverse Transcription System为Promega公司产品;其余试剂均为国产分析纯.
1.2方法
1.2.1引物的设计与合成参考基因库(GenBank登陆号: U15155.1)中TRY基因的核苷酸序列,采用Primer 5.0软件设计如下引物:上游引物——ATGAA ATTCT TAGTG TTAGT CGCC;下游引物——TCAGT TGGAA GACAT AGTCG.该引物可扩增747 bp的TRY基因全长片段,由上海生工生物工程股份有限公司合成.
1.2.2组织总RNA的提取取50~100 mg组织,于液氮环境下用研钵磨碎,按照RNA抽提试剂盒说明书提取.
1.2.3cDNA的合成及PCR扩增参照RT-PCR试剂盒说明书进行cDNA第一链的合成和扩增.反应条件:42 ℃ 15 min,70 ℃ 15 min.反转录完成后可直接进行PCR扩增或置-20 ℃保存备用.PCR扩增采用25 μL体系:含2 μL cDNA、上下游引物(10 μmol·L-1)各1 μL、12.5 μL PCR Mix,以无核酸酶水加至25 μL.反应条件如下:95 ℃预变性10 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸45 s,共35个循环;最后于72 ℃再延伸10 min.反应结束后根据需要置-20或4 ℃保存.
1.2.4目的基因的克隆与序列测定扩增得到的PCR产物经琼脂糖凝胶回收,克隆至pEASY-T1载体,转化Trans1-T1感受态细胞,采用M13正反向引物,通过PCR反应检测得到阳性克隆,送宝生物工程(大连)有限公司进行测序.
1.2.5TRY基因序列比较及生物信息学分析采用DNAstar软件对测序结果进行拼接比对,登录NCBI将TRY基因序列与GenBank中发表的其他物种的TRY基因序列进行同源性比较和遗传系统进化树分析.运用生物学软件(DNAMAN 6.0.3.99、DNAStar 5.0)和在线生物信息学分析工具(SignaIP 4.1、NetNGLyc 1.0、NetPhos 2.0、ProtScale、TMHMM、GOR4)对TRY基因的生物信息学进行分析.
2结果与分析
2.1RT-PCR扩增、克隆和测序鉴定
采用TRY基因特异性引物对提取的RNA进行RT-PCR扩增,凝胶电泳得到扩增大小约为747 bp的基因片段(图1),与预测的相符.将该片段克隆到pEASY-T1载体,转化到Trans1-T1感受态细胞中,过夜培养之后,随机挑选5个白色克隆菌进行阳性重组子鉴定,初步确定TRY基因已成功克隆到pEASY-T1载体上.为了进一步确定TRY基因是否已经成功克隆到pEASY-T1载体上,提取质粒后进行凝胶电泳鉴定,鉴定质粒成功提取之后,移取适量的质粒送宝生物工程(大连)有限公司进行测序.测序结果表明,TRY基因已经成功克隆到pEASY-T1载体上,并能正常复制增殖.
2.2TRY基因的基本信息
采用DNAstar软件对测序结果进行分析的结果显示,所扩增的片段均为TRY基因片段,TRY基因开放阅读框为747 bp,编码248个氨基酸残基,其中,ATG为起始密码子,TGA为终止密码子.由测序结果推算出蛋白质分子质量约为 26.1 ku.编码的248个氨基酸中,14个氨基酸为强碱性氨基酸(K、R),12个为强酸性氨基酸(D、E),80个为疏水性氨基酸(A、I、L、F、W、V),100个为极性氨基酸(N、C、Q、S、T、Y).TRY氨基酸等电点为7.71,这与胰蛋白酶是一种碱性氨基酸的观点相吻合.
2.3TRY基因信号肽预测
采用SignaIP 4.1在线软件对TRY基因氨基酸序列进行潜在信号肽裂解位点预测,得知该氨基酸含有信号肽(图2),因此做原核表达时,一般要将信号肽序列去除.预测的信号肽由15个氨基酸组成,为MKFLVLVAFLGVAVA;激活肽由10个氨基酸残基组成,为FPISDEDDDK.
2.4TRY基因糖基化位点预测
采用NetNGLyc 1.0在线软件对序列进行N-糖基化位点预测.结果(图3)显示,TRY基因未发现糖基化位点.
2.5TRY基因磷酸化位点预测
采用NetPhos 2.0在线软件对序列进行磷酸化位点预测.结果(图4)显示,TRY基因存在6个丝氨酸位点、2个苏氨酸位点和3个酪氨酸位点(图4).
2.6TRY蛋白疏水性、亲水性及跨膜结构域预测
采用ProtScale在线软件对序列进行疏水性和亲水性分析可知,TRY蛋白疏水性最高分值为3.2,亲水性最高分值为-2.2(图5).整体而言,TRY整条多链疏水性氨基酸稍多于亲水性氨基酸,由此推测该蛋白属于疏水性蛋白.
采用TMHMM在线软件对序列进行跨膜结构域分析可知,TRY氨基酸序列无明显的跨膜区域,蛋白几乎全在膜外(图6),由此可推测该蛋白为非跨膜蛋白.
2.7TRY蛋白二级结构预测
采用GOR4在线软件预测到TRY蛋白的二级结构主要有α-螺旋结构、延伸链结构和无规则卷曲结构(图7).3种主要结构所占的比例为:α-螺旋区域20个氨基酸占8.06%;延伸链区域90个氨基酸占36.29%;无规则卷曲区域138个氨基酸占55.65%.其中:无规则卷曲结构所占比例最大,占一半以上的比例;其次是延伸链结构;而α-螺旋结构所占比例最小.
2.8TRY氨基酸序列比对
将黄羽肉鸡TRY氨基酸序列与GenBank中发表的几种物种的TRY氨基酸序列进行比对发现,黄羽肉鸡TRY序列也具有丝氨酸蛋白酶的保守序列:(1)含有高度保守的催化三联体氨基酸(组氨酸-64、天冬氨酸-110和丝氨酸-203);(2)具有典型的保守底物结合位点——天冬氨酸-197,该残基位于底物结合沟的底部,并通过电荷作用而稳定底物裂解位点的赖氨酸或精氨酸残基,因而也决定着胰蛋白酶的专一性;(3)具有构成6个二硫键所需的12个半胱氨酸残基(其中,8个半胱氨酸残基在其他物种中是完全一致的,其余4个半胱氨酸残基在其他物种中也都是高度保守的);(4)具有决定结合底物特异性的一个关键氨基酸——酪氨酸-178;(5)具有丝氨酸蛋白酶的典型特征序列即位于催化活性部位丝氨酸附近的氨基酸(甘氨酸—天冬氨酸—丝氨酸—甘氨酸—甘氨酸—脯氨酸 )等(图8).
2.9TRY氨基酸序列的同源性
将黄羽肉鸡TRY氨基酸序列与GenBank中发表的几种物种的TRY氨基酸序列进行比对,利用相关软件进行同源性分析.结果(表1)显示:黄羽肉鸡TRY与其同属纯种鸡的同源性最高,达98.8%;与野猪的同源性其次,达72.4%;与斜带石斑鱼、狗和褐家鼠的同源性也较高,均达70%以上;与塞内加尔鳎和牙鲆的同源性最低,分别仅为52.0%和52.9%.
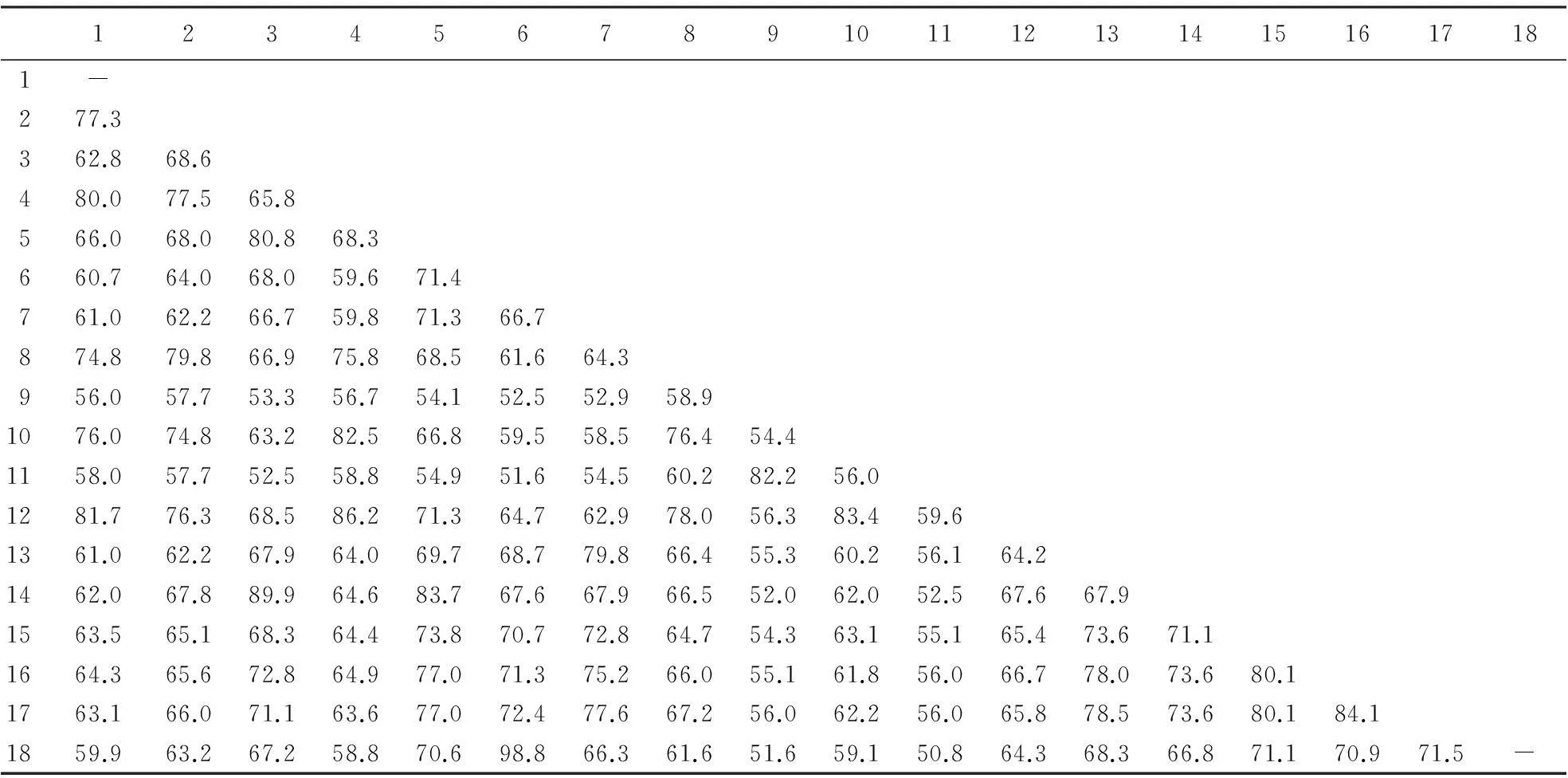
表1 黄羽肉鸡与其他物种的TRY氨基酸序列同源性1)
1)1:日本鳗鲡;2:草鱼;3:翘嘴鲌;4:鳀鱼;5:斜带石斑鱼;6:黄羽肉鸡;7:人;8:虎头鲨;9:牙鲆;10:蓝鳕鱼;11:塞内加尔鳎;12:金头鲷;13:牛;14:斑马鱼;15:狗;16:褐家鼠;17:野猪;18:纯种鸡.
3.0TRY遗传系统进化树
将黄羽肉鸡TRY氨基酸序列与从GenBank上获得的几种物种TRY氨基酸序列进行比对,并采用相关软件构建遗传系统进化树.结果(图9)显示,18个物种TRY主要分为3支,分别为亚型I、亚型Ⅱ和亚型Ⅲ.黄羽肉鸡与纯种鸡、野猪、褐家鼠、狗、人类、牛、翘嘴鲌、斑马鱼和斜带石斑鱼属于同一亚型(亚型I);牙鲆与塞内加尔鳎属于另一亚型(亚型Ⅱ);其他6个物种同属于亚型Ⅲ.
4讨论
目前虽然对TRY的分子生物学有了一定的研究,但主要集中在鱼类,对于其他物种的研究还鲜见报道.截止到目前,已在一些鱼类中成功克隆获得TRY cDNA序列,如翘嘴鲌[8]、金头鲷[9]、冬蝶[10]、大西洋鳕鱼[11]、牙鲆[12]、斜带石斑鱼[13]、蓝鳕鱼[14]、日本鳗鲡[15]和塞内加尔鳎[16]等.
禽类消化酶基因的克隆和序列测定是研究消化酶mRNA表达的基础.在众多基因序列的研究方法中,cDNA快速克隆技术是近年来广泛应用的获取完整cDNA的方法.与通过建立cDNA文库进行筛选的常规方法比较,该法具有简便、快速和经济的优点.而PCR作为一种特异性扩增DNA或RNA片段的方法,因其具有快速、特异、灵敏和简便的优点,已被广泛应用于基因的分子生物学研究中[17-18].为了对禽类TRY基因进行深入研究,本试验采用RT-PCR技术成功扩增并克隆得到黄羽肉鸡TRY基因,该基因全长747 bp,将其目的基因与载体连接,获得阳性重组子,测序结果表明扩增出的片段即为黄羽肉鸡TRY基因.该RT-PCR技术用于检测TRY的表达具有很强的特异性,也证明了所采用的克隆方案是合理可行的.
本试验采用生物学软件对黄羽肉鸡TRY蛋白的性质进行分析的结果显示,氨基酸等电点为7.71,这与胰蛋白酶是一种碱性氨基酸的观点相吻合;同时,通过对TRY蛋白信号肽裂解位点的预测,发现该蛋白含有信号肽裂解位点.结合氨基酸序列比对结果,发现TRY的信号肽和激活肽序列都是非常保守的.一般脊椎动物的信号肽是由15个氨基酸残基组成,但有的物种的信号肽可能会少2~3个氨基酸残基,也有可能会多出几个氨基酸残基.黄羽肉鸡TRY的信号肽由15个氨基酸残基组成,即甲硫氨酸—赖氨酸—苯丙氨酸—亮氨酸—缬氨酸—亮氨酸—缬氨酸—丙氨酸—苯丙氨酸—亮氨酸—甘氨酸—缬氨酸—丙氨酸—缬氨酸—丙氨酸,与其他物种比较具有高度的保守性.对TRY激活肽的研究始于1955年,当时Davie et al[19]发现牛的TRY通过水解去掉一段八肽后具有了活性形式.大多数物种的TRY信号肽由接近8个氨基酸残基组成.通过比对发现,各物种的TRY激活肽都有一个共同的特点,即C-末端都是碱性氨基酸残基——赖氨酸残基.在这个碱性氨基酸残基之前至少有3个天冬氨酸残基聚集成族,当然也存在例外.许多真核生物的TRY基因都有3个这样成族聚集的天冬氨酸残基,通过分析发现越高级的动物越倾向于具有4个或更多个这样的氨基酸残基.这表明在动物的进化过程中,在选择压力的作用下,连续的天冬氨酸残基有一个递增的过程,这一结果与Roach et al[20]的研究结果一致.黄羽肉鸡的TRY激活肽由10个氨基酸残基组成,即苯丙氨酸—脯氨酸—异亮氨酸—丝氨酸—天冬氨酸—谷氨酸—天冬氨酸—天冬氨酸—天冬氨酸—赖氨酸,位于碱性氨基酸残基——赖氨酸残基前面,并不像高等脊椎动物那样是4个连续的天冬氨酸残基.这表明禽类在进化上还是属于比较低级的脊椎动物.
序列一致性分析表明,黄羽肉鸡TRY与其同属纯种鸡的同源性最高,达98.8%.遗传系统进化树分析表明,黄羽肉鸡TRY氨基酸序列与纯种鸡、野猪、褐家鼠、狗、人类、牛、翘嘴鲌、斑马鱼和斜带石斑鱼属于同一亚型(亚型I).遗传系统进化树总体表现为:同属内种间亲缘关系最近,同目内科间亲缘关系次之,不同目间的亲缘关系最远.这些结果为进一步研究禽类TRY的基因功能和进化等提供参考.
本试验首次成功克隆获得了黄羽肉鸡TRY基因的cDNA全序列,这将有助于进一步研究其表达调控机理.禽类因其消化系统的特殊性,如肠道短小、蠕动紧张、内容物在肠道停留时间短等,因此在消化过程中蛋白酶发挥着更加重要的作用.而胰蛋白酶又是禽类对蛋白质消化过程中起重要作用的消化酶,其以非活性TRY的形式被合成和分泌,被肠激酶或者激活的胰蛋白酶切割除去氨基端的酸性激活肽,继而转变成有活性的胰蛋白酶.因此,从基因水平对黄羽肉鸡TRY进行深入研究与探讨,将有助于推进家禽消化酶的研究及提高家禽的健康养殖技术.
参考文献
[1] PEREZ-CASANOVA J C, MURRAY H M, GALLANT J W, et al. Development of the digestive capacity in larvae of haddock (Melanogrammusaeglefinus) and Atlantic cod (Gadusmorhua) [J]. Aquaculture, 2006,251:377-401.
[2] RAWLINGS N D, BARRETT A J. Families of serine peptidases [J]. Meth Enzymol, 1994,244:19-61.
[3] MITHOFER K, FERNANDEZ-DEL CASTILLO C, RATTNER D, et al. Subcellular kinetics of early trypsinogen activation in acute rodent pancreatitis [J]. Am J Physiol, 1998,274:G71-G79.
[4] 王镜岩,朱圣庚,徐长发.生物化学[M].3版.北京:高等教育出版社,2002:405.
[5] CHEN J M, KUKOR Z, LE MARECHAL C, et al. Evolution of trypsinogen activation peptides [J]. Mol Biol Evol, 2003,20(11):1767-1777.
[6] RUST M B. Nutritional physiology [M]∥HALVER J E, HARDY R W. Fish Nutrition. 3rd ed. Amsterdam: Elsevier, 2003:367-452.
[7] RYPNIEWSKI W R, PERRAKIS A, VORGIAS C E, et al. Evolutionary divergence and conservation of trypsin [J]. Protein Eng, 1994,7(1):57-64.
[8] RUAN G L, LI Y, GAO Z X, et al. Molecular characterization of trypsinogens and development of trypsinogen gene expression and tryptic activities in grass carp (Ctenopharyngodonidellus) and topmouth culter (Culteralburnus) [J]. Comp Biochem Physiol B Biochem Mol Biol, 2010,155(1):77-85.
[9] PSOCHIOU E, SARROPOULOU E, MAMURIS Z, et al. Sequence analysis and tissue expression pattern ofSparusauratachymotrypsinogens and trypsinogen [J]. Comp Biochem Physiol B Biochem Mol Biol, 2007,147(3):367-377.
[10] DOUGLAS S E, GALLANT J W. Isolation of cDNAs for trypsinogen from the winter flouder,Pleuronectesamericanus[J]. Mar Biotechnol, 1998,6(4):214-219.
[11] GUDMUNDSDOTTIR A, GUDMUNDSDOTTIR E, OSKARSSON S, et al. Isolation and characterization of cDNAs from Atlantic cod encoding two different forms of trypsinogen [J]. Eur J Biochem, 1993,217(3):1 091-1 097.
[12] SUZUKI T, SRIVASTAVA A S, KUROK AWA T. cDNA cloning and phylogenetic analysis of pancreatic serine proteases from Japanese flouder,Paralichthysolivaceus[J]. Comp Biochem Physiol B Biochem Mol Biol, 2002,131(1):63-70.
[13] 胡永乐,梁旭方,王琳,等.斜带石斑鱼胰蛋白酶原和淀粉酶全长cDNA的克隆与序列分析[J].热带海洋学报,2010,29(5):125-131.
[14] GENICOT S, RENTIER-DELRUE F, EDWARDS D, et al. Trypsin and trypsinogen from an Antarctic fish: molecular basis of cold adaptation [J]. Biochimica et Biophysica Acta, 1996,1298(1):45-57.
[15] KUROKAWA T, SUZUKI T, OHTA H, et al. Expression of pancreatic enzyme genes during the early larval stage of Japanese eelAnguillajaponica[J]. Fish Sci, 2002,68(4):736-744.
[16] MANCHA D O M, INFANTE C, ASENSIO E, et al. Molecular characterization and gene expression of six trypsinogens in the flatfish Senegalese sole (SoleasenegalensisKaup)during larval development and in tissues [J]. Comp Biochem Physiol B Biochem Mol Biol, 2008,149(2):334-344.
[17] 谢芝勋,庞耀珊,刘加波,等.用反转录聚合酶链反应检测禽呼肠孤病毒的研究[J].中国预防兽医学报,1999,21(5):365-367.
[18] 温进坤,韩梅.医学分子生物学理论与研究技术[M].北京:科学出版社,1999:106-141.
[19] DAVIE E W, NEURATH H. Identification of a peptide released during autocatalytic activation of trypsinogen [J]. Biol Chem, 1955,212:515-529.
[20] ROACH J C, WANG K, LU G, et al. The molecular evolution of the vertebrate trypsinogens [J]. Journal of Molecular Evolution, 1997,45(6):640-652.
(责任编辑:施晓棠)
Molecular cloning, structure prediction and function analysis of trypsinogen in yellow broiler
ZHAN Tiantian, FAN Qian, ZHANG Jie, XU Lihui, WANG Quanxi, GAO Yuyun, WANG Changkang
(College of Animal Science, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
Abstract:To elucidate the function of trypsinogen (TRY) in the process of digestion in poultry, TRY gene of yellow broiler was successfully cloned, and a series of bioinformatics software were used to analyze and predict the structure and function of TRY. Results showed that full-length of open reading frame (ORF) of TRY was 747 bp, which encoded 248 amino acids. TRY has a signal peptide of 15 amino acids (MKFLVLVAFLGVAVA) and an activation peptide of 10 amino acids (FPISDEDDDK). The molecular weight of TRY was 26.1 ku, with 11 phosphorylation sites but no glycosylation site. TRY was hydrophobic without transmembrane domain. Alignment analysis based on the amino acid sequences revealed that TRY from yellow broiler was highly conservative, which included the catalytic triad (His-64, Asp-110 and Ser-203), with 12 cysteines forming 6 disulfide bonds. Homology analysis indicated that TRY from yellow broiler and purebred chicken had the highest homology at 98.8%.
Key words:trypsinogen; trypsin; clone; cDNA; sequence analysis
DOI:10.13323/j.cnki.j.fafu(nat.sci.).2016.01.009
中图分类号:S831; Q785
文献标识码:A
文章编号:1671-5470(2016)01-0048-08
作者简介:詹湉湉(1990-),女,硕士研究生.研究方向:动物营养与饲料科学.Email:461542461@qq.com.通讯作者王长康(1962-),男,教授,硕士生导师.研究方向:家禽营养.Email:wangchangkangcn@163.com.
基金项目:福建省农业“五新工程”资助项目(K6MLA001A).
收稿日期:2015-04-16修回日期:2015-08-12
