不同病理类型子宫内膜组织中β-catenin、YAP-1、Survivin表达观察
2016-04-18荆丽红严鹏高玉彤
荆丽红,严鹏,高玉彤
(1天津医科大学病理学教研室,天津300070;2西安交通大学法医学院)
不同病理类型子宫内膜组织中β-catenin、YAP-1、Survivin表达观察
荆丽红1,严鹏2,高玉彤1
(1天津医科大学病理学教研室,天津300070;2西安交通大学法医学院)
摘要:目的观察不同病理类型子宫内膜组织中β-链蛋白(β-catenin)、Yes相关蛋白1(YAP-1)和生存素(Survivin)的表达变化,并探讨三者与子宫内膜样腺癌发病的关系。方法 采用免疫组化法分别检测增殖期、单纯性增生、复杂性增生子宫内膜组织及子宫内膜样腺癌组织中的β-catenin、YAP-1、Survivin。结果β-catenin、YAP-1、Survivin在增殖期、单纯性增生、复杂性增生子宫内膜组织及子宫内膜样腺癌组织中的阳性表达依次增多(P均<0.05);β-catenin在高分化、中分化、低分化子宫内膜样腺癌组织中的阳性表达依次减少(P均<0.05)。子宫内膜样腺癌组织中β-catenin与YAP-1、YAP-1与Survivin阳性表达均呈正相关关系(r分别为0.378、0.700,P均<0.05)。结论 子宫内膜样腺癌组织中β-catenin、YAP-1、Survivin阳性表达增高,三者可能协同参与了子宫内膜样腺癌的发病。
关键词:子宫肿瘤;子宫内膜样腺癌;β-链蛋白;Yes相关蛋白1;生存素
子宫内膜癌是女性生殖系统常见的恶性肿瘤,以子宫内膜样腺癌最为常见,近年来发病率呈上升趋势。现已证实,Wnt/β-链蛋白(β-catenin)、Akt/PI3K等与调节细胞周期和细胞分化有关的分子信号通路异常激活在子宫内膜癌发生发展中起重要作用[1,2]。各种因素引起Wnt信号通路异常激活,导致β-catenin在胞核中累积并与核内转录因子TCF/LEF结合,进而激活下游靶基因表达。一项关于大肠癌的研究[3]结果表明,Wnt信号通路异常激活后,胞核内累积的β-catenin还可与Yes相关蛋白1(YAP-1)/TBX5结合,并激活下游靶基因生存素(Survivin)表达,从而导致细胞恶变。本研究观察了不同病理类型子宫内膜组织中β-catenin、YAP-1、Survivin的表达变化,探讨三者在子宫内膜样腺癌发生发展中的作用。
1材料与方法
1.1标本来源选取2009年12月~2015年3月存档于天津医科大学总医院病理科的子宫内膜病理组织标本80例份,其中包括增殖期子宫内膜15例份(患者中位年龄43岁),单纯性增生子宫内膜15例份(患者中位年龄46岁),复杂性增生子宫内膜20例份(患者中位年龄49岁),子宫内膜样腺癌30例份(患者中位年龄59岁,高分化9例、中分化11例、低分化10例)。所有组织切片均按《乳腺及女性生殖器官肿瘤病理学和遗传学》中相关标准重新复诊和分级。
1.2β-catenin、YAP-1、Survivin检测方法所有蜡块均经4 μm连续切片,65~70 ℃温箱烤片1.5~2 h,常规脱蜡至水,选用通用型二抗PV-6000行免疫组化染色,枸橼酸钠缓冲液(pH 6.0)微波热修复,3 min×2次。YAP-1、Survivin以细胞核中呈现棕黄色颗粒为阳性信号;每例份选取5个具有代表性的高倍视野,阳性细胞数百分比≤10%计1分、11%~50%计2分、51%~75%计3分、>75%计4分,无特异性着色计0分、浅棕色计1分、棕黄色计2分、棕褐色计3分;将阳性细胞百分比得分与染色强度得分相乘,≥2判定为阳性。β-catenin正常表达于细胞膜和细胞质,出现于细胞核为异常表达,结果判定参照文献[4]方法,高倍镜下随机计数500个细胞,当>5%的细胞出现细胞核异常染色时判定为阳性表达。
1.3统计学方法采用SPSS17.0统计软件进行统计分析。计数资料比较采用χ2检验;相关性分析采用Pearson相关分析法。以P<0.05为差异有统计学意义。
2结果
2.1不同病理类型子宫内膜组织中β-catenin、YAP-1、Survivin表达比较β-catenin、YAP-1、Survivin在增殖期、单纯性增生、复杂性增生子宫内膜组织及子宫内膜样腺癌组织中的阳性表达依次增多,同种指标各组间两两相比,P均<0.05。见表1、图1~3。
2.2不同组织学分级子宫内膜样腺癌组织中β-catenin、YAP-1、Survivin表达比较β-catenin在高分化、中分化、低分化子宫内膜样腺癌组织中阳性表达依次减少,两两相比,P均<0.05。见表2。

表1 增殖期、单纯性增生、复杂性增生子宫内膜组织
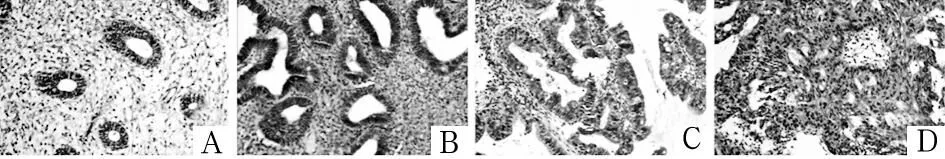
注:A为增殖期子宫内膜;B为单纯性增生子宫内膜;C为复杂性增生子宫内膜;D为子宫内膜样腺癌。
图1增殖期、单纯性增生、复杂性增生子宫内膜组织
及子宫内膜样腺癌组织中β-catenin的表达
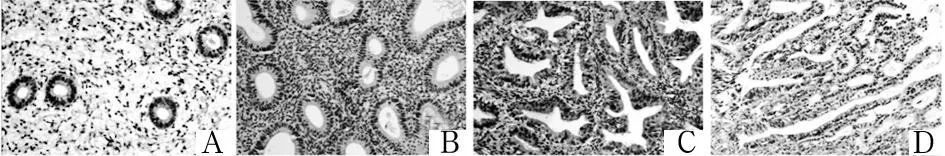
注:A为增殖期子宫内膜;B为单纯性增生子宫内膜;C为复杂性增生子宫内膜;D为子宫内膜样腺癌。
图2增殖期、单纯性增生、复杂性增生子宫内膜组织
及子宫内膜样腺癌组织中YAP-1的表达

注:A为增殖期子宫内膜;B为单纯性增生子宫内膜;C为复杂性增生子宫内膜;D为子宫内膜样腺癌。
图3增殖期、单纯性增生、复杂性增生子宫内膜组织
及子宫内膜样腺癌组织中Survivin的表达

表2 不同组织学分级子宫内膜样腺癌组织中β-catenin、
2.3子宫内膜样腺癌组织中β-catenin、YAP-1、Survivin表达的相关性子宫内膜样腺癌组织中β-catenin与YAP-1、YAP-1与Survivin的阳性表达均呈正相关关系(r分别为0.378、0.700,P均<0.05)。
3讨论
大量实验数据证实,与细胞周期调节和细胞分化有关的分子信号通路的异常激活参与子宫内膜样腺癌的发生发展。Wnt/β-catenin信号通路参与细胞周期调节,与细胞增殖、凋亡及迁移有关[5],其核心分子β-catenin在胞核内异常累积与多种恶性肿瘤的发生有关[6~8]。近年研究显示,β-catenin在子宫内膜样腺癌组织中也有异常表达。有学者[2]发现,胞核中累积的β-catenin除与TCF/LEF形成转录复合物启动下游靶基因表达外,也可与YAP-1/TBX-5形成转录复合物并激活Survivin及BCL2L1表达,从而导致大肠癌的发生。
YAP-1是一种细胞内连接蛋白和转录辅激活因子[9],定位于人类染色体11q22[10]。通常情况下,YAP-1高度保守,其高表达可导致细胞增殖及细胞周期调控异常,导致肿瘤发生,增强肿瘤侵袭能力[11]。研究[12]显示,在卵巢癌、肝癌、胃癌、大肠癌、前列腺癌等多种实体肿瘤中均发现YAP-1高表达。Zhang等[13]研究显示,YAP-1高表达可增强卵巢癌细胞侵袭和转移能力,YAP-1在正常子宫内膜、子宫内膜不典型增生组织及子宫内膜样腺癌组织中阳性表达率逐渐升高,同时还发现子宫内膜样腺癌组织中YAP-1与Survivin表达呈正相关关系,但其机制尚不清楚。
Survivin作为Wnt信号通路的重要靶基因,主要参与细胞增殖、细胞凋亡与细胞周期的调控。Survivin在多数正常组织中不表达或少量表达,而在多种肿瘤组织中呈异常高表达[14]。Lee等[15]研究显示,结肠癌组织中β-catenin与Survivin表达呈正相关关系,梁海红等[16]在乳腺癌相关研究中同样发现了这一现象。
本研究检测了不同子宫内膜病变组织中的β-catenin、YAP-1、Survivin,结果显示β-catenin、YAP-1、Survivin在增殖期、单纯性增生、复杂性增生子宫内膜组织及子宫内膜样腺癌组织中阳性表达逐渐增多,β-catenin在高分化、中分化、低分化子宫内膜样腺癌组织中的阳性表达逐渐减少,提示β-catenin、YAP-1和Survivin均与子宫内膜样腺癌的发病有关,且β-catenin与肿瘤恶性程度相关。我们通过Pearson相关分析还发现,子宫内膜样腺癌组织中β-catenin与YAP-1、YAP-1与Survivin表达均呈正相关关系,推测在子宫内膜样腺癌发生过程中,β-catenin在细胞核中与YAP-1形成转录复合物,激活下游靶基因Survivin表达,三者起到了协同作用。
结合上述研究结果,我们推测,在经典Wnt信号通路中至少存在两种转录复合物参与子宫内膜样腺癌的发病,即β-catenin-TCF/LEF转录复合物和β-catenin-YAP1转录复合物。进一步研究β-catenin、YAP-1、Survivin三者之间相互作用的关系及具体机制有望为子宫内膜样腺癌的临床治疗、预后判断等提供帮助。
参考文献:
[1] Markowska A, Pawalowska M, Lubin J, et al. Signalling pathways in endometrial cancer[J]. Contemp Oncol (Pozn), 2014,18(3):143-148.
[2] Wang Y, van der Zee M, Fodde R, et al. Wnt/Β-catenin and sex hormone signaling in endometrial homeostasis and cancer[J]. Oncotarget, 2010,1(7):674-684.
[3] Rosenbluh J, Nijhawan D, Cox AG, et al. beta-Catenin-driven cancers require a YAP1 transcriptional complex for survival and tumorigenesis[J]. Cell, 2012,151(7):1457-1473.
[4] Liao X, Siu MK, Au CW, et al. Aberrant activation of hedgehog signaling pathway contributes to endometrial carcinogenesis through beta-catenin[J]. Mod Pathol, 2009,22(6):839-847.
[5] Van Scoyk M, Randall J, Sergew A, et al. Wnt signaling pathway and lung disease[J]. Transl Res, 2008,151(4):175-180.
[6] Chiurillo MA. Role of the Wnt/beta-catenin pathway in gastric cancer: An in-depth literature review[J]. World J Exp Med, 2015,5(2):84-102.
[7] Nagaraj AB, Joseph P, Kovalenko O, et al. Critical role of Wnt/beta-catenin signaling in driving epithelial ovarian cancer platinum resistance[J]. Oncotarget, 2015,6(27):23720-23734.
[8] Paul S, Dey A. Wnt signaling and cancer development: therapeutic implication Minireview[J]. Neoplasma, 2008,55(3):165-176.
[9] Sudol M. Yes-Associated Protein (Yap65) Is a Proline-Rich Phosphoprotein That Binds to the Sh3 Domain of the Yes Protooncogene Product[J]. Oncogene, 1994,9(8):2145-2152.
[10] Overholtzer M, Zhang J, Smolen GA, et al. Transforming properties of YAP, a candidate oncogene on the chromosome 11q22 amplicon[J]. Proc Natl Acad Sci U S A, 2006,103(33):12405-12410.
[11] Zhao B, Lei QY, Guan KL. The Hippo-YAP pathway: new connections between regulation of organ size and cancer[J]. Curr Opin Cell Biol, 2008,20(6):638-646.
[12] Steinhardt AA, Gayyed MF, Klein AP, et al. Expression of Yes-associated protein in common solid tumors[J]. Hum Pathol, 2008,39(11):1582-1589.
[13] Zhang X, George J, Deb S, et al. The Hippo pathway transcriptional co-activator, YAP, is an ovarian cancer oncogene[J]. Oncogene, 2011,30(25):2810-2822.
[14] Sasaki T, Lopes MBS, Hankins GR, et al. Expression of survivin, an inhibitor of apoptosis protein, in tumors of the nervous system[J]. Acta Neuropathologica, 2002,104(1):105-109.
[15] Lee SC, Kim OH, Lee SK, et al. IWR-1 inhibits epithelial-mesenchymal transition of colorectal cancer cells through suppressing Wnt/β-catenin signaling as well as survivin expression[J]. Oncotarget, 2015,6(29):27146-27159.
[16] 梁海红,姚宏.β-链蛋白、P120ctn、Survivin及雌激素受体β在乳腺癌中的表达及临床意义[J].中国药物与临床,2010,4(10):420-421.
(收稿日期:2016-09-07)
中图分类号:R737.33
文献标志码:B
文章编号:1002-266X(2016)07-0044-03
doi:10.3969/j.issn.1002-266X.2016.07.016
通信作者:高玉彤(E-mail: emmagao_2010@163.com)
