辣椒果皮颜色的遗传分析
2016-04-18丁盼盼江海坤刘童光易建群田红梅
丁盼盼 江海坤 刘童光 陈 鹏 易建群 田红梅 王 艳 方 凌
(1安徽农业大学,安徽合肥 230031;2安徽省农业科学院园艺研究所,安徽合肥 230031;3园艺作物种质创新与生理生态安徽省重点实验室,安徽合肥 230031)
辣椒果皮颜色的遗传分析
丁盼盼1,2,3江海坤2,3*刘童光1*陈 鹏1,2,3易建群1,2,3田红梅2,3王 艳2,3方 凌2,3
(1安徽农业大学,安徽合肥 230031;2安徽省农业科学院园艺研究所,安徽合肥 230031;3园艺作物种质创新与生理生态安徽省重点实验室,安徽合肥 230031)
以商品成熟期果皮紫色(245)、绿色(246)、乳白色(247)的3份辣椒品系为亲本,配制杂交组合245×246和245×247,构建6世代遗传群体,通过目测分级、色差仪分析测定P1、P2、F1、B1、B2、F2各单株的辣椒商品成熟期果皮颜色L值、C值和颜色级值,并应用6个世代联合分析法研究辣椒商品成熟期果皮颜色的遗传规律。结果表明,辣椒商品成熟期果皮颜色遗传为细胞核遗传,紫-绿组合的辣椒商品成熟期果皮颜色性状符合1对加性主基因+加性-显性混合多基因模型,即D-2模型,其L值、C值和颜色级值F2主基因遗传率分别为22.39%、91.39%和82.26%;紫-白组合的辣椒商品成熟期果皮颜色性状符合2对加性-显性-上位性主基因+加性-显性-上位多基因模型,即E-0模型,其L值、C值和颜色级值F2主基因遗传率分别为87.02%、94.34%和97.54%。表明主基因遗传力较强,多基因遗传力和环境效应影响弱,在育种时对辣椒商品成熟期果皮颜色的选择应在早期分离世代进行。
辣椒;果皮颜色;紫色;色差仪;遗传
辣椒(Capsicum frutescens L.)为茄科辣椒属一年生或多年生草本植物。果实通常呈圆锥形或长圆形,未成熟时呈绿色,商品成熟期变成白色、绿色或紫色,生理成熟期变成红色、橙红色或黄色。其VC含量在蔬菜中居第1位。紫色辣椒是辣椒中稀有的种质资源(隋益虎,2011),其商品成熟期因富含花色素而呈现出紫色,植株具有耐热、耐寒、耐旱以及抗病的特点,对开发和利用种质资源创新等具有重要的意义(戴斌,2013)。目前关于辣椒果皮颜色的研究主要集中在白色、红色、绿色、橙色等颜色上(Smith,1950;Kormos & Kormos,1960;王恒明 等,2004),而关于紫色性状的研究却鲜有报道。
植物颜色性状遗传研究的测量一般采用目测法或色差仪测量。前者简便易行,但由于感官的局限性和人的主观性限制,鉴定结果准确性不高(汪琳和应铁进,2000);而后者比较准确客观,但有时却很难反映颜色的复杂心理刺激作用。两者都是颜色测量不可缺少的,但色差仪测定是主要趋势(曹连平 等,2004)。目前目测法在番茄(阮美颖,2013)、甘蓝(谭其猛 等,1964)、大白菜(张德双等,2011)、水稻(石帮志 等,2002)和辣椒(徐小万 等,2011)上都有应用;色差仪测量在黄瓜(王建科 等,2013;申晓青 等,2014)和茄子(相丛超 等,2015)等植物上应用广泛,但在辣椒果皮上却未曾报道。
本试验采用果皮紫色辣椒245、果皮绿色辣椒246和果皮乳白色辣椒247作亲本,分别配制杂交组合245×246和245×247,构建6个世代遗传群体,利用植物数量性状主基因+多基因模型的多世代进行联合分析(盖钧镒,2003)并估算有关遗传参数,探讨辣椒商品成熟期果皮颜色的遗传规律,以期为辣椒育种实践提供理论依据。
1 材料与方法
1.1 试验材料
供试材料如表1所示,均由安徽省农业科学院园艺研究所辣椒课题组提供。

表1 试验材料及其果皮颜色
1.2 试验方法
2015年3月10日在安徽省农业科学院园艺研究所试验基地大棚内种植亲本245、246和247,配制杂交组合245×246、245×247、246×245、247×245,获得F1种子。2015年8月5日种植F1,将F1(245×246)和F1(245×247)通过自交或回交获得F2和B1、B2种子。2016年1月24日将P1、P2、F1、B1、B2和F2这6个世代材料的种子播种于试验基地的大棚内,分别种植10、10、12、60、60株和100株,6月24日开始在每株上取1个生长正常并且达到商品成熟期的辣椒进行果皮颜色的测量。
1.3 果皮颜色的测定和分级
1.3.1 目测与分级 参照张宝玺和李锡香(2006)的辣椒种质资源描述规范和数据标准,将辣椒商品成熟期果皮颜色分为乳白、白绿、白紫、浅绿、绿、绿紫、浅紫、紫、深紫、紫黑这10个级别(图1)。

图1 辣椒商品成熟期果色分类的标准颜色
1.3.2 色差仪测定 采用CR-400色差仪对辣椒果皮颜色进行测定,采用CIE Lab表色系统测定果实表皮的L、a、b、C值。其中,L值表示亮度值,代表表皮光滑度;a值表示红绿色值,负值偏绿,正值偏红;b值表示黄蓝值,负值偏蓝,正值偏黄;C值表示色饱和度或色强度(C2= a2+ b2)。
用色差仪测定时,选择辣椒果实向光面上、中、下3个点,取平均值作为辣椒果皮颜色的测定值。
根据目测法的分级级别,结合色差仪测定的目测标准果皮颜色的L值和C值,制定本试验辣椒商品成熟期果皮颜色的分级标准(表2)。
1.3.3 统计分析方法 采用多世代联合的数量性状分离分析方法中的P1、P2、F1、B1、B2和F2联合分析方法,对试验数据进行分析处理。
2 结果与分析
2.1 6个世代辣椒果皮颜色的次数分布
2.1.1 亲本及F1辣椒果皮颜色的次数分布 亲本及F1果皮颜色如图2所示,F1(245×246)和F1(246×245)、F1(245×247)和F1(247×245)果皮颜色相同。经色差仪测量和u检验法分析(表3),上述F1正反交之间的L值、C值和颜色级值差异不显著。说明245和246、245和247之间的颜色遗传为细胞核遗传,不受细胞质控制。
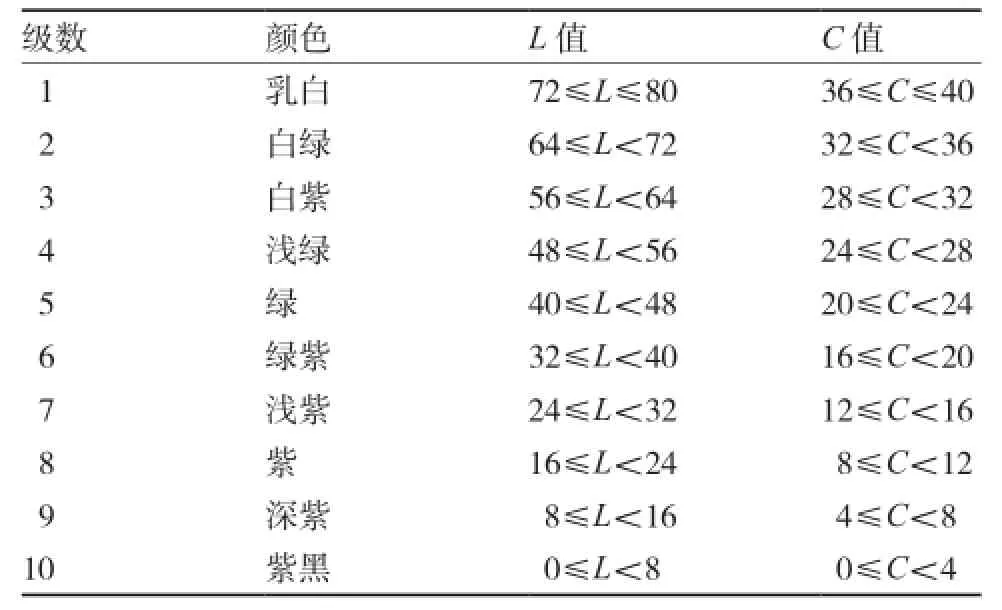
表2 辣椒商品成熟期果皮颜色的分级标准

图2 亲本及F1辣椒果皮颜色表现
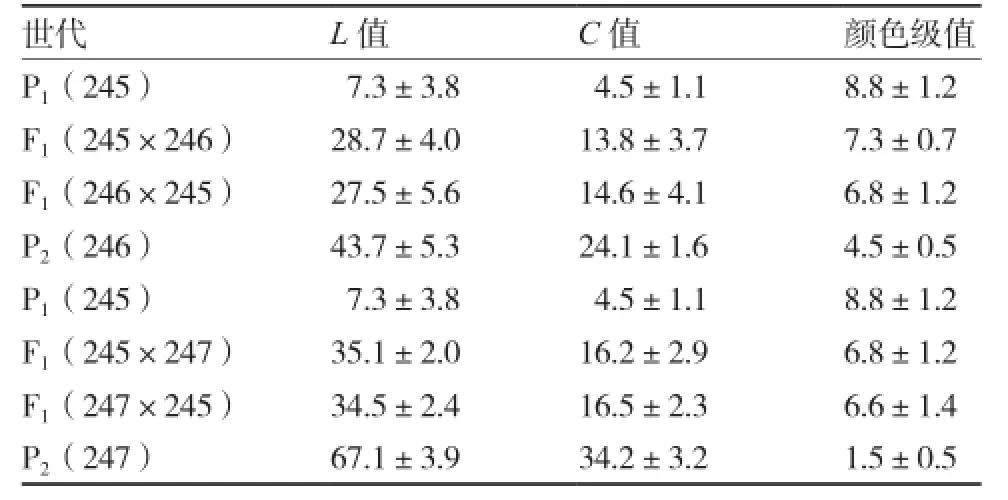
表3 亲本及F1辣椒果实颜色L值和C值统计量平均值

图3 245×246组合F2果色L值、C值和颜色级值的数量分布图
结合图2和表3可知,F1(245×246)果皮颜色为浅紫,F1(245×247)为绿紫,每个F1的L值、C值和颜色级值均介于两亲本之间且都偏向于低值亲本,每个F1的果皮颜色也都介于两亲本之间,说明紫色对绿色、紫色对白色均为不完全显性。
2.1.2 F2辣椒果皮颜色的次数分布 结合图3和图4可知,245×246和245×247这2个组合的F2的L值、C值和颜色级值均呈现双峰偏正态分布,说明245×246和245×247这2个组合的辣椒商品成熟期果皮颜色遗传属于数量性状遗传。
2.2 最优遗传模型的选择与检验
分别以245×246和245×247这2个组合的P1、P2、F1、B1、B2、F26个世代的L值、C值和颜色级值为基础,运用6世代联合分析法,分别选出AIC值较小的4个模型,再通过适合性检验,选择参数达到显著差异数量最少的模型即为最优模型。从表4可知,组合245×246中L值的C-0、D-1、D-2和E-3模型的AIC值较小。其中D-2模型的AIC值最小且差异显著性统计量最少,所以D-2模型为最优模型。结合表4和表5,245×246中C值和颜色级值的最优模型均为D-2模型,说明245×246组合的商品成熟期果皮颜色性状符合D-2遗传模型,即由1对加性主基因+加性-显性混合多基因控制。同理分析,组合245×247的L值、C值和颜色级值的最优模型均为E-0模型,说明245×247组合的商品成熟期果皮颜色性状符合E-0遗传模型,即2对加性-显性-上位性主基因+加性-显性-上位多基因模型。
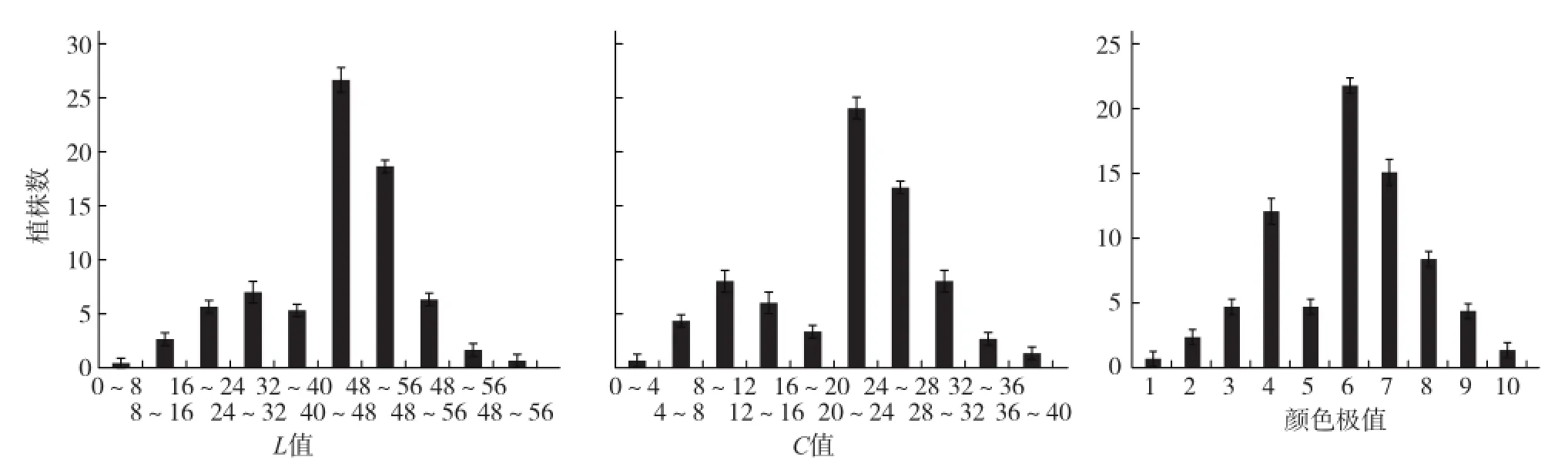
图4 245×247组合F2果色L值、C值和颜色级值的数量分布图

表4 245×246和245×247组合L值、C值和颜色级值遗传模型的AIC值
2.3 最适模型的遗传参数估计
如表6所示,245×246组合中L值的1对主基因加性效应为-5.29,表现为减效,多基因的加性效应和显性效应分别为-2.57和-6.98,均表现为减效。主基因遗传率在B1、B2和F2中分别为0.89%、60.89%和22.39%,主基因在B2中作用较大,多基因遗传率在B1、B2和F2中分别为0、26.11%和62.25%,多基因在F2中作用较大。
245×246组合中C值的1对主基因加性效应为-11.38,表现为减效,多基因的加性效应为3.72,表现为加效,多基因显性效应为-12.68,表现为减效,主基因遗传率在F2中作用较大,而多基因遗传率在B1中作用较大。
245×246组合中颜色级值的1对主基因和多基因均表现为加效,而多基因的显性效应为-0.35,表现为减效。主基因遗传率在F2中作用较大,而多基因遗传率在B1中作用较大。

表5 245×246和245×247组合遗传模型的适合性检验
如表7所示,245×247组合L值的2对主基因加性效应分别为-10.68和-10.52,2对主基因加性效应相差不多,表明2对主基因在加性效应中共同作用。第1对主基因的显性效应和显性度分别为-4.54和0.43,第2对主基因的显性效应和显性度分别为-0.48和0.06,表明2对主基因的效应都以加性效应为主。上位作用中,2对主基因的显性×加性的互作效应较大。245×247组合L值的B1、B2和F2的主基因遗传率分别为53.39%、76.29%和87.02%,多基因遗传率分别为0、17.26%和3.85%,主基因在B2和F2中的遗传率较高。

表6 245×246组合L值、C值和颜色级值6世代联合分析的遗传参数估计(D-2模型)
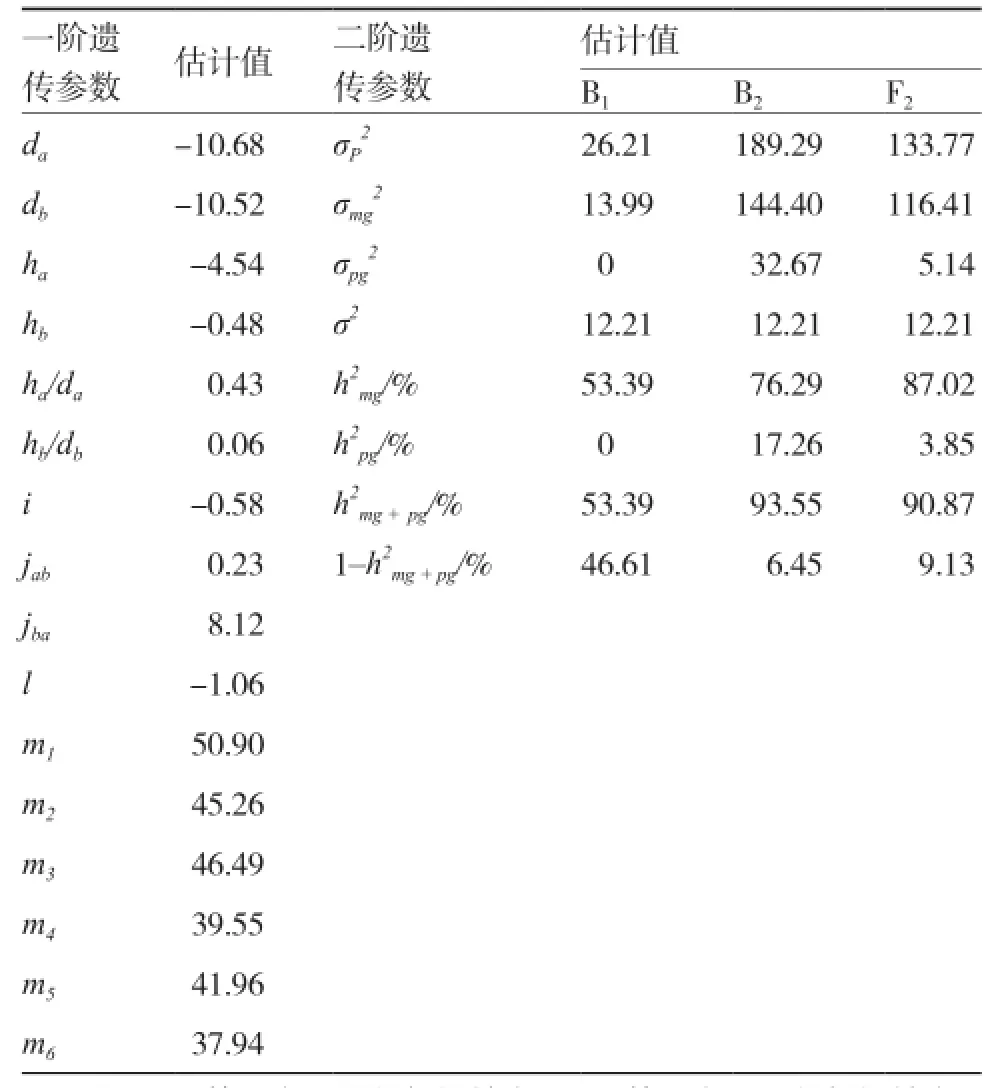
表7 245×247组合L值6世代联合分析的遗传参数估计(E-0模型)

表8 245×247组合C值6世代联合分析的遗传参数估计(E-0模型)
如表8所示,245×247组合C值的2对主基因加性效应、显性效应和显性度与L值的基本一致,C值的2对主基因都以加性效应为主,且加性效应相同。而在上位作用中,2对主基因的加性×加性的互作效应较大。245×247组合C值的主基因遗传率在B1、B2和F2分别为20.34%、93.86%和94.34%,多基因遗传率均为0,主基因在B2和F2中的遗传率非常高,说明245×247组合的商品成熟期果皮颜色主要受主基因控制。
如表9所示,245×247组合颜色级值的2对主基因加性效应、显性效应和显性度与L值的基本一致,2对主基因都以加性效应为主,但其加性效应都相差不多。上位效应中,2个主基因之间的显性×加性互作效应和2个基因之间的显性×显性互作效应较大。主基因在B1、B2和F2中的遗传率都非常高,表明245×247组合的商品成熟期果皮颜色主要受主基因控制。

表9 245×247组合颜色级值6世代联合分析的遗传参数估计(E-0模型)
3 结论与讨论
3.1 测量方法
目前辣椒果皮颜色和叶片颜色的测量多采用目测法,徐小万等(2011)采用目测法研究了辣椒子叶紫色和绿色的遗传规律;Hurtadohernandez和Smith(1984)通过目测法对辣椒属不同颜色的彩色甜椒成对杂交和回交,研究出彩色甜椒成熟果实颜色遗传受3对相互独立的基因y、c1和c2控制。目测法虽然简单,但却受人为和环境因素的影响,测量结果准确度不高。而色差仪却能够较准确地测量颜色深浅、光泽度的差异,在番茄(鲁博 等,2008)、黄瓜(申晓青 等,2014)和大豆(章元明等,2001)上已经开始普遍使用。本试验则采用目测法和色差仪相结合的方法对辣椒果皮颜色进行测量,提高了试验准确度。
3.2 辣椒果皮颜色遗传
有关辣椒果皮颜色的研究,Smith(1950)认为绿色成熟果实中仍有叶绿素的存在,将与此相关的基因命名为cl-叶绿素沉积基因;Kormos和 Kormos(1960)认为辣椒属不同成熟果实颜色的形成是3个独立的基因y、c1和c2相互作用的结果,且乳白色的基因型为yc1c2;而王恒明等(2004)则认为y、c1、c2、cl及其等位基因的不同组合控制了彩色甜椒成熟果实颜色的形成,乳白色的基因型为yc1+c2cl,绿色的基因型为yc1c2cl。本试验则通过植物数量性状主基因+多基因模型的多世代联合分析法,更加准确详细地了解到辣椒商品成熟期果色紫色与绿色受1对加性主基因+加性-显性混合多基因控制,紫色与白色受2对加性-显性-上位性主基因+加性-显性-上位多基因控制。试验结果表明,多基因遗传力和环境效应影响弱,主基因遗传力较强,所以在育种时,应在早期分离世代对辣椒商品成熟期果皮颜色进行选择。
由于目前试验方法的局限性,最多只能检测到2对主基因,然而紫色辣椒和白色辣椒的颜色遗传也有可能受3对或3对以上的主基因控制,由此也可以推测出绿色和白色的颜色遗传至少受1对主基因控制。总而言之,为了更加清楚地了解辣椒果皮颜色之间的遗传规律,不仅需要进行更多辣椒果皮颜色之间的杂交组合,还需要进一步完善分析方法。
3.3 环境对果实遗传的影响
辣椒果皮颜色的测量结果表明,辣椒果皮颜色的遗传受基因和环境共同影响,推测环境影响可能与紫色辣椒的褪色有关。因此,在测量紫色辣椒果皮的过程中,应严格控制测量时间,避免出现褪色,影响试验结果。
曹连平,王力民,李锡军.2004.色差仪的应用实践.印染,30(24):33-38.
戴斌.2013.紫色辣椒的农艺性状及色素研究〔博士论文〕.苏州:苏州大学.
盖钧镒.2003.植物数量性状遗传体系.北京:科学出版社.
鲁博,冯辉,王五宏.2008.番茄主要株型参数主基因—多基因混合模型分析.沈阳农业大学学报,39(3):351-353.
阮美颖.2013.紫色番茄果实主要色素积累、果色遗传规律及种质创新研究〔博士论文〕.金华:浙江师范大学.
申晓青,陈书霞,潘玉朋.2014.黄瓜嫩果果皮颜色的遗传研究.农业生物技术学报,22(1):37-46.
石帮志,孙灿慧,陈丽平.2002.贵州紫香稻紫色性状的遗传规律及其在育种中的应用初探.种子,(2):29-30.
隋益虎.2011.辣椒紫色性状遗传分析、相关基因克隆和种间杂种创制〔博士论文〕.南京:南京农业大学.
谭其猛,花宝春,魏宝琴.1964.甘蓝紫色性状遗传规律研究初报.园艺学报,3(1):41-49.
汪琳,应铁进.2000.番茄果实采后贮藏的颜色动力学研究.食品科技,(5):49-51.
王恒明,王得元,李颖.2004.国外彩色甜椒成熟果实颜色遗传研究进展.长江蔬菜,(10):35-38.
王建科,方小雪,李雪红.2013.黄瓜嫩果皮颜色的遗传研究.园艺学报,40(3):479-486.
相丛超,张巍巍,罗双霞.2015.茄子果萼下颜色的遗传分析和SSR标记的相关性分析.河北农业大学学报,38(4):50-55.徐小万,罗少波,李颖.2011.辣椒子叶颜色遗传规律的初步研究.中国农学通报,27(13):281-283.
张宝玺,李锡香.2006.辣椒种质资源描述规范和数据标准.北京:中国农业出版社.
张德双,张凤兰,赵岫云.2011.大白菜(大白菜×紫色小白菜)叶片紫色性状的遗传分析.中国蔬菜,(2):36-38.
章元明,盖钧镒,王永军.2001.利用P1、P2和DH或RIL群体联合分离分析的拓展.遗传,23(5):467-470.
Hurtadohernandez H,Smith P G.1984.Inheritance of mature fruit color in Capsicum annuum L.Journal of Heredity,76(3):211-213.
Kormos J,Kormos K.1960.The genetic types of the carotenoid system of the red-pepper fruit.Acta Botanica Academiae Scientiarum Hungaricae,6:305-309.
Smith P G.1950.Inheritance of brown and green mature fruit color in peppers.Journal of Heredity,41:138-140.
Genetic Analysis on Pepper Peel Color
DING Pan-pan1,2,3,JIANG Hai-kun2,3*,LIU Tong-guang1*,CHEN Peng1,2,3,YI Jian-qun1,2,3,TIAN Hong-mei2,3,WANG Yan2,3,FANG Ling2,3
(1Anhui Agricultural University,Hefei 230031,Anhui,China;2Horticultural Research Institute of Anhui Provincial Academy of Agricultural Sciences,Hefei 230031,Anhui,China;3Key Laboratory of Genetic Improvement and Ecophysiology of Horticultural Crop,Hefei 230031,Anhui,China)
Taking 3 pepper(Capsicum frutescens L.)varieties with peel colors of purple(‘245’),green(‘246’),white(‘247’) as parents,this study crossed ‘245×246’ and ‘245×247’,then constructed 6 generations of genetic population. And by adopting visual grading plus chromatic meter analysis to measure the L value,C value and color value of single commodity pepper plant peel color during maturity on generations of P1,P2,F1,F2,B1and B2. Their peel color inheritances were studied by the method of conjoint analysis on 6 generations. The results showed that the inheritance of fruit peel color traits of commodity maturity accorded with the nucleus of genetic,and the major gene and polygene(D-2 model)inheritance of fruit peel color of commodity maturity in the purple-green combination accorded with the additive and hybrid additive-dominance pattern,that was D-2 model. Its L value,C value and color value of major gene heritability in F2of the purple-green combination were 22.39%,91.39% and 82.26%,respectively. The major gene and polygene(E-0 model)inheritance of fruit peel color of commodity maturity in the purple-white combination accorded with the additivedominance-epitasis pattern.Its L value,C value and color value of major gene heritability in F2of the purplewhite combination were 87.02%,94.34% and 97.54%,respectively. These results indicated that the major gene heritability in F2was stronger,while the polygene heritability and environmental effect were weaker. So the fruit peel color of commodity maturity breeding should be selected in the early generation.
Pepper;Rind color;Purple;Colorimeter;Heredity
丁盼盼,女,硕士研究生,专业方向:蔬菜遗传育种与生物技术,E-mail:1479839234@qq.com
*通讯作者(Corresponding authors):江海坤,男,副研究员,专业方向:蔬菜育种,E-mail:42944543@qq.com;刘童光,男,副教授,硕士生导师,专业方向:蔬菜遗传育种与生物技术,E-mail:ltg3600@ sina.com
2016-09-14;接受日期:2016-11-15
安徽省科技重大专项(15czz03120),安徽省农业科学院科研项目(16D0307),国家现代农业产业技术体系建设专项(GARS-25-G-18),安徽省蔬菜产业技术体系建设任务
