槲皮黄酮对AMPK/NF-κB信号通路介导IL-6表达的影响
2016-04-13何标廉果
何标,廉果
(襄阳市中心医院 药学部,湖北 襄阳 441021)
槲皮黄酮对AMPK/NF-κB信号通路介导IL-6表达的影响
何标,廉果
(襄阳市中心医院 药学部,湖北 襄阳 441021)
目的 探讨槲皮黄酮介导AMPK/NF-κB信号通路对IL-6炎症因子表达的影响。方法 RAW264.7细胞体外培养,采用LPS不同浓度及时间点诱导炎症模型,ELISA法检测IL-6含量;CCK8试验检测槲皮黄酮和LPS(1 ng/mL)对RAW264.7细胞抑制率的影响;槲皮黄酮处理细胞1 h后,加入LPS(1 ng/mL)培养48 h,ELISA法检测IL-6含量;将细胞分为5组后,ELISA法检测IL-6表达水平;Western blot检测细胞核中NF-κB蛋白的表达水平。结果 LPS处理细胞后,分泌IL-6的量明显高于对照组细胞;CCK8实验表明槲皮黄酮和LPS对细胞的抑制作用较弱;槲皮黄酮处理后的细胞分泌IL-6的能力减弱;LPS+AMPK激活剂组、LPS+槲皮黄酮组、LPS+槲皮黄酮+AMPK激活剂组相对于LPS细胞组中IL-6的分泌受到抑制,并且细胞核内NF-κB的表达水平降低。结论 槲皮黄酮通过刺激AMPK含量来抑制NF-κB向细胞核的转移,导致细胞核内NF-κB表达降低而起到抑制炎症因子IL-6的分泌。
槲皮黄酮; 炎症因子; 信号通路
槲皮黄酮(quercetin)是一类黄酮类化合物,具有显著的抗氧化和抗炎症活性,能够治疗多种疾病,如神经退行性疾病、肿瘤、糖尿病及肥胖症等[1-5]。许多疾病的发生均与炎症反应相关,若能对炎症反应进行抑制,可有效改善某些疾病。有关研究表明腺苷酸活化蛋白激酶(AMPK)可介导炎症反应的发生[6-8],还参与细胞内的代谢和能量的平衡[9]。NF-κB是一种核转录因子,介导细胞核内许多蛋白因子的转录,包括调控炎症因子的转录水平。有关研究报道,p-AMPK可以通过抑制NF-κB向细胞核内的转移,从而阻止促炎性细胞因子的产生[10-12]。因此,核因子NF-κB为AMPK的下游作用蛋白。槲皮黄酮的抗炎症活性是否通过AMPK/NF-κB信号通路来影响炎症因子的表达水平未得到证实。本实验通过细菌脂多糖(lipopolysaccharides,LPS)诱导RAW264.7细胞炎症模型,探讨槲皮黄酮调控炎症反应的分子机制,为槲皮黄酮的临床应用提供理论依据。
1 材料与仪器
1.1 材料
槲皮黄酮(Sigma,CAS No.117-39-5,质量分数≥99%);AICAR(AMPK激活剂,美国,纯度≥99%);LPS(Sigma公司);DMEM培养基(Gibcol公司);胎牛血清(FBS,Gibcol公司);GAPDH抗体、p-AMPK抗体、LaminB、NF-κB抗体(GeneTex,USA);ELISA试剂盒(BOSTER公司);RAW264.7细胞(南京科佰生物科技有限公司)。
1.2 主要仪器
Spectra max plus 384型酶标仪(Molecular Devices公司);Odyssey近红外扫描仪(LI-COR Biosciences)。
2 方法
2.1 细胞培养
RAW264.7细胞(小鼠单核/巨噬细胞)用高糖培养基(DMEM)培养,成分包括10%FBS、1%A-A(青霉素-链霉素),于5%(φ)CO2、37 ℃培养箱中培养,待细胞长到80%~90%时便可用于传代培养。传代时先弃去旧培养基,用PBS清洗细胞2次,再加入胰酶消化细胞,待细胞变圆后加入新鲜培养基终止消化,离心倒掉上清,重悬细胞,并以1∶2比例进行传代。
2.2 LPS诱导RAW264.7细胞分泌IL-6的研究
2.2.1 不同浓度LPS对IL-6分泌影响的研究 将RAW264.7细胞重悬后,以4×106个/孔细胞数接种于6孔板中,待细胞贴壁生长到80%~90%时后,每孔加入不同浓度的LPS(0.1、1、10、50 ng/mL)处理细胞,另设空白对照组,在5%CO2、37 ℃培养箱中继续培养24 h,然后收集培养基,采用ELISA试剂盒检测IL-6的分泌水平。
2.2.2 不同时间点LPS对IL-6分泌的影响 将RAW264.7细胞重悬后,以4×106个/孔细胞数接种于6孔板中,待细胞贴壁生长到80%~90%时后,每孔加入1 ng/mL的LPS,在5%CO2、37 ℃培养箱中分别培养3、6、12、24、48 h,然后收集细胞培养基,采用ELISA试剂盒检测IL-6的分泌水平,并在不同时间点设置空白对照。
2.3 槲皮黄酮、LPS对细胞的毒性实验
将RAW264.7细胞重悬后,以1×106个/孔细胞数接种于96孔板中,待细胞贴壁生长到80%~90%时,弃去旧培养基,每孔加入含槲皮黄酮(10、40、80 μg/mL)和LPS(1 ng/mL)的新鲜培养基,设3个复孔,于5%CO2、37 ℃培养箱中继续培养24 h,然后吸去旧培养基,每孔加入含10 μL CCK8试剂新鲜培养基100 μL,继续培养1 h后取出置于酶标仪中,于450 nm处测定吸光度值(A值)。
2.4 槲皮黄酮对细胞分泌IL-6的影响
将RAW264.7细胞重悬后,以4×106个/孔细胞数接种于6孔板中,将细胞分为对照组、LPS组、槲皮黄酮(10、40、80 μg/mL)组,待细胞贴壁生长到80%~90%时后,用槲皮黄酮处理细胞1 h后加入LPS(1 ng/mL)干预细胞48 h,然后收集各孔的细胞上清液,用ELISA试剂盒检测IL-6的分泌水平。
2.5 槲皮黄酮通过刺激AMPK影响IL-6的分泌
将RAW264.7细胞重悬后,以1×107个/孔细胞数接种于直径为10 cm2的培养皿中,将细胞分为对照组、LPS组、LPS+AMPK激活剂组、LPS+槲皮黄酮组、LPS+槲皮黄酮+AMPK激活剂组。各组加入的槲皮黄酮浓度均为40 μg/mL,干预1 h后加入LPS(1 ng/mL)干预细胞24 h,然后再用AMPK激活剂(AICAR,2 μmol/L)处理细胞,24 h后收集细胞上清液及细胞,采用ELISA试剂盒检测上清中IL-6的含量。分别采用细胞质或细胞核蛋白提取试剂盒提取质(核)蛋白,于-80 ℃冰箱保存。
2.6 槲皮黄酮对p-AMPK(胞质)NF-κB(胞核)蛋白表达的影响
采用BCA试剂盒测定蛋白浓度,采用Western blot技术检测蛋白表达水平,每孔上样50 μg蛋白质进行凝胶电泳,电泳完成后将蛋白转移至PVDF膜,然后一抗孵育过夜,洗膜3次后二抗孵育1 h,利用Odyssey近红外扫描仪对GAPDH、p-AMPK、LaminB、NF-κB表达水平进行检测。
2.7 统计学处理
3 结果
3.1LPS促进RAW264.7细胞分泌IL-6
3.1.1 不同浓度LPS对IL-6分泌的影响 结果如图1A所示,不同质量浓度的LPS处理细胞后,均能促进IL-6的分泌量,而LPS浓度为1ng/mL时,RAW264.7细胞分泌的IL-6量最多,与空白对照组细胞比较差异有统计学意义(P<0.05)。
3.1.2 不同时间点LPS对IL-6分泌的影响 结果如图1B所示,当LPS质量浓度为1ng/mL时,RAW264.7细胞分泌IL-6的量随时间的延长而不断增加,与空白对照组细胞比较差异有统计学意义(P<0.05)。
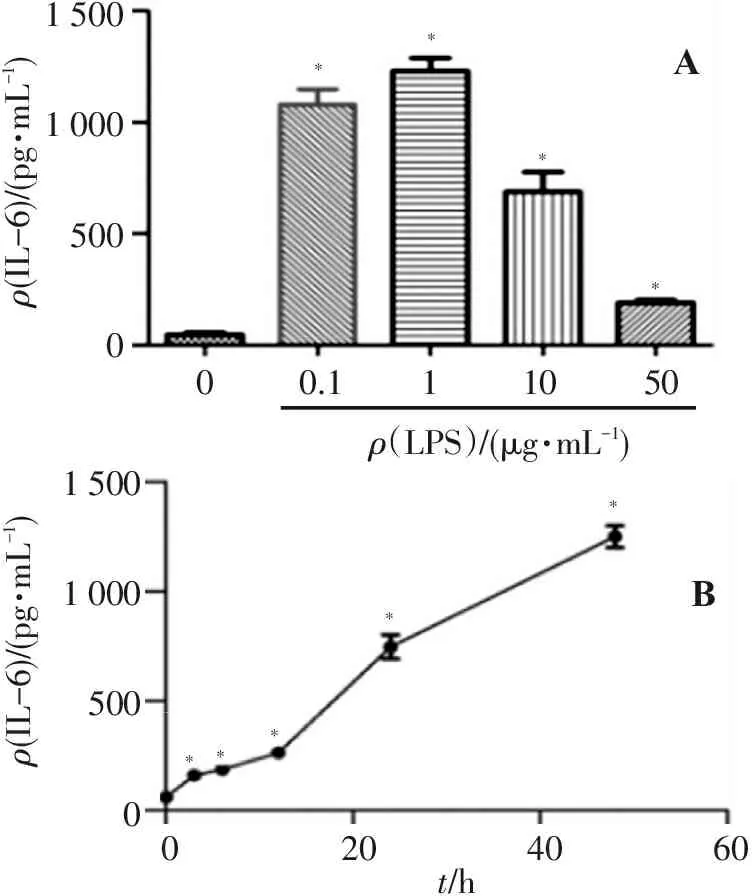
*****2040600150010005000150010005000****105010.10ρ(LPS)/(μg?mL-1)ρ(IL-6)/(pg?mL-1)ABt/hρ(IL-6)/(pg?mL-1)
与空白对照细胞比较:*P<0.05。
图1 LPS在不同浓度及不同时间点对RAW264.7细胞分泌IL-6的影响(n=3)
Figure 1 Influence of LPS at different concentrations and times on the secretion of IL-6 in RAW264.7 cells (n=3)
3.2 槲皮黄酮、LPS对细胞存活率的影响
结果表明,即使是高浓度的槲皮黄酮(80 μg/mL)和LPS(1 ng/mL)对细胞的存活率无明显抑制效应,此时细胞存活率为(95.66±1.12)%,与对照组细胞比较差异无统计学意义(P>0.05)。
3.3 槲皮黄酮对细胞分泌IL-6的影响
结果见图2,与LPS组比较,槲皮黄酮(10、40、80 μg/mL)细胞组分泌的IL-6分别降低了45.8%、56.3%、61.4%,差异有统计学意义(P<0.05)。

150010005000**104080LPS0ρ(槲皮黄酮)/(ng?mL-1)ρ(IL-6)/(pg?mL-1)
与LPS组比较:P<0.05。
图2 槲皮黄酮对LPS诱导的细胞IL-6分泌的影响
Figure 2 Influence of quercetin on the secretion of IL-6 in RAW264.7 cells stimulated by LPS
3.4 槲皮黄酮通过刺激AMPK影响IL-6的分泌
结果如图3所示,LPS组细胞中IL-6的分泌量显著高于对照组细胞,进一步说明细胞炎症模型构建成功;与LPS组比较,LPS+AMPK激活剂组、LPS+槲皮黄酮组、LPS+槲皮黄酮+AMPK激活剂组中细胞分泌的IL-6均显著降低(P<0.05),说明槲皮黄酮通过刺激AMPK来抑制IL-6的分泌。
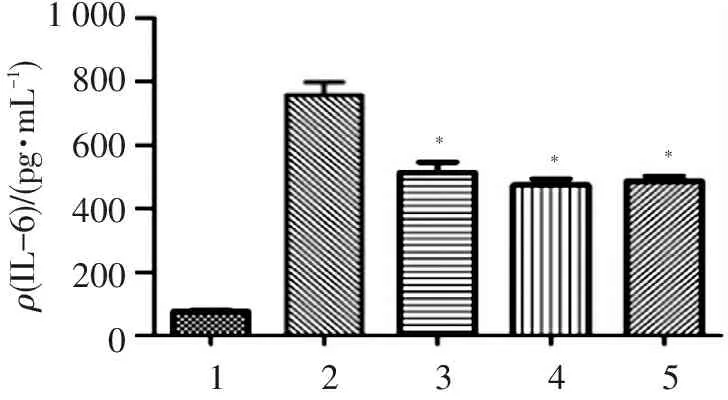
***10008006004002000ρ(IL-6)/(pg?mL-1)12345
1.对照组; 2. LPS组; 3. LPS+AMPK激活剂组; 4. LPS+槲皮黄酮组; 5. LPS+槲皮黄酮+AMPK激活剂组;
与LPS组比较:*P<0.05。
图3 槲皮黄酮通过介导AMPK抑制IL-6的分泌
Figure 3 Inhibition of quercetin on IL-6 secretion in RAW 264.7 cells via AMPK
3.5 槲皮黄酮对p-AMPK(胞质)NF-κB(胞核)蛋白表达的影响
GAPDH、p-AMPK、LaminB、NF-κB表达水平检测结果如图4所示,LPS+AMPK激活剂组、LPS+槲皮黄酮组、LPS+槲皮黄酮+AMPK激活剂组细胞中p-AMPK表达水平相对于LPS组显著降低,而核蛋白NF-κB的表达水平相对于LPS组显著升高,差异均有统计学意义(P<0.05)。
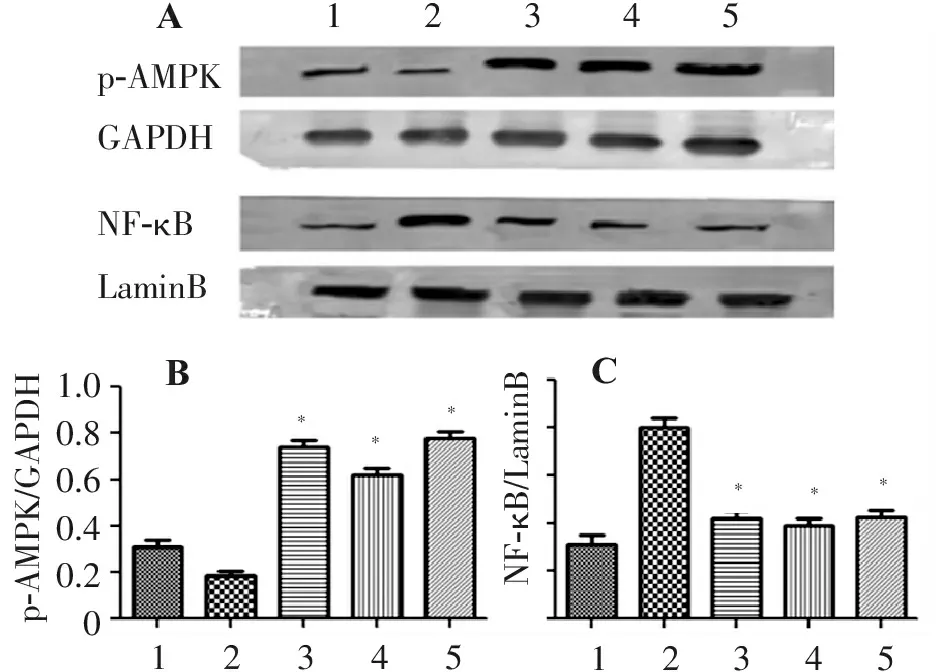
12345123451.00.80.60.40.20p-AMPKGAPDHNF-κBLaminBBCAp-AMPK/GAPDHNF-κB/LaminB12345******
1.对照组; 2. LPS组; 3. LPS+AMPK激活剂组; 4. LPS+槲皮黄酮组; 5. LPS+槲皮黄酮+AMPK激活剂组;
与LPS组比较:*P<0.05。
图4 槲皮黄酮对细胞中p-AMPK和NF-κB蛋白表达的影响(n=3)
Figure 4 Effect of quercetin on the expression of p-AMPK and NF-κB proteins in RAW264.7 cells (n=3)
4 讨论
RAW264.7细胞为小鼠巨噬细胞,属于免疫细胞,主要参与非特异性和特异性免疫反应,其分泌的炎症因子是导致疾病发生的关键[13-14]。研究发现经典活化巨噬细胞可大量分泌促炎因子,如TNF-α、IL-1、IL-6等,而替代活化巨噬细胞则大量分泌抵抗素样分子蛋白家族及壳多糖酶等[15]。
LPS是革兰阴性菌外膜主要成分,对宿主具有毒害,其释放入血液中达到一定程度会产生内毒素血症。研究表明LPS可以通过与Toll样受体(TLR4)结合激活炎症信号通路,包括核因子NF-κB从细胞质向细胞核内的转移,然后与目的基因的启动子结合,促进炎症因子TNF-α、IL-1、IL-6等的表达,导致炎症反应的发生[16]。当LPS被TLR4受体识别后,与接头分子MyD88结合,而活化IRAK后与肿瘤坏死因子受体相关因子-6(TRAF6)结合诱导其活化,再通过一系列级联反应,促使NF-κB向细胞核内的转移,刺激炎症因子的表达。因此,本实验采用LPS刺激RAW264.7细胞来建立炎症细胞模型,为后续实验研究槲皮黄酮抗炎症活性的分子机制奠定了基础。
大量研究表明,大量的中药成分对免疫系统具有较好的调节作用,但其作用的分子机制研究较少。槲皮黄酮是一种黄酮类物质,具有较好的抗炎活性作用,而其对NF-κB信号通路是否有影响的研究未见相关报道。因此,本实验通过建立细胞炎症模型探讨了槲皮黄酮抗炎活性的作用机制。笔者首先通过寻找LPS的最佳给药剂量和给药时间来诱导RAW264.7细胞炎症模型;再通过CCK8实验证实了槲皮黄酮和LPS均对RAW264.7细胞的存活率无明显抑制作用。本实验结果表明:与LPS组比较,LPS+AMPK激活剂组、LPS+槲皮黄酮组、LPS+槲皮黄酮+AMPK激活剂组中细胞分泌的IL-6均显著降低(P<0.05),说明槲皮黄酮通过刺激AMPK来抑制IL-6的分泌;LPS+AMPK激活剂组、LPS+槲皮黄酮组、LPS+槲皮黄酮+AMPK激活剂组细胞中p-AMPK表达水平相对于LPS组显著升高,而核蛋白NF-κB的表达水平相对于LPS组显著降低,差异均有统计学意义(P<0.05)。说明槲皮黄酮可以刺激AMPK的磷酸化水平,抑制NF-κB向细胞核内的转移,降低炎症因子IL-6的表达。
综上所述,槲皮黄酮的抗炎症活性可能是通过作用于AMPK/NF-κB信号通路来达到抗炎的效果,而槲皮黄酮是否存在其他的抗炎机制,尚需进一步研究。
[1] COMALADA M,CAMUESCO D,SIERRA S,et al.Invivoquercitrin antiinflammatory effect involves release of quercetin,which inhibits inflammation through down-regulation of the NF-κB pathway[J]. Eur J Immunol,2005,35(2):584-592.
[2] DOK-GO H,LEE K H,KIM H J,et al. Neuroprotective effects of antioxidative flavonoids,quercetin,(+)- dihydroquercetin and quercetin 3-methyl ether,isolated from opuntia ficus-indica var saboten[J]. Brain Res,2003,965(23):130-136.
[3] LU J,PAPP LV,FANG J,et al. Inhibition of mammalian thioredoxin reductase by some flavonoids:implications for myricetin and quercetin anticancer activity[J]. Cancer Res,2006,66(3):4410-4418.
[4] LU J,ZHENG Y L,LUO L,et al. Quercetin reverses d-galactose induced neurotoxicity in mouse brain[J]. Behav Brain Res,2006,171(9):251-260.
[5] KEMPURAJ D,CASTELLANI M,PETRARCA C,et al. Inhibitory effect of quercetin on tryptase and interleukin-6 release,and histidine decarboxylase mRNA transcription by human mast cell-1 cell line[J]. Clin Exp Med,2006,6(12):150-156.
[6] AHN J,LEE H,KIM S,et al. The anti-obesity effect of quercetin is mediated by the AMPK and MAPK signaling pathways[J]. Biochem Biophys Res Commun,2008,373(5):545-549.
[7] HWANG J T,KWON D Y,YOON S H.AMP-activated protein kinase:a potential target for the diseases prevention by natural occurring polyphenols[J]. New Biotechnol,2009,26(12):17-22.
[8] SUCHANKOVA G,NELSON L E,GERHART-HINES Z,et al. Concurrent regulation of AMP-activated protein kinase and SIRT1 in mammalian cells[J]. Biochem Biophys Res Commun,2009,378(21):836-841.
[9] HARDIE D G.AMPK:a key regulator of energy balance in the single cell and the whole organism[J]. Int J Obes,2008,32(8):S7-S12.
[10] CACICEDO J M,YAGIHASHIi N,KEANEY J J F,et al. AMPK inhibits fatty acid-induced increases in NF-[kappa]B transactivation in cultured human umbilical vein endothelial cells[J]. Biochem Biophys Res Commun,2004,324(14):1204-1209.
[11] PRASAD R,GIRI S,NATH N,et al. 5-Aminoimidazole-4-carboxamide-1-beta-4-ribofuranoside attenuates experimental autoimmune encephalomyelitis via modulation of endothelial-monocyte interaction[J]. J Neurosci Res,2006,84(14):614-625.
[12] GIRI S,NATH N,SMITH B,et al. 5-aminoimidazole-4-carboxamide-1-{beta}-4-ribofuranoside inhibits proinflam-matory response in glial cells:a possible role of AMP-activated protein kinase[J]. J Neurosci,2004,24(16):479-487.
[13] PANT S,DESHMUKH A,GURUMURTHY G S,et al. Inflammation and atherosclerosis-revisited[J]. J Car Pharm Thera,2014,19(2):170-178.
[14] WALLERT M,SCHMOLZ L,KOEBERLE A,et al. alpha-Tocopherol long-chain metabolite alpha-13′-COOH affects the inflammatory response of lipopolysaccharide-activated murine RAW264.7 macrophages[J]. Mol Nut F Res,2015,59(8):1524-1534.
[15] 刘敏,聂汉祥,杨巧玉,等.哮喘小鼠肺间质巨噬细胞的表型特征分析[J].武汉大学学报(医学版),2014,35(3):357-361.
[16] BEUTLER B.TLR4 as the mammalian endotoxin sensor[J]. Cur Topic Microb Immunol,2002,270(12):109-120.
(责任编辑:幸建华)
Influence of quercetin on the expression of IL-6 by AMPK/NF-κB signaling pathway
HE Biao,LIAN Guo
(DepartmentofMedicine,XiangyangCentralHospital,Xiangyang441021,China)
Objective To investigate the influence of quercetin on the secretion of IL-6 by AMPK/NF-κB signaling pathway. Methods RAW264.7 cells were treated with lipopolysaccharide (LPS) at different concentrations and times,and the content of IL-6 was measured using ELISA.The viability of RAW264.7 cells treated with LPS and quercetin were detected by CCK8 assay and IL-6 levels were analyzed by ELISA.The activity of NF-κB was determined by western blot. Results The levels of IL-6 were increased in RAW264.7 cells after LPS challenge.There was no difference between quercetin and LPS on the viability of RAW264.7 cells.Treatment with quercetin inhibited the secretion of IL-6 in a dose-dependent manner.The levels of IL-6 and NF-κB activity were decreased in LPS-stimulated RAW264.7 cells when preconditioned with AMPK activator,quercetin or quercetin with AMPK activator. Conclusion Quercetin may inhibit IL-6 secretion in RAW264.7 cells by upregulation of AMPK activity,which decreases nuclear translocation of NF-κB.
quercetin; inflammatory factor; signaling pathway
2016-05-27
何标(1981—),男,主管药师,主要从事中药药理学研究,Email:384642983@qq.com;通信作者:廉果(1983—),女,主管药师,主要从事中药药理学研究,Email:362145782@qq.com。
时间:2016-09-30 10:14
http://www.cnki.net/kcms/detail/44.1413.R.20160930.1014.003.html
R285
A
1006-8783(2016)05-0634-05
10.16809/j.cnki.1006-8783.2016052701
