应用分子对接技术模拟预测黄芩改善胰岛素抵抗的物质基础
2016-04-13潘思娜王亚玲韩智慧吴纯伟王淑美杨永霞
潘思娜,王亚玲,韩智慧,吴纯伟,王淑美,杨永霞
(广东药科大学 1. 基础学院; 2.中药学院,广东 广州 510006)
医学研究
应用分子对接技术模拟预测黄芩改善胰岛素抵抗的物质基础
潘思娜1,2,王亚玲1,2,韩智慧1,2,吴纯伟2,王淑美2,杨永霞1
(广东药科大学 1. 基础学院; 2.中药学院,广东 广州 510006)
目的 应用分子对接技术模拟预测黄芩改善胰岛素抵抗的活性物质,揭示黄芩改善胰岛素抵抗的物质基础。方法 应用分子对接技术对黄芩所含43种化合物与胰岛素抵抗有关的24个靶点进行对接筛选,并采用Cytoscape软件建立多成分-多靶点网络模型。结果 黄芩中有14个化合物与12个以上的靶点有较好的结合活性。结论 通过分子对接技术模拟筛选出黄芩中改善胰岛素抵抗的活性成分,为中药复方的物质基础研究提供参考。
黄芩; 分子对接; 胰岛素抵抗; 物质基础
胰岛素抵抗(insulin resistance,IR)是指机体对胰岛素生理作用的反应性降低,即胰岛素促进葡萄糖摄取作用受损,其具体表现为外周组织如脂肪和肝脏组织对胰岛素敏感性下降以及对葡萄糖的利用障碍[1]。IR是2型糖尿病的发病基础,也是代谢综合征的核心机制[2]。WHO预计到2025年,全世界糖尿病患者将增加到3亿,我国将达3 800万人[3];目前我国代谢综合征发病率大于15%,患者人数已超过2亿[4]。因此,寻找能减少IR产生及逆转IR的药物与方法已成为当代医药学的迫切需要。黄芩始载于《神农本草经》,列为中品,为唇形科植物黄芩的根[5]。黄芩单独使用或复方对IR的改善具有较好疗效。黄芩有降糖作用,也有治疗糖尿病并发症的作用[6];黄芩提取物能提高胰岛素的敏感性和活化AMPK,治疗糖尿病,改善IR[7];黄连解毒汤对IR大鼠肝线粒体损伤有明显的保护作用[8];葛根芩连汤可以调节糖代谢、提高机体的抗氧化能力、改善大鼠的IR[9]。因此,黄芩具有明确的改善IR的作用。但是,中药成分复杂,黄芩改善IR作用的物质基础尚不清楚。
分子对接技术[10]是从已知结构的受体(靶蛋白或活性位点)和配体出发,通过化学计量学方法模拟分子的几何结构和分子间作用力来进行分子间相互作用识别并预测受体配体复合物结构的方法,也是比较成熟的直接药物设计方法。本研究用分子对接技术,将黄芩中的化合物与IR的相关靶点进行对接,筛选黄芩中可能改善IR的活性成分。
1 材料与方法
1.1 材料
本文应用的软件为Sybyl-X7.3(美国Tripos公司)中的Surflex-Dock模块和Cytoscape 3.0.0。软件运行环境:Microsoft Windows XP Professional操作系统。
1.2 黄芩化合物的收集及准备
从化学专业数据库和《中药原植物化学成分手册》查找并从PubChem化合物数据库(http://pubchem.ncbi.nlm.nih.gov)下载已报道的黄芩所含化学成分,共计43个。利用Sybyl-7.3软件对每个分子进行加氢处理,添加Gasteiger-Hückel电荷、加Tripos力场、以Powell能量梯度法完成能量最小化。
1.3 靶点的收集及准备
根据IR的发病机制及药物治疗方法,查询国内外的文献报道,选取与IR相关的重要靶点作为研究对象,分别有PI3K、AMPK、GLUT4等24个靶点,从RCSB的蛋白质PDB结构数据库下载得到24个靶点的三维晶体结构并保存为PDB格式,见表1。利用Surflex-Dock软件对靶点蛋白进行结构处理。具体操作是提取配体,去除水分子及其他配体,为蛋白质加氢,以AMBER7 FF99力场进行能量优化,选择Automatic模式产生活性口袋,其余参数均为默认设置。1.4 分子对接
将每个化合物分别与24个靶点按默认参数进行分子对接,得到Total Score、Crash、Polar等参数值为对接成功,本文以Total Score参数为评价指标。Surflex-Dock打分函数是以-log10为单位模拟结合能力,Total Score值越大,配体与受体结合越稳定[11]。打分大于5.0的说明分子与靶点有较好的结合活性,打分大于7.0则说明分子与靶点的结合构型具有强烈的活性[12]。
表1 IR相关蛋白靶点
Table 1 Protein targets related with insulin resistance
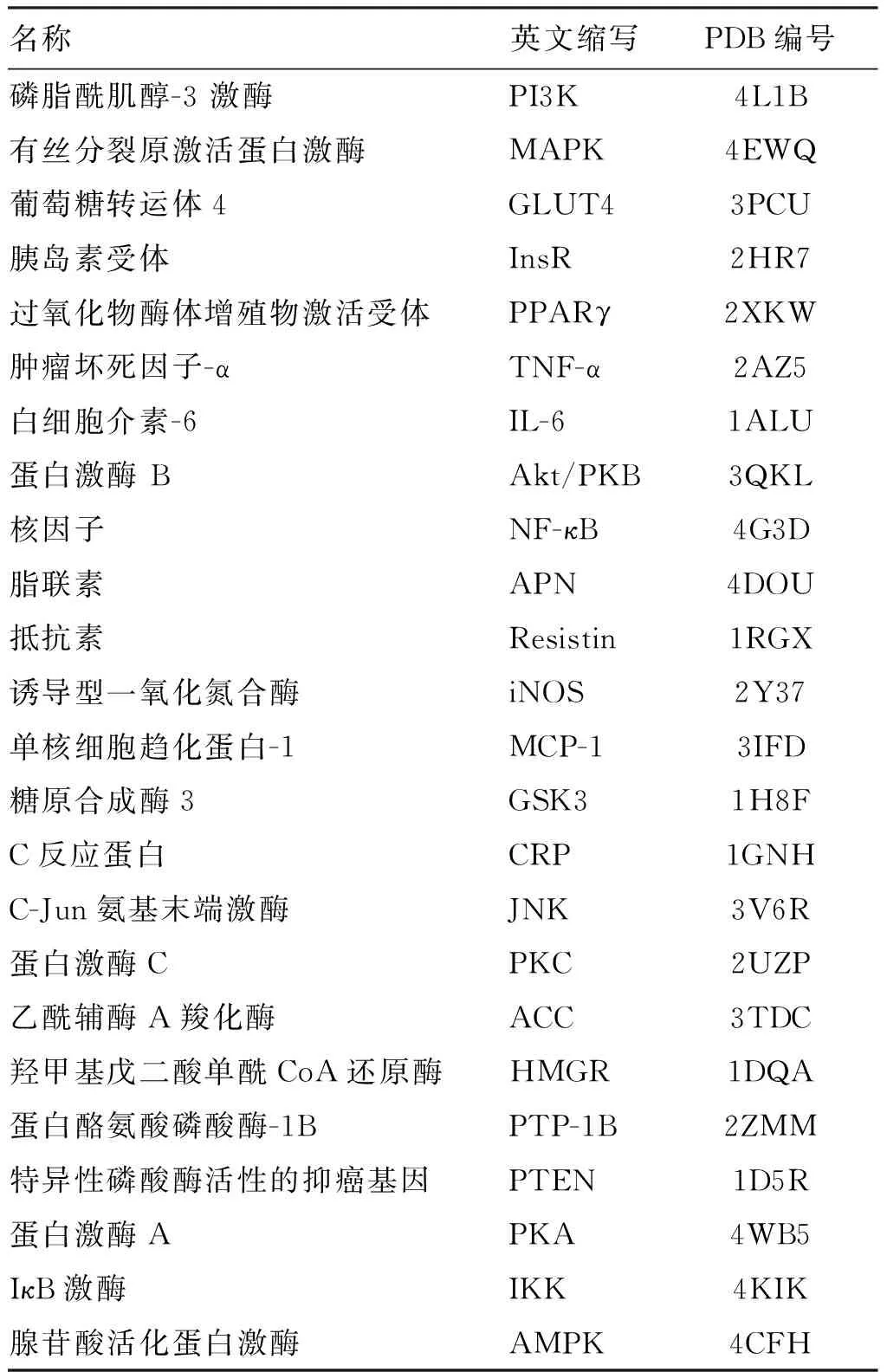
名称英文缩写PDB编号磷脂酰肌醇-3激酶PI3K4L1B有丝分裂原激活蛋白激酶MAPK4EWQ葡萄糖转运体4GLUT43PCU胰岛素受体InsR2HR7过氧化物酶体增殖物激活受体PPARγ2XKW肿瘤坏死因子-αTNF-α2AZ5白细胞介素-6IL-61ALU蛋白激酶BAkt/PKB3QKL核因子NF-κB4G3D脂联素APN4DOU抵抗素Resistin1RGX诱导型一氧化氮合酶iNOS2Y37单核细胞趋化蛋白-1MCP-13IFD糖原合成酶3GSK31H8FC反应蛋白CRP1GNHC-Jun氨基末端激酶JNK3V6R蛋白激酶CPKC2UZP乙酰辅酶A羧化酶ACC3TDC羟甲基戊二酸单酰CoA还原酶HMGR1DQA蛋白酪氨酸磷酸酶-1BPTP-1B2ZMM特异性磷酸酶活性的抑癌基因PTEN1D5R蛋白激酶APKA4WB5IκB激酶IKK4KIK腺苷酸活化蛋白激酶AMPK4CFH
1.5 分子蛋白作用网络的构建
应用Cytoscape 3.0.0软件建立多成分-多靶点网络模型,该网络包括活性成分和靶点2类节点,若某一靶点与某化合物有结合活性,则以边相连。通过网络分析揭示黄芩改善IR的活性成分及作用靶点网络。
2 结果
2.1 分子对接结果
Surflex-Dock软件不仅运行速度快,也具有较高可靠性和准确性。将黄芩中的43个活性小分子与24个靶点蛋白分别进行对接,统计筛选结果。黄芩中14个化合物与12个或12个以上的靶点有比较强烈的相互作用,结果见表2。木蝴蝶素A-7-O-葡萄糖醛酸苷、二氢黄芩苷、汉黄芩素-5-β-D-葡萄糖苷、黄芩苷、滇黄芩新苷、黄芩新素、菜油甾醇、5,2′,5′-三羟基-6,7,8-三甲氧基黄酮、甘肃黄芩素 I、圣草素、豆甾醇、半枝莲种素、5,7,2′-三羟基-6′-甲氧基黄酮、甘黄芩苷元分别与20、17、16、16、16、15、14、14、13、13、13、13、12、12个蛋白有较好的结合活性,提示这些成分可能对黄芩改善IR起重要作用。
2.2 活性成分的多靶点作用研究
采用Cytoscape软件建立14个活性成分与24个靶点间的多成分-多靶点网络模型,见图1。经网络分析,发现黄芩所含化合物与靶点蛋白之间存在复杂的网络关系,这14个活性成分可调控与IR相关的24个靶点。在网络模型中,每个靶点的平均化合物数为8.5,平均每个化合物与14.5个靶点相关联,反映了中药“多成分、多靶点”的特点。其中,JNK、AMPK、MAPK、PI3K、Akt、GSK3等靶点在网络模型中连接度较高,推测其可能是黄芩发挥药效作用的重要靶标。

表2 黄芩分子对接结果Table 2 Results of molecular docking of Scutellaria baicalensis
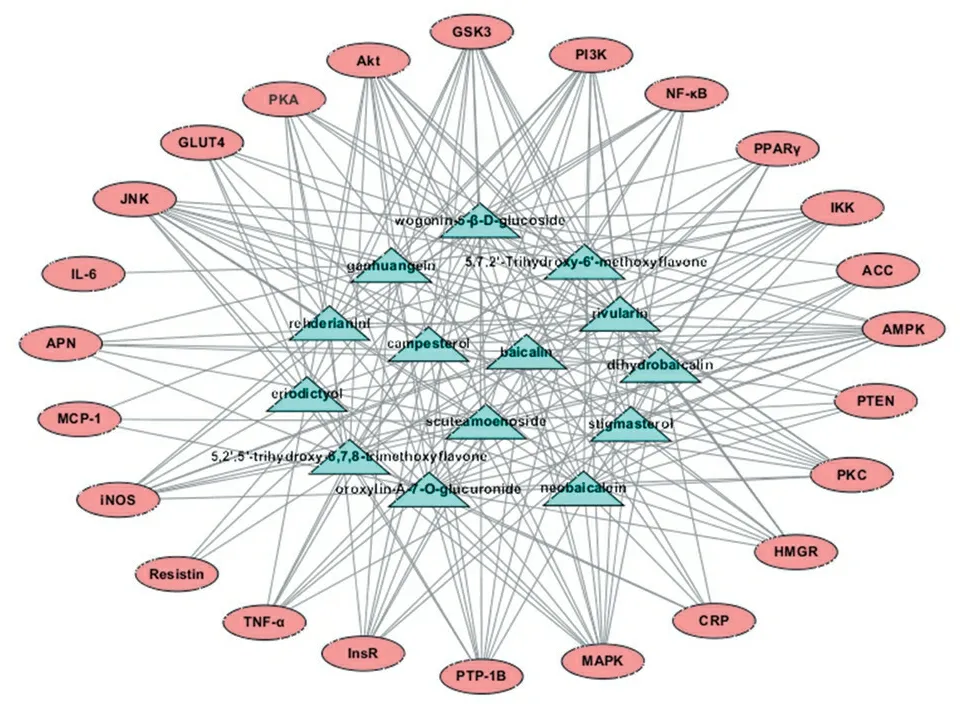
图1 多成分-多靶点网络图
Figure 1 Multi-component and multi-target network
3 讨论
总结最近几年关于IR的研究报道,IR的病理机制主要包含:胰岛素受体前水平、胰岛素受体水平、信号转导通路异常、炎症因子及脂肪因子改变[13-14]。
磷脂酰肌醇3激酶(PI3K)途径是在胰岛素信号转导中起关键性作用,蛋白激酶B(Akt)作为PI3K 途径的下游激酶,能够通过影响糖原合成酶激酶 3(GSK3)、葡萄糖转运体4(GLUT4)等下游分子和蛋白,参与糖原合成、葡萄糖转运及β细胞功能调控等方面参与机体糖代谢调节过程[15-17]。由对接结果可知,与PI3K、Akt、GSK3、GLUT4对接得分大于5的化合物分别有13、13、13、6个,其中与4个靶点蛋白都有较高结合活性的化合物有6个,分别是黄芩新素、5,2′,5′-三羟基-6,7,8-三甲氧基黄酮、半枝莲种素、圣草素、甘肃黄芩素I、5,7,2′-三羟基-6′-甲氧基黄酮。黄芩改善IR机制中PI3K/Akt途径未见报道,推测PI3K/Akt通路可能是重要的潜在靶点,同时以上化合物可能与其通路靶点有关,其药理机制及药效学研究有待进一步验证。
如表2、图1所示,有13个成分均对腺苷酸活化蛋白激酶(AMPK)具有较好的相互作用,提示AMPK可能是黄芩改善IR的主要作用靶点。与前期文献报道的黄芩提取物能活化AMPK,改善IR的结果相吻合[7]。AMPK是一种在细胞内调节能量代谢的蛋白激酶,广泛存在于骨骼肌、肝脏、胰腺和脂肪组织中。羟甲基戊二酸CoA还原酶(HMGR)和乙酰CoA 羧化酶(ACC)分别是胆固醇和脂肪酸合成的关键酶,也是AMPK的底物。激活AMPK可使两者磷酸化失活,从而分别抑制胆固醇和脂肪合成[18-20]。由结果可知,14种化合物中与HMGR打分结果大于5的有9个,分别为二氢黄芩苷、黄芩苷、菜油甾醇、圣草素、豆甾醇、木蝴蝶素A-7-O-葡萄糖醛酸苷、滇黄芩新苷、半枝莲种素、5,7,2′-三羟基-6′-甲氧基黄酮。与ACC有较好结合活性的有二氢黄芩苷、木蝴蝶素A-7-O-葡萄糖醛酸苷、豆甾醇、汉黄芩素-5-β-D-葡萄糖苷、黄芩新素、菜油甾醇6个成分。通过分析,与HMGR、ACC有较好作用的成分都分别与AMPK有较好的结合活性,暗示这些化合物可能是影响AMPK的活性,从而调节胆固醇和脂肪酸的代谢,达到改善IR治疗糖尿病的效果。刘金凤等[21]研究表明,黄芩苷可激活肝和骨骼肌中AMPK,对糖尿病大鼠有一定的保护作用。其他化合物的药效学研究有待进一步研究。
PPAR是一类核转录因子,属核受体超家族成员,有α、β、γ 3种亚型[22]。其中PPARγ通过影响NF-κB、炎症因子、脂肪因子等,调节相关基因的表达,影响糖脂代谢、脂肪形成,其受体激动剂用于治疗高脂血症和2型糖尿病[23-24]。黄芩中菜油甾醇、豆甾醇、二氢黄芩苷、黄芩苷、滇黄芩新苷、汉黄芩素-5-β-D-葡萄糖苷、木蝴蝶素A-7-O-葡萄糖醛酸苷与PPARγ有较好的结合活性。分析这7个化合物可能是黄芩改善IR作用于PPARγ靶点的有效物质。已有研究表明,黄芩苷通过上调PPARγ的表达,升高脂连素水平并降低抵抗素、TNF-α水平,改善IR[25-26]。本研究发现的成分将为后续深入研究黄芩的物质基础提供了方向。
中药所含的化学成分复杂,其药理作用是中药所含多种活性成分通过多途径、多环节和多靶点所表现出的综合或整合作用,作用机制复杂,使得中药物质基础的研究是目前中医药研究面临的最重要、最关键的问题。利用分子对接的方法,黄芩中的14个成分与24个靶点的对接都有12或12个以上的靶点打分大于5。其中,二氢黄芩苷、黄芩苷、木蝴蝶素A-7-O-葡萄糖醛酸苷、滇黄芩新苷、5,2′,5′-三羟基-6,7,8-三甲氧基黄酮、圣草素与24个靶点打分大于7的靶点数目分别有6、4、4、4、3、3个,说明这些成分与靶点具有强烈的结合活性。同时,JNK、MAPK、IKK、GLUT4、PKA与3个以上的成分有强烈的相互作用,推测以上靶点可能也是黄芩改善IR的重要靶标。对网络图1总体分析表明,黄芩中即存在一个成分与多个靶点之间的相互作用,同时也存在不同成分作用于同一个靶点的现象,这一结果也暗示黄芩改善IR可能涉及到多个成分、多个靶点、多生物通路之间的协同作用,同时也符合传统中药的“多成分-多靶点”的特点。
[1] KHAN S,WANG C H.ER stress in adipocytes and insulin resistance:mechanisms and signifiance (Review)[J]. Mol Med Rep,2014,10(5):2234-2240.
[2] MACKAWY A M,BADAWI M E.Association of vitamin D and vitamin D receptor gene polymorphisms with chronic inflammation,insulin resistance and metabolic syndrome components in type 2 diabetic Egyptian patients[J]. Meta Gene,2014,2:540-556.
[3] 何敬和,刘冠男,常震,等.中西医治疗糖尿病研究进展[J].中国康复,2012,27(2):132-134.
[4] 姚东升,刘平,胡义扬,等.中医药治疗代谢综合征研究进展[J].中华中医药学刊,2013,31(5):1113-1115.
[5] 国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2005:211-212.
[6] 蔡薇薇,孟建伟,寇红云,等. 黄芩治疗糖尿病并发症机制研究进展[J].中国药房,2008,19(12):947-949.
[7] SONG K H,LEE S H,KIM B Y,et al. Extracts ofScutellariabaicalensisreduced body weight and blood triglyceride in db/db mice[J]. Phytother Res,2013,27(2):244-250.
[8] 黄琳,陆付耳,杨小玉,等.黄连解毒汤对胰岛素抵抗大鼠肝脏线粒体氧化应激的影响[J].中国中西医结合杂志,2008,28(8):725-728.
[9] 李颖萌,范雪梅,王义明,等. 葛根芩连汤对2型糖尿病大鼠的治疗作用及其机制探讨[J].药学学报,2013,48(9):1415-1421.
[10] 段爱霞,陈晶,刘宏德,等. 分子对接方法的应用与发展[J].分析科学学报,2009,25(4):473-477.
[11] SUN J,CAI S,YAN N,et al. Docking and 3D-QSAR studies of influenza neuraminidase inhibitors using three-dimensional holographic vector of atomic interaction field analysis[J]. Eur J Med Chem,2010,45(3):1008-1014.
[12] 路丽,关琴笑,田元新,等.基于分子对接技术模拟预测大黄用于缺血性脑中风的物质基础[J].中药材,2015,38(4):781-785.
[13] 张世卿,佟丽.胰岛素抵抗作用发生机制及实验模型的研究进展[J].中药新药与临床药理,2012,23(3):364-368.
[14] SAMUEL V T,SHULMAN G I. Mechanisms for insulin resistance:common threads and missing links[J]. Cell,2012,148(5):852-871.
[15] WU W L,GAN W H,TONG M L,et al. Over-expression of NYGGF4 (PID1) inhibits glucose transport in skeletal myotubes by blocking the IRS1/PI3K/AKT insulin pathway[J]. Mol Genet Metab,2011,102(3):374-377.
[16] 迟毓婧,李晶,管又飞,等. PI3K-Akt 信号传导通路对糖代谢的调控作用[J].中国生物化学与分子生物学报,2010,26(10):879-885.
[17] 詹巾卓,李娜,孙汇,等.PI-3K转导通路在Ⅱ型糖尿病发病机制中作用的研究进展[J].北华大学学报(自然科学版),2012,13(2):186-189.
[18] 马泽军,陈莉明.AMPK与胰岛素抵抗[J].国际内分泌代谢杂志,2006,26(1):48-50.
[19] VIOLLET B,LANTIER L,DEVIN-LECLERC J,et al. Targeting the AMPK pathway for the treatment of type 2 diabetes[J]. Front Biosci,2009,14:3380-3400.
[20] OUADDA A B,LEVY E,ZIV E,et al. Increased hepatic lipogenesis in insulin resistance and type 2 diabetes is associated with AMPK signalling pathway up- regulation in psammomys obesus[J]. Biosci Rep,2009,29(5):283-292.
[21] 刘金凤,彭红丽.黄芩苷对链脲佐菌素诱导的糖尿病模型大鼠血糖和血脂及腺苷酸活化蛋白激酶的影响[J].中国药理学与毒理学杂志,2011,25(2):145-150.
[22] HOLNESS M J,SAMSUDDIN S,SUGDEN M C. The role of PPARs in modulating cardiac metabolism in diabetes[J]. Pharmacol Res,2009,60(3):185-194.
[23] 陈俊群,黄起壬.PPARγ与胰岛素抵抗[J].中国医疗前沿,2011,6(20):12-13.
[24] MONSALVE F A,PYARASANI R D,DELGDO-LOPEZ F,et al. Peroxisome proliferator-activated receptor targets for the treatment of metabolic diseases[J].Mediators Inflamm,2013,20(13):549-627.
[25] 沈红燕,吴晓冬. 黄芩苷对大鼠脂肪细胞胰岛素抵抗的改善作用[J].中国临床药理学与治疗学,2011,16(3):263-268.
[26] 刘长山,王秀军,孙丽萍,等.黄芩苷对2型糖尿病大鼠模型胰岛素抵抗的影响[J].中国老年学杂志,2010,30(23):3541-3542.
(责任编辑:幸建华)
Application of molecular docking technology simulation for prediction of the material basis of Scutellaria baicalensis improving insulin resistance
PAN Sina1,2,WANG Yaling1,2,HAN Zhihui1,2,WU Chunwei2,WANG Shumei2,YANG Yongxia1
(1.SchoolofBasicCourses; 2.SchoolofTraditionalChineseMedicine,GuangdongPharmaceuticalUniversity,Guangzhou510006,China)
Objective To predicate the active substances of Scutellaria baicalensis for improvement of insulin resistance by the molecular docking technology. Methods The molecular docking technology was used to analyze the relationship of 43 compounds of Scutellaria baicalensis with 24 targets related with insulin resistance. Meanwhile,multi-component and multi-target network was established by software Cytoscape. Results 14 compounds of Scutellaria baicalensis displayed good binding activities with above 12 targets. Conclusion The molecular docking technology can be used to screen active ingredients of Scutellaria baicalensis for improving insulin resistance,which may provide a reference for study of the material basis of traditional Chinese medicine.
Scutellaria baicalensis; molecular docking; insulin resistance; material basis
2016-06-03
广东省公益研究与能力建设项目(2015A020211033)
潘思娜(1990—),女,2014级硕士研究生,Email:pansnzch@126.com; 通信作者:杨永霞,女,博士,教授,主要从事生物波谱学与代谢组学研究,Email:sheepma@163.com。
时间:2016-09-30 9:48
http://www.cnki.net/kcms/detail/44.1413.R.20160930.0948.002.html
R285
A
1006-8783(2016)05-0629-05
10.16809/j.cnki.1006-8783.2016060301
