负载姜黄素的玉米醇溶蛋白-多糖纳米颗粒的制备及生物活性研究
2016-04-13黄旭琳黄晓霞钟南京高永清胡坤
黄旭琳,黄晓霞,钟南京,高永清,胡坤
(广东药科大学 1.公共卫生学院,广东 广州 510310; 2.食品科学学院,广东 中山 528458)
药剂学
负载姜黄素的玉米醇溶蛋白-多糖纳米颗粒的制备及生物活性研究
黄旭琳1,黄晓霞1,钟南京2,高永清2,胡坤2
(广东药科大学 1.公共卫生学院,广东 广州 510310; 2.食品科学学院,广东 中山 528458)
目的 制备负载姜黄素的玉米醇溶蛋白-多糖纳米颗粒及评价其生物活性。方法 以反溶剂法和静电沉积法制备负载姜黄素的核/壳型复合纳米颗粒,以扫描电镜观察形貌,DPPH·法测定抗氧化活性,平板抑菌试验测定抗菌活性,模拟体外消化试验测定消化吸收率。结果 纳米颗粒为表面光滑的球形,平均粒径为133 nm;姜黄素纳米颗粒对DPPH·自由基的清除率明显高于姜黄素乙醇溶液,清除率分别为(13.89±0.69)、(16.73±0.097) μg/mL;纳米颗粒的抑菌效果较差;纳米颗粒包埋的姜黄素消化吸收率提高了4倍。结论 纳米颗粒包埋的姜黄素具有较高的抗氧化活性及消化吸收率,在功能性食品及药物方面有良好的应用前景。
姜黄素; 玉米醇溶蛋白; 多糖; 纳米颗粒; 抗氧化活性
姜黄素是存在于姜黄(Curcumalonga)根茎中的一种天然脂溶性多酚,是我国传统中药姜黄的主要活性成分。研究表明,姜黄素具有抗氧化、抗感染、抗菌、抗病毒、抗风湿病、神经保护、抑制癌细胞增殖等多种药理活性[1-4]。虽然姜黄素具有多种有益健康的效应,但在药物和营养补充剂方面的应用却非常有限,这主要是因为姜黄素几乎不溶于水,口服姜黄素的生物利用度非常低[2]。
利用玉米醇溶蛋白制备负载姜黄素的纳米颗粒,以提高姜黄素在水中的分散性及生物活性逐渐受到重视[5-6]。玉米醇溶蛋白是玉米的主要储存蛋白,因其疏水性氨基酸含量高,可溶于50%~90%的乙醇溶液而不溶于水[7]。采用反溶剂法制备的纳米颗粒易因玉米醇溶蛋白的疏水相互作用而产生聚集[6]。本课题组利用静电沉积法,将果胶吸附到纳米颗粒表面,利用果胶羧基基团的静电排斥稳定纳米颗粒,制得的纳米颗粒具有较好的水分散性[8],而用海藻酸钠替代部分果胶,可以提高纳米颗粒在中性pH的水相中的分散性[9]。本文用海藻酸钠替代部分果胶,制备负载姜黄素的玉米醇溶蛋白-多糖复合纳米颗粒,研究纳米颗粒包埋的姜黄素清除自由基能力及抗菌活性,并以模拟消化液研究姜黄素的生物利用度,以期开发出具有商业应用价值的姜黄素纳米载体系统。
1 材料与方法
1.1 材料与试剂
玉米醇溶蛋白(医药级,上海抚生实业有限公司);姜黄素(质量分数>98%,Acros Organics);果胶(橘皮果胶)、胃蛋白酶、胰蛋白酶、胆盐、Tween 80、维生素C(美国Sigma-Alorich);海藻酸钠(食品级,青岛明月海藻有限公司);1,1-二苯-2-苦基肼(DPPH,日本Tokyo Chemical Industry);HCl、NaOH、无水乙醇、二甲基亚砜、三氯甲烷等都为分析纯。
大肠埃希菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)、铜绿假单胞菌(Pseudomonasaeruginosa)由广东省微生物菌种保藏中心提供;营养琼脂、营养肉汤(广东环凯微生物科技有限公司)。
1.2 仪器
R05磁力搅拌器(瑞士IKA);pH-3C pH计(上海仪电科学仪器股份有限公司);R-1001N旋蒸蒸发仪(郑州长城科工贸有限公司);Nano-ZS激光粒度仪(英国Malvern);NovaNanoSEM 430场发射扫描电镜(荷兰FEI);TU-1901紫外可见分光光度计(北京谱析通用仪器有限公司)。
1.3 负载姜黄素的玉米醇溶蛋白/果胶纳米颗粒的制备
参照文献[8]方法,预先配制含玉米醇溶蛋白(质量浓度2.0%)和姜黄素(质量浓度0.24%)的乙醇溶液(体积分数85%)、质量浓度为0.2%的果胶和海藻酸钠溶液,将果胶和海藻酸钠溶液按照7∶3的体积比混合,用HCl调节至pH 4.0。
用注射器将4.0 mL姜黄素-醇溶蛋白溶液缓慢分散至16 mL pH 4.0蒸馏水(0.1 mol/L HCl溶液调节)中,分散时以磁力搅拌(1 000 r/min,3 min),旋转蒸发乙醇,并用pH 4.0的蒸馏水补充到20 mL。将制得的分散液注入到25 mL果胶/海藻酸钠多糖溶液中,分散时磁力搅拌(900 r/min,5 min),得到含姜黄素-醇溶蛋白-果胶/海藻酸钠纳米颗粒分散液,调节至pH 4.0,离心(3 000 r/min,10 min)除去大颗粒即为所需的样品。以动态激光散射法测定颗粒的粒径分布。
1.4 纳米颗粒中姜黄素质量分数的测定[8]
取冷冻干燥后的纳米颗粒10 mg,溶于10 mL DMSO中,避光,磁力搅拌2 h(500 r/min),离心(5 ℃,12 000 r/min)1 h,取上清液以DMSO稀释10倍,在433 nm处测定吸光度。同波长下测定不同浓度的姜黄素-DMSO溶液的吸光度,并绘制标准曲线(y=0.15x-0.002,R2=0.996 8,n=6)。通过标准曲线可算出纳米颗粒中姜黄素的质量分数。
1.5 纳米颗粒的扫描电镜(SEM)观察
取少量纳米颗粒黏附于导电胶上,喷金(15 nm)后在场发射扫面电镜下观察,高真空模式,10 kV加速电压,放大倍率×100 000。
1.6 DPPH·自由基清除试验
[10]的方法,并做以下修改:将冷冻干燥的纳米颗粒(溶于去离子水)、姜黄素标准品(乙醇溶解)配制成不同的浓度。然后将100 μmol/L DPPH·乙醇溶液2 mL分别与等体积的纳米颗粒分散液和姜黄素乙醇溶液混合,在室温下避光保存30 min,测量反应溶液的吸光度(571 nm)。达到50%清除率的样品浓度(SC50)用于比较不同样品的自由基清除能力。同时做未负载姜黄素的纳米颗粒的对照试验,以消除玉米醇溶蛋白和多糖的影响。按以下公式计算自由基清除活性:
式中:As和Ac分别是样品和空白的吸光度。
1.7 纳米颗粒抗菌能力的测定
将大肠埃希菌、铜绿假单胞菌和金黄色葡萄球菌菌株分别接种营养肉汤培养基(pH 7.4),稀释至106CFU/mL备用[11]。将冷冻干燥的纳米颗粒溶于双蒸水中制备姜黄素质量浓度分别为240、180、120、60 μg/mL的分散液。往培养皿中加入无菌熔融营养琼脂15~20 mL及106CFU的待测细菌悬液1 mL,待琼脂凝固后进行打孔(d=7 mm)。向孔穴中加入纳米颗粒胶体分散液100 μL,在4 ℃条件下静置4 h,再放置于37 ℃恒温箱培养24 h后测量抑菌圈直径。对照组用等量的姜黄素的DMSO溶液。
1.8 纳米颗粒体外模拟消化吸收能力的测定[12]
1.8.1 模拟胃液消化阶段 准确称取0.1 g冷冻干燥的纳米颗粒(姜黄素质量分数9.52%)或与纳米颗粒组分相同的姜黄素、玉米醇溶蛋白和果胶混合物分散在20 mL双蒸水中,磁力搅拌器搅拌分散1 h(500 r/min),然后加入到20 mL模拟胃液中(含0.064 g胃蛋白酶,质量分数0.2%NaCl,质量分数0.05% Tween 80,盐酸调节pH至1.2),将混合液调整到pH 2.5,在37 ℃恒温摇床保温消化2 h,然后以NaOH溶液调节pH 6.8,终止消化。1.8.2 模拟小肠消化阶段 将胃液消化液置于37 ℃水浴中,依次加入37 ℃预热的胆盐溶液(质量浓度为4.7%)4.0 mL、CaCl2溶液(质量浓度11%)1 mL及胰酶液(质量浓度5.8%)2.5 mL,以恒定pH滴定仪保持体系pH 7.0。加入胰酶液后开始计时,消化时间2 h。
1.8.3 消化液中姜黄素的定量分析 将最终的消化液离心分离(12 000 r/min,30 min),收集上清液并记录体积。取上清液4.0 mL,加入三氯甲烷4.0 mL,涡旋混合2 min,离心分离,取三氯甲烷层。水层再用三氯甲烷4.0 mL提取1次,离心分离后合并三氯甲烷层。在417 nm波长下测定吸光度。同波长下测定不同浓度的姜黄素-三氯甲烷溶液吸光度,并绘制标准曲线(y=0.125 4x-0.001 6,R2=0.999 9,n=6)。通过下式计算姜黄素的消化吸收率:
式中:Ccur指离心后上清液中姜黄素浓度;Vsur指上清液体积;mcur指纳米颗粒中姜黄素的质量。
1.9 数据处理
2 结果与分析
2.1 纳米颗粒形貌特性
激光动态光散射测得的负载姜黄素纳米颗粒的粒径分布见图1A。可见,绝大多数颗粒分布在100~200 nm范围,同时也存在少量的粒径小于100 nm的颗粒。颗粒的平均粒径为133 nm,多分散性指数(PDI)为0.22,说明制备的纳米颗粒粒径均匀。纳米颗粒的微观形貌见图1B。可见,纳米颗粒呈球形,表面光滑,大多数粒径在100~200 nm,与动态光散射法测得的数据一致,经测定冷冻干燥后的纳米颗粒的再分散性,结果表明分散的纳米颗粒溶液为澄清透明状,无肉眼可见大颗粒,使用动态光散射测得的纳米颗粒的平均粒径较新鲜制备的纳米胶体溶液的平均粒径稍大。冷冻干燥后的纳米颗粒产率为(87.86±2.77)%,包封率为(92.9±4.8)%,载药量为(6.2±0.23)%。
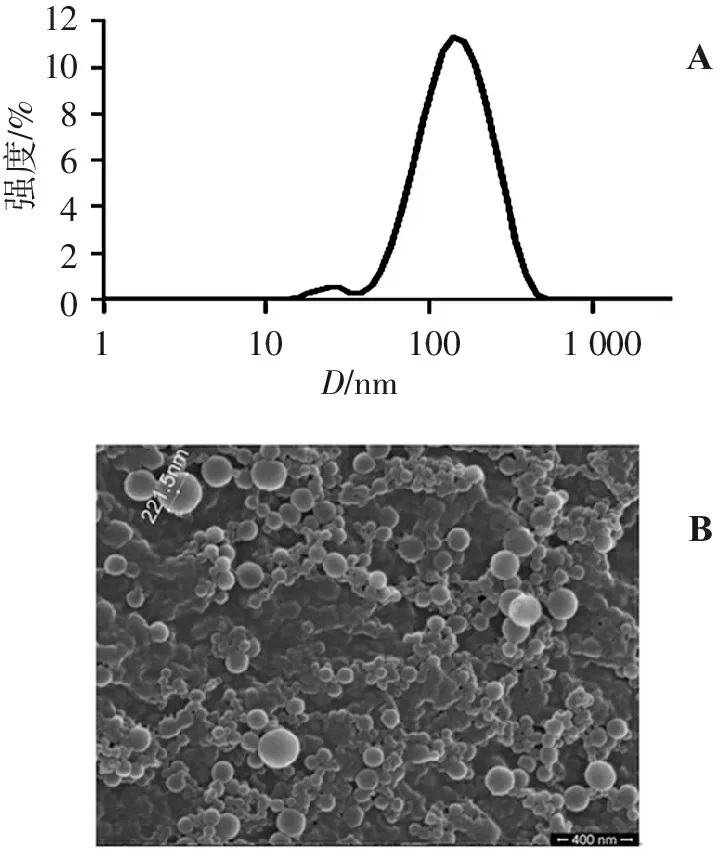
121086420强度/%D/nm1000100101BA
2.2 DPPH自由基清除能力
姜黄素具有较强的清除DPPH自由基能力,但在水中溶解度极低,将姜黄素溶解在乙醇溶液中,能发挥其清除自由基能力。从图2可见,姜黄素乙醇溶液、姜黄素纳米颗粒和维生素C对DPPH·的清除能力呈现剂量依赖型增长,而无姜黄素的纳米颗粒清除自由基的能力极低,且无剂量依存关系。维生素C的自由基清除活性最强,在质量浓度为10 μg/mL时,自由基清除能力已达到90%。当姜黄素质量浓度高于5 μg/mL时,纳米颗粒负载的姜黄素比姜黄素乙醇溶液表现出更强的自由基清除能力,且随着姜黄素质量浓度的增加,近似线性的增加。而乙醇溶解的姜黄素在质量浓度超过20 μg/mL时,清除自由基能力随浓度的增加增幅下降。姜黄素乙醇溶液、纳米颗粒和维生素C的SC50分别为(16.73±0.097)、(13.89±0.69)、(5.04±0.62) μg/mL,3者之间差异有统计学意义(P<0.05),说明包埋后的姜黄素比乙醇溶解的姜黄素具有更强的清除DPPH自由基能力。
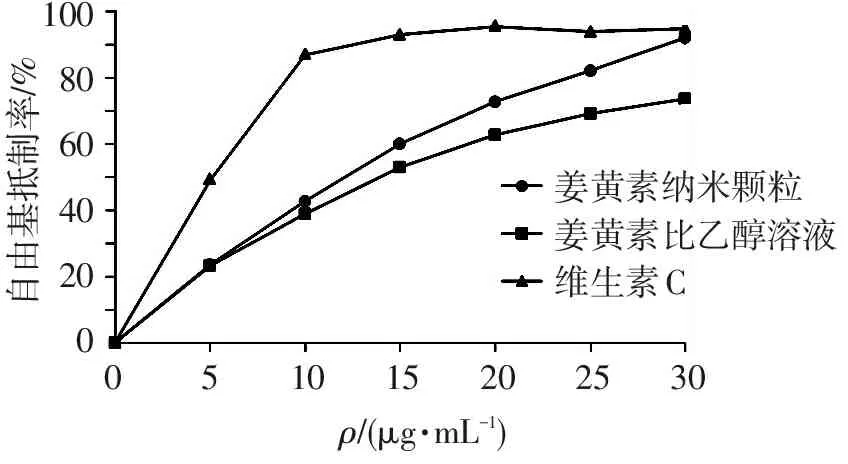
100806040200自由基抵制率/%姜黄素纳米颗粒姜黄素比乙醇溶液维生素C101520253005ρ/(μg?mL-1)
图2 姜黄素对DPPH自由基的清除能力
Figure 2 DPPH radical scavenging activity of curcumin
2.3 姜黄素纳米颗粒的抗菌能力
平板抑菌圈试验测定纳米颗粒负载的姜黄素对大肠埃希菌、铜绿假单胞菌革兰阴性菌(G-)和金黄色葡萄球菌(G+)生长抑制的能力,结果见表1及图3。可见,纳米颗粒负载的姜黄素基本没有抑菌能力;而姜黄素/DMSO溶液则具有显著的抑菌效果,最低浓度为60 μg/mL时,对大肠埃希菌、铜绿假单胞菌和金黄色葡萄球菌都有明显的抑制作用,抑菌环直径分别为(13.0±2.1)、(13.0±0.7)、(14.8±0.8) mm,随着姜黄素浓度增加至240 μg/mL,姜黄素的抑菌效果与剂量之间没有明显的正相关性(P>0.05),如铜绿假单胞菌培养基中,当姜黄素浓度增加到180 μg/mL,抑菌环直径为(16.5±3.35) mm,而浓度为240 μg/mL时,抑菌环直径为(13.5±2.1) mm。

注:左上角和左下角为姜黄素-DMSO溶液;右上角和右下角为包埋的姜黄素胶体分散液。
图3 姜黄素纳米颗粒对大肠埃希菌的平板抑菌环
Figure 3 Antimicrobial ring ofE.coliof curcumin loaded zein/polysaccharide nanoparticles
2.4 姜黄素纳米颗粒体外消化吸收率
以模拟胃肠消化液体外消化负载姜黄素的纳米颗粒及与纳米颗粒组分完全相同的姜黄素-玉米醇溶蛋白-果胶的混合物,评价模拟消化后消化液溶解的姜黄素的量,不能溶解于消化液中的姜黄素被认为不能被人体吸收利用。以消化液中的姜黄素与消化前纳米颗粒或混合物中姜黄素的百分比表示姜黄素的吸收率,结果表明,纳米颗粒包埋的姜黄素消化吸收率为14.8%,而混合物中姜黄素的消化吸收率仅为3.6%(P<0.05)。姜黄素几乎不溶于水,为了增加消化后的姜黄素在水中的溶解度,在模拟胃液消化中添加了质量分数为0.05%的吐温80,以乳化剂的胶束溶解消化后释放的姜黄素。因此,可以认为姜黄素、醇溶蛋白和果胶混合物中的姜黄素能最大限度地被吐温80胶束分散的百分数为3.6%,而纳米颗粒包埋的姜黄素的吸收率增加了4倍。
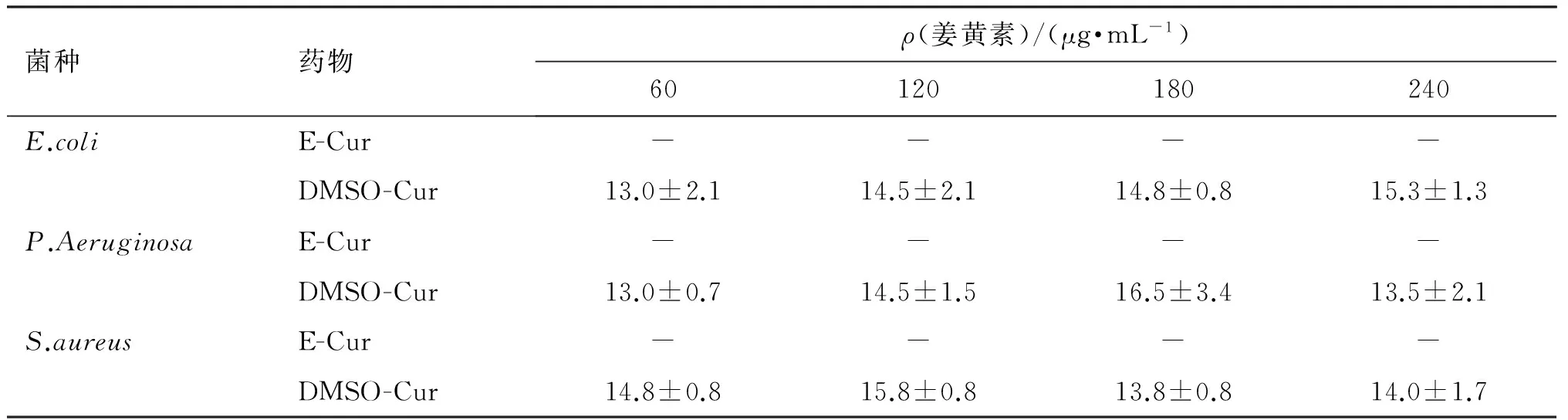
表1 姜黄素纳米颗粒对不同菌株的抑菌能力Table 1 Antimicrobial activity of of curcumin loaded zein/polysaccharide nanoparticles
注:E-Cur为纳米颗粒包埋的姜黄素; DMSO-Cur为DMSO溶解的姜黄素; “-”抑菌环直径<10 mm,为无抑菌作用。
3 讨论
玉米醇溶蛋白等电点约为6.2[7],在pH=4时,蛋白质带正电荷,带阴离子的果胶和海藻酸钠因静电相互作用吸附到玉米醇溶蛋白纳米颗粒的表面,形成核-壳型复合纳米颗粒,并因多糖阴离子的电荷排斥而保持稳定[8]。本课题组前期研究发现,当海藻酸钠替代30%的果胶时,纳米颗粒在中性pH范围能保持稳定[9]。本文在此基础上研究纳米颗粒的生物活性。纳米颗粒负载的姜黄素表现出比乙醇溶解的姜黄素更高的清除DPPH自由基的能力,从而说明纳米颗粒负载姜黄素对提高其抗氧化活性是有效的。但在评价其抗菌活性时,DMSO溶解的姜黄素表现出对革兰阴性和阳性菌都有较好的抑制作用,而纳米颗粒负载的姜黄素却无抑菌作用。这主要是因为抑菌环法需要抗菌物质能快速扩散到琼脂凝胶培养基内才能发挥抑菌作用,而经纳米颗粒包埋的姜黄素扩散到琼脂培养基中的速度很慢,且姜黄素不溶于水,从纳米颗粒扩散出来的姜黄素不能充分分散到培养基,从而不能发挥出抗菌作用[13]。DMSO溶解的姜黄素抗菌活性与剂量之间没有相关性,这也可以从姜黄素的极低溶解性方面去解释。因为高浓度姜黄素溶液滴加到培养基中时,更多的姜黄素析出,不能提高它在培养基中的抗菌效果。
以模拟消化液中溶解的姜黄素占颗粒或混合物中姜黄素的相对含量表征姜黄素经消化后的吸收率,是研究人体消化吸收姜黄素的一种简单经济的模式[3]。人体胃肠液中存在天然的胶束,如脂肪酸胶束或胆酸盐胶束。本文在模拟消化时,加入一定量的吐温80,目的是尽可能地溶解分散消化释放出的姜黄素。吐温80的浓度远高于其临界胶束浓度,因此释放出来的姜黄素能最大程度的被吐温80胶束稳定。本文结果显示,纳米颗粒包埋的姜黄素经消化后在消化液中的浓度是同组分混合物消化后的4倍,这也充分说明经过纳米颗粒包埋的姜黄素能更有效地释放到消化液从而被人体吸收。在后续的研究中,将利用动物模型研究纳米颗粒包埋的姜黄素消化吸收及体内代谢动力学。
参考文献:
[1] KUMAR S S,MAHESH A,MAHADEVAN S,et al. Synthesis and characterization of curcumin loaded polymer/lipid based nanoparticles and evaluation of their antitumor effects on MCF-7 cells[J]. Biochim Biophys Acta,2014,1840(6):1913-1922.
[2] ANAND P,KUNNUMAKKARA A B,NEWMAN R A,et al. Bioavailability of curcumin- problems and promises[J]. Mol Pharm,2007,4(6):807-818.
[3] ANAND P,THOMAS S G,KUNNUMAKKARA A B,et al. Biological activities of curcumin and its analogues (Congeners) made by man and Mother Nature[J]. Biochem Pharmacol,2008,76(11):1590-1611.
[4] BHAWANA,BASNIWAL R K,BUTTAR H S,et al. Curcumin nanoparticles: Preparation,characterization,and antimicrobial study[J]. J Agric Food Chem,2011,59:2056-2061.
[5] PATEL A R,HEUSSEN P C,DORST E,et al. Colloidal approach to prepare colour blends from colourants with different solubility profiles[J]. Food Chem,2013,141(2):1466-1471.
[6] PATEL A R,HU Yingchun,TIWARI J K,et al. Synthesis and characterization of zein-curcumin colloidal particles [J]. Soft Matter,2010,6(24):6192-6196.
[7] SHUKLA R,CHERYAN M. Zein the industrial protein from corn [J]. Ind Crop Prod,2001,13(3):171-192.
[8] HU Kun,HUANG Xiaoxia,GAO Yongqing,et al. Core-shell biopolymer nanoparticle delivery systems: Synthesis and characterization of curcumin fortified zein-pectin nanoparticles[J]. Food Chem,2015,182:275-281.
[9] HUANG Xiaoxia,HUANG Xulin,GONG Yushi,et al. Enhancement of curcumin water dispersibility and antioxidant activity using core-shell protein-polysaccharide nanoparticles[J]. Food Res Int,2016,87:1-9.
[10] ZOU Yanping,LU Yanhua,WEI Dongzhi. Antioxidant activity of a flavonoid-rich extract ofHypericumperforatumL.invitro[J]. J Agric Food Chem,2004,52(16):5032-5039.
[11] 中华人民共和国卫生部.食品安全国家标准,食品微生物学检验,菌落总数测定:GB 47892—2010[S].北京:中国标准出版社,2010.
[12] YANG Ying,MCClEMENTS D J. Vitamin E bioaccessibility: influence of carrier oil type on digestion and release of emulsified α-tocopherol acetate[J]. Food Chem,2013,141(1):473-481.
[13] WATTANASATCHA A,RENGPIPAT S,WANICHWE-CHARUNGRUANG S. Thymol nanospheres as an effective anti-bacterial agent[J]. Int J Pharm,2012,434(1/2):360-365.
(责任编辑:陈翔)
Study on the preparation and biological activity of curcumin loaded zein/polysaccharide nanoparticles
HUANG Xulin1,HUANG Xiaoxia1,ZHONG Nanjing2,GAO Yongqing2,HU Kun2
(1.SchoolofPublicHealth,GuangdongParmaceuticalUniversity,Guangzhou510310,China; 2.SchoolofFoodScience,GuangdongParmaceuticalUniversity,Zhongshan528458,China)
Objective To prepare curcumin loaded zein/polysaccharide nanoparticles and study their bioactivity. Methods Curcumin loaded zein/polysaccharide core-shell biopolymer nanoparticles were synthetized with anti-solvent and electrostatic deposition method. Scanning electron microscope was used to observe the morphology; DPPH· method was carried out to evaluate the antioxidant activity; the antibacterial activity was determined by plate inhibition test and the bioavailability was detected by the simulative digestive experimentinvitro. Results The curcumin nanoparticles were spherical with smooth surface and average diameter 133 nm; the DPPH· scavenging rate of curcumin nanoparticles was superior to that of curcumin ethanol solution with SC50(13.89±0.69) μg/mL and (16.73±0.097) μg/mL,respectively. But the antimicrobial activity of nanoparticles was unsatisfactory; the bioavailability of encapsulated curcumin increased 4 times than that of free curcumin. Conclusion The encapsulated curcumin nanoparticles exhibited superior antioxidant activity and bioavailability,which might be used in functional food and medicine.
curcumin; zein; polysaccharide; nanoparticles; antioxidant
2016-06-21
广东省科技厅国际合作项目(2015A050502051)
黄旭琳(1991—),女,2014级硕士研究生,Email:xulin_h@163.com;通信作者:胡坤(1975—),男,教授,从事食品活性成分及其输送体系研究,Email:huk88@126.com。
时间:2016-09-30 16:39
http://www.cnki.net/kcms/detail/44.1413.R.20160930.1639.010.html
R944
A
1006-8783(2016)05-0545-05
10.16809/j.cnki.1006-8783.2016062103
