活性自由基聚合法制备多壁碳纳米管表面槲皮素分子印迹聚合物及其应用
2016-04-13热萨莱提伊敏热娜古丽阿不都热合曼买买提吐尔逊木合塔尔吐尔洪
热萨莱提·伊敏,热娜古丽·阿不都热合曼,买买提·吐尔逊,木合塔尔·吐尔洪,2*
(1.喀什大学 化学与环境科学学院,新疆 喀什 844000;2.新疆特色药食用植物资源化学重点实验室,新疆 喀什 844000)
活性自由基聚合法制备多壁碳纳米管表面槲皮素分子印迹聚合物及其应用
热萨莱提·伊敏1,热娜古丽·阿不都热合曼1,买买提·吐尔逊1,木合塔尔·吐尔洪1,2*
(1.喀什大学 化学与环境科学学院,新疆 喀什 844000;2.新疆特色药食用植物资源化学重点实验室,新疆 喀什 844000)
为了制备能有效分离富集药草中槲皮素的固相萃取柱,以丙烯酰胺(AM)修饰的碳纳米管为载体,三硫代碳酸酯(DBTTC)为可逆加成-断裂链转移剂(RAFT试剂),槲皮素为模板,甲基丙烯酸(MAA)为功能单体,乙二醇二甲基丙烯酸酯(EGDMA)为交联剂,乙腈为致孔剂,制备了槲皮素分子印迹聚合物,采用红外光谱、扫描电镜和热重分析对印迹材料进行表征,通过高效液相色谱(HPLC)研究聚合物的吸附性能和对底物的特异性识别能力。结果表明,通过活性自由基聚合法合成的多壁碳纳米管表面槲皮素分子印迹聚合具有更好的形态结构和吸附性能,且对槲皮素有很好的特异性识别能力。
活性自由基聚合;多壁碳纳米管;表面印迹;槲皮素;吸附性能
分子印迹聚合物是具有特异性识别能力、特定功能基团以及孔穴大小和形状的新型高分子材料。在高效液相色谱[1-2]、电化学传感器[3-4]、毛细管电泳分析、手性分离中用于样品的预处理、分离富集和快速检测等[5-7]。但分子印迹技术在实际应用中仍受到诸多因素的影响和制约,为了克服传统印迹聚合物呈块状、颗粒较大、使用前需研磨过筛的缺点[8],人们不断探寻新的制备技术以改善印迹识别效能,并提高其实际适用性[9]。以具有高比表面积、高比表面能、高反应活性等[10]特征的多壁碳纳米管为载体的表面印迹技术近年来受到了研究者的关注和重视[11-13]。碳纳米管表面很难直接修饰印迹聚合物,制备的印迹复合材料在固相萃取过程中由于吸附力不够,萃取压力过大而难以使用,所以使用前必须对其进行表面修饰。由于表面修饰的碳纳米管表面接枝而制备的印迹聚合物的印迹空穴排列在碳纳米管的表面上,从而为质量传递且在介质中对特定化合物的可接近性提供了方便[14-16]。并且为了减少双分子偶合、歧化终止和链转移等副反应以及克服聚合反应过程难以控制等一些困难[17],可在聚合反应体系中加入可逆加成-断裂链转移(RAFT)自由基,使得形成的聚合物均匀且聚合步骤易于控制。
本文在前期研究工作的基础上[17],进一步制备出以丙烯酰胺修饰的碳纳米管为载体的分子印迹聚合材料,并将其作为高效液相色谱固定相,用于维吾尔中草药蜀葵花中的活性成分槲皮素的分离分析,发现表面修饰的槲皮素分子印迹聚合物比传统分子印迹聚合方法合成的槲皮素聚合物颗粒更加均匀,具有更好的吸附性能,克服了传统方法合成的聚合物呈块状、颗粒较大、需研磨过筛,且聚合物的高度交联使其内部模板分子洗脱比较困难,印迹孔穴有“深埋”等[8]缺点,为进一步开发利用地方民族医药及其分离富集方面提供新型、先进、可靠的检测技术。
1 实验部分
1.1 试剂与仪器
槲皮素(中国药品生物制品检定所),山萘酚对照品(中国药品生物制品检定所);多壁碳纳米管(MWCNTs,直径30~40 nm,纯度>95%),丙烯酰胺(AM,分析纯,天津市福晨化学试剂厂);甲基丙烯酸(MAA,分析纯,天津大茂化学试剂厂,使用前减压蒸馏处理);氯化苄、二硫化碳(分析纯,天津化学试剂有限公司);乙二醇二甲基丙烯酸酯(EDMA,分析纯,山东烟台云开化工有限责任公司);偶氮二异丁腈(AIBN,化学纯,上海试四赫维化工有限公司);甲醇、乙腈(色谱纯,天津市光复精细化工研究所);四正丁基溴化胺(分析纯,上海试剂总厂),实验用水为高纯水,其它试剂均为分析纯。
岛津LC-20AT高效液相色谱仪(配有SPD-M20A 二极管阵列检测器,DGU-20A5 在线脱气机,LC-solution 工作站);STA7200热重分析仪;IR200红外分析仪;ZK-82B 真空干燥箱(上海市实验仪器总厂);KQ-200VDB型双频声控超声波清洗器(昆山市超声波仪器厂);分析天平(FA2104型);80-1型沉淀离心器(上海手术器械厂);SHA-C型水浴恒温振荡器(江苏金坛亿通电子有限公司)。
1.2 多壁碳纳米管的表面修饰与接枝分子印迹聚合物
由于多壁碳纳米管表面直接修饰印迹聚合物很困难,而且制备的印迹高分子材料进行固相萃取时具有吸附力不够、萃取压力过大等缺点,因此需先对碳纳米管进行修饰。称取1.000 0 g MWCNTs,加入30 mL浓硝酸和90 mL水,回流反应8 h,完成MWCNTs的羧基化,用微孔滤膜抽滤、真空干燥24 h,再加入二氯亚砜100 mL回流反应24 h进行酰氯化,抽滤、真空干燥24 h后,以DMF为溶剂加入两倍的丙烯酰胺完成表面修饰。
合成分子印迹聚合物:称取表1所示的各反应物之后将反应器密封,溶液超声10 min,通氮气10 min,静置1 h后,于60 ℃下沉淀聚合24 h。反应完成后,聚合物冷却至室温,真空干燥24 h后,滤纸包装好聚合物装在索氏提取器中,用体积比为1∶4的醋酸-甲醇溶液反复洗涤24 h,以除去模板分子及未聚合的功能单体和交联剂,然后用甲醇洗脱醋酸6 h,聚合物真空干燥24 h,得到聚合物MWCNTs-MIP1~MWCNTs-MIP4。

表1 合成聚合物 MIP1~ MIP4所需反应物的量Table 1 Amount of each reactant required for the synthesis of polymer MWCNTs -MIP1~ MWCNTs -MIP4
1.3 分子印迹聚合物的表征
采用扫描电子显微镜对真空干燥后 MIP1~ MIP4的微观形貌进行观察,用红外光谱仪扫描聚合物的吸收(用KBr压片制样,在分辨率为4 cm-1,4 000~500 cm-1区间内测定),采用STA7200型热重分析仪测定重量随温度变化的特性,测试条件为:流动氮气气氛,流速为200 mL/min,升温速率10 ℃/min,温度范围30~700 ℃。
1.4 吸附等温线测定
称取分子印迹聚合物 MIP1~ MIP4各20 mg,置于10 mL吸附管中,分别加入5,10,20,40,60,80,100,120 μg/mL浓度的槲皮素甲醇溶液,室温下振荡4 h,上清液以3 000 r/min离心15 min,用HPLC 检测上清液浓度,平行测定3 次,取平均值。根据差减法计算印迹材料对槲皮素结合量,计算其吸附量。
1.5 吸附动力学测定
称取20 mg分子印迹聚合物 MIP1~MIP4,置于25 mL吸附管中,加入100 μg/mL槲皮素甲醇溶液,室温下振荡,每隔40 min取上清液2 mL,直至500 min,3 000 r/min离心15 min,用HPLC 检测上清液浓度,平行测定3 次,取平均值。根据差减法计算印迹材料对槲皮素的结合量,计算其吸附量。计算公式:Qa=(C0-C1)V/M,其中Qe为吸附量(μg/mL),C0和C1分别为槲皮素甲醇溶液吸附前后浓度(μg/mL),V为槲皮素标准溶液体积,M为加入表面修饰过的碳纳米管质量(20 mg)。
1.6 固相萃取选择性实验
考察了分子印迹聚合物对模板槲皮素和结构相似的山萘酚的吸附性能,色谱柱为Agilent HC-C18柱(5 μm,250 mm×4.6 mm),以甲醇-0.4%磷酸(50∶50)为流动相,流速为1.0 mL/min,检测波长为360 nm,柱温为30 ℃,进样量为10 μL色谱条件下以聚合物 MIP4为萃取柱分离测定蜀葵花中的槲皮素和山萘酚。
样品处理:准确称取干燥、粉碎、过筛(60目)的蜀葵花粉末2.0 g(维吾尔药材蜀葵花于2013年7月购自喀什地区沙车县维吾尔医院生药库房的干燥花),以固液比为1∶25加入65%乙醇回流提取1 h,提取2次,抽滤,合并滤液进行浓缩至干,冷却至室温,用甲醇定容至50 mL,摇匀,过0.45 μm微孔滤膜后进行HPLC分析。
固相萃取:精确称取300 mg印迹分子 MIP4置于放置板的固相萃取柱中,并用筛板盖住,以10 mL甲醇对柱子进行活化后,用水淋洗柱子,量取10 mL 已处理的蜀葵花提取液以5 mL/min 的流速通过萃取柱,并用甲醇洗掉分子印迹聚合物上的非特异性吸附的其他物质,收集淋洗液,待HPLC检测,然后用40 mL甲醇-醋酸溶液将模板分子洗脱下来,收集洗脱液浓缩后用甲醇定容,采用HPLC 检测。
2 结果与讨论
2.1 聚合条件对于分子印迹聚合物结构形态的影响
从图1可知,在反应体系中加入RAFT试剂合成的聚合物 MIP4的形状比不加RAFT试剂合成的聚合物 MIP2的颗粒形状均匀,空隙分布好,原因可能是由于传统方法的聚合反应过程较难以控制。
2.2 聚合物的红外扫描结果

2.3 聚合物的热重分析结果
图3为MWCNTs和MIP4在30~700 ℃范围内的热重分析结果,从图中可以看出,在30~100 ℃有1个失重峰,失重率为3.96%,这是聚合物表面吸附的水和未干燥完全的溶剂的失重;100 ~600 ℃内MWCNTs无失重,而聚合物MWCNTs-MIP4有两次失重,一个在302.5 ℃,这是聚合物非特异性即物理性包覆造成的,另一个在570.7 ℃左右,是聚合物的特异性即化学性包覆造成的。对比MWCNTs和聚合物MIP4的热重图并且扣除100 ℃前溶剂的失重,估算出碳纳米管表面其他分子的接枝率为95.0%(总失重率为98.96%)。
2.4 印迹材料的吸附性能
吸附等温线能很好地反映聚合物的吸附性能,为研究聚合物对槲皮素的结合特异性,分别采用MIP1~MIP4对8种不同初始质量浓度的槲皮素甲醇溶液进行吸附试验,从图4可以看出,对于相同浓度的槲皮素甲醇溶液,MIP4和MIP2与MIP3和MIP1的吸附性能差异较大,相比之下,MIP4具有更好的吸附性能,因为此印迹聚合物上,有模板分子槲皮素洗脱之后留下的对槲皮素有特异性识别功能的 “空穴”;而合成空白组MIP3时,不加入槲皮素,所以不具有这种特异性吸附能力的结合点,吸附均为非特异性吸附,吸附能力较低。
2.5 印迹材料的吸附动力学
随着吸附时间的增加,MIP4和MIP2对槲皮素的吸附量呈增加的趋势(图5),相比之下MIP4对模板有更好的吸附性能,且吸附量在前140 min内急剧增加,在140 min时达640 μg/g(最大为700 μg/g),之后吸附量增速逐渐降低并基本接近饱和。原因是开始阶段槲皮素先吸附在聚合物表面特异性识别的孔穴,这种表面吸附的传质阻力小,有利于聚合物对槲皮素的快速吸附,而表面孔穴达到吸附饱和后,槲皮素透过聚合物表面传到内部空穴,受到的阻力较大,导致其吸附速度下降,在较长时间后才达到吸附平衡。
2.6 聚合物对底物的选择性吸附
选择聚合物MIP4为萃取柱,按照“1.6”实验条件,对蜀葵花(Althaea rosea L)中槲皮素进行了分离富集,表明利用槲皮素分子印迹聚合物固相柱可萃取蜀葵花中槲皮素,并与山萘酚有明显的分离。标准溶液的线性范围均为12.5~125 μg/mL,r分别为0.999 9和0.998 8。洗脱液中槲皮素的浓度为81 μg/mL(RSD为3.9%,n=4),最大载样量为552 μg/g,吸附率达到86%。从图6可以看出,蜀葵花提取液通过槲皮素分子印迹聚合物萃取后,大量槲皮素被印迹聚合物特异性吸附,而山萘酚也有吸附,这是因为分子印迹聚合物对山萘酚有一定的非特异性吸附,即物理性吸附,但这种吸附并不强,这说明分子印迹聚合物MIP4上的模板分子槲皮素洗脱之后留下了对槲皮素有特异性识别功能的 “空穴”。因此,印迹聚合物MIP4作为固相萃取柱并用于药草中槲皮素的分离和富集是可行的。
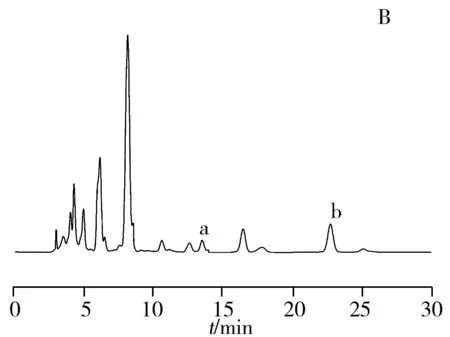
图6 分子印迹聚合物的固相萃取色谱图
Fig.6 Chromatograms of selectivity of molecularly imprinted solid extraction
A.HPLC of Althaea rosea L solution;B.HPLC of solution after extraction;C.HPLC of eluate;peak a:quercetin;b:kaempferol
3 结 论
本文以丙烯酰胺修饰的碳纳米管为载体,以DBTTC为可逆加成-断裂链转移剂,槲皮素为模板,MAA功能单体,EGDMA为交联剂,乙腈作为致孔剂,制备了槲皮素分子印迹聚合物,并将碳纳米管表面印迹的槲皮素印迹聚合物作为HPLC固定相,将其用于维吾尔中草药蜀葵花中槲皮素的分离分析。结果表明,通过活性自由基聚合法合成的多壁碳纳米管表面槲皮素分子印迹聚合物具有更好的形态结构和吸附性能,并且对槲皮素有很好的特异性识别能力,在分离富集蜀葵花中槲皮素时,吸附率达到86%。以本文合成的聚合物MIP4作为固相萃取柱为在中草药中槲皮素的分离富集提供了可能。
[1] Rong J F,Wei H,Huang H S,Li Y J,Xu M Z.J.Instrum.Anal.(荣杰峰,韦航,黄伙水,李亦军,许美珠.分析测试学报),2016,35(1):8-15.
[2] Zhang H B,Zhang C H,Nie Y,Hu Y F,Zou H Y,Yao S Z.Chin.J.Anal.Chem.(张华斌,张朝晖,聂燕,胡宇芳,邹海英,姚守拙.分析化学),2009,7:955-959.
[3] Peng Y Y.J.Instrum.Anal.(彭友元.分析测试学报),2013,32(12):1427-1432.
[4] Tang T,Tang C G,Zeng Y B,Li L,Pan Y D,Xu Q X,Xiao P X,Ye B Q.J.Instrum.Anal.(唐婷,汤传贵,曾延波,李蕾,潘样丹,徐启祥,肖平秀,叶冰青.分析测试学报),2015,34(11):1253-1258.
[5] Qiu X Z,Peng C H,Wang S L,Guo H S,Lu L Q.J.Instrum.Anal.(丘秀珍,彭翠红,王少玲,郭会时,卢吕泉.分析测试学报),2015,34(12):1403-1407.
[6] Chen X J,Wang J,She Y X,Ye Q,Cao W Q.J.FoodSaf.Qual.(陈孝建,王静,佘永新,叶青,曹维强.食品安全质量检测学报),2014,5(5):1459-1467.
[7] Zhao Y F,Zhang W H.J.Instrum.Anal.(赵永福,张文华.分析测试学报),2015,34(8):953-957.
[8] Yang W H,Yan S L,Wei C,Wang Q Z.ActaPolym.Sin.,2010,(10):1163-1169.
[9] Liu H,Shi Y,Wang D,Yang G,Yu A,Zhang H.J.Pharm.Biomed.Anal.,2003,32:479-485.
[10] Li H,Li Y Z,Li Z P,Li Y N,Peng X Y.J.Funct.Mater.(李辉,李玉琢,李志平,李亚男,彭夕洋.功能材料),2012,43(6):684-687.
[11] Yang LW,Liu H M,Qu H M,Zeng S J,Xiong Y Q,Xu W J.Chin.J.Appl.Chem.,2008,25(2):137-141.
[12] Kan X,Zhao Q,Zhang Z,Wang Z,Zhu J.Talanta,2008,75:22-26.
[13] Gao D,Zhang Z,Wu M,Xie C,Guan G,Wang D.J.Am.Chem.Soc.,2007,129:7859-7866.
[14] Claudio B,Patrizia B,Cristina G,Laura A,Cinzia P,Gianfranco G.J.Chromatogr.A,2011,1218:1828-1834.
[15] Tan C J,Hong Chu G,Ker K H,Tong Y W.Anal.Chem.,2008,80(3):683-692.
[16] Baggiani C,Anfossi L,Baravalle P,Giovannoli C,Giraudi G,Barolo C,Viscardi G.J.Sep.Sci.,2009,32(19):3292-3300.[17] Tursun M,Emin R,Dawut G,Chu G H,Jelil M,Turhon M.Chem.J.Chin.Univ.(买买提·吐尔逊,古丽巴哈尔·达吾提,热萨莱提·伊敏,楚刚会,买合木提江·杰力,木合塔尔·吐尔洪.高等学校化学学报),2015,36(12):2402-2408.
Preparation of Quercetin Imprinted Polymer on Surface of Multi-walled Carbon Nanotubes by Living Radical Polymerization and Its ApplicationResalat EMIN1,Renagul ABDURAH
MAN1,Mamat TURSON1,Muheta'er TUERHONG1,2*
(1.Chemistry and Environmental Science College,Kashgar University,Kashgar 844000,China;2.Key laboratory of Xinjiang Native Medicinal and Edible Plant Resources Chemistry,Kashgar 844000,China)
In order to prepare the solid phase extraction column for the effective separation and enrichment of quercetin in the medicinal herb,a novel surface molecularly imprinted polymer was synthesized by a reversible addition fragmentation chain transfer(RAFT) polymerization method,combining molecular imprinting with living radical polymerization techniques,using acrylamide(AM) modified multi-walled carbon nanotubes(MWCNTs) as supporting matrix,dibenzyltrithiocarbonate(DBTTC) as reversible RAFT reagent,quercetin as template molecule,methacrylic acid(MAA as functional monomer and acetonitrile as pore former.The multi-walled carbon nanotubes molecularly imprinted polymers were characterized by Fourier transform infrared spectroscopy(FTIR),scanning electronic microscopy(SEM) and thermogravimetric analysis(TG).The adsorption properties and specific recognition ability of the polymer were tested by HPLC.The results showed that a stable imprinted layer was successfully grafted on the MWCNTs surface.And the imprinted polymers with good morphology and adsorption property have a specific recognition ability for quercetin.
living radical polymerization;multi-walled carbon nanotubes;molecularly imprinted polymer;quercetin;adsorption rate
2016-04-09;
2016-05-17
自治区高校科研计划青年教师科研启动基金(XJEDU2014S055)
10.3969/j.issn.1004-4957.2016.11.015
O657.72;TQ460.72
A
1004-4957(2016)11-1456-05
*通讯作者:木合塔尔·吐尔洪,教授,研究方向:环境及药物分析,Tel:0998-2892332,E-mail:tumut@sohu.com
