适配体上转换发光生物传感技术在食品安全快速检测中的应用
2016-04-11任舒悦李巧凤高志贤
任舒悦李巧凤高志贤
300050天津,军事医学科学院卫生学环境医学研究所,天津市环境与食品安全风险监控技术重点实验室(任舒悦、高志贤);450001郑州大学公共卫生学院(李巧凤)
·综述·
适配体上转换发光生物传感技术在食品安全快速检测中的应用
任舒悦李巧凤高志贤
300050天津,军事医学科学院卫生学环境医学研究所,天津市环境与食品安全风险监控技术重点实验室(任舒悦、高志贤);450001郑州大学公共卫生学院(李巧凤)
食品安全快速检测技术在预防医学领域扮演着至关重要的角色。传统理化检测方法存在耗费大、操作难、检测环境要求高等问题,不能满足质量安全监督中快速现场筛查的需求,正逐步被新兴的快速检测传感技术代替。新型适配体上转换发光生物传感技术建立在功能化上转换发光纳米材料与适配体技术相结合基础上,是一种新兴快速检测技术。与传统免疫荧光技术相比,其灵敏度高、特异性好、稳定性强,广泛应用于快速检测中。对上转换发光技术及适配体技术进行了简要介绍,对基于适配体的上转换发光生物传感技术及其在食品安全检测领域的应用进行了综述;根据目前的应用领域,指出了该技术存在的瓶颈及未来的发展趋势,为该技术在食品安全及多领域的应用提供了参考。
适配体;上转换发光;生物传感器;食品安全;快速检测
Fund program:National Natural Science Foundation of China(21477162),Science and Technology Support Program of Tianjin,China(14ZCZDSF0021)
0 引言
目前,食品污染事件频出,食品安全成为全球最受关注的话题之一。食品质量安全领域中常用的理化检测方法有液相色谱法、气质联用法、毛细管电泳法等,其存在样品前处理复杂、耗时费力、成本高等问题,不能满足现场筛查的需求[1]。一些现代生物技术如DNA探针、聚合酶链式反应、生物芯片、酶联免疫吸附剂测定等,虽具有对靶标分子高效富集、特异性高、快速检测等优点[2-4],但存在样品前处理复杂、抗体制备困难、生物原料容易失活、检测微环境要求较高等缺点,限制了其在食品污染物现场筛查中的广泛应用[5]。因此,适用于现场筛查且简单、快速的食品污染物筛查技术是食品安全快速检测领域的重点研究方向。
1 上转换发光技术
上转换发光(up-converting phosphor,UCP)材料是由稀土元素构成的发光晶体材料。稀土元素所具有的f电子层赋予UCP材料独特的上转换发光特性,即可被低能的红外光激发并发射高能的可见光[6]。近年来,通过对UCP纳米颗粒进行表面修饰,将其与生物分子连接并进行标记的技术得到广泛应用。修饰后的UCP钠米颗粒作为生物示踪物可完全排除生物背景荧光干扰,在检测中具有高度的敏感性、特异性与稳定性。因此,该技术在高通量药物筛选与输送、基因组学研究、光动力学治疗、组织成像、食品环境检测以及生物战剂防御等方面具有潜在应用价值[7]。
2 适配体技术
适配体是一类能与靶分子形成高亲和力、高特异性结合的寡核苷酸单链,是由指数级富集的配体进化技术从体外筛选而得[8]。适配体与各种靶分子的结合基于单链核酸结构和空间构象的多样性。适配体可通过链内某些互补碱基间的配对以及静电、氢键等作用发生自身适应性折叠,形成稳定的三维空间结构[9],绑定于靶分子上。因此,适配体对其靶分子显示出高度的亲和力[10]。相对于抗体和酶,适配体具有4项优势[11]。①靶分子可体外筛选且目标范围广,包括:蛋白质、细胞、致病菌、病毒、小分子物质等。②高亲和力、特异性。相对抗体来说,适配体筛选的精确度可以到甲基分子结构中的羟基。其与靶分子形成的复合物的解离常数Kd一般都在mmol/L水平甚至可达pmol/L水平。③制备操作简单且容易修饰。适配体的尺寸比传统抗体小,合成的重现性好。④化学稳定性好,容易保存。
目前,已筛选出多种具有高特异性、高靶分子亲和力的适配体,已经被广泛应用于临床医学、药物研发、生物传感等领域[12]。其靶标物包括:生长因子,抗体,细胞表面受体,转录因子,多肽,酶,抗生素,蛋白质,重金属等。
适配体由于其高特异性、灵敏度、靶标物广泛、耗费较少、体外合成容易以及安全稳定性强等优势,在食品安全检测领域具有良好的应用前景。近年来,多项基于适配体的技术被开发并应用于食品安全检测领域[13],如:纳米比色技术、SPR传感技术、动态光散射技术、电化学技术以及荧光传感技术等。这类技术的关键就是将适配体与纳米材料结合构建检测平台,如:碳纳米管、磁纳米颗粒、胶体金、上转换荧光纳米颗粒、量子点、石墨烯、二硫化钼等。本文主要总结基于适配体与上转换荧光纳米颗粒结合的传感技术在食品安全快速检测中的应用。
3 基于适配体的上转换发光生物传感技术在食品安全快速检测中的应用
3.1 食源性致病菌快速检测
食源性致病菌是指在食品加工和流通过程中进行存活代谢引起食品腐败变质或分泌有毒有害物质,间接或直接致人患病的一类菌体。常见的食源性致病菌有沙门氏菌、志贺氏菌、金黄色葡糖球菌等[14]。此类致病菌会引起人急性中毒,轻者出现上吐下泻等胃肠炎症状,重者会造成呼吸循环、神经等系统症状,急需相关技术加以检测。目前,基于适配体的上转换发光生物传感技术在食品安全检测领域研究逐步开展。例如,Duan等[15]合成双色上转换纳米颗粒标记鼠伤寒沙门氏菌和金黄色葡萄球菌的适配体,实现水样本中2种目标物的同时检测(图1)。2种病菌的检测范围分别为10~105cfu/ml(R2=0.996 4)和10~105cfu/ml(R2=0.993 6),检出限为5 cfu/ml和8 cfu/ml。Cheng等[17]合成Mn2+掺杂的上转换纳米颗粒修饰鼠伤寒沙门氏菌适配体,发射峰在807 nm,实现基于共振能量转移的金纳米棒荧光猝灭,加入目标物后荧光恢复。检测范围在12~5× 105cfu/ml(R2=0.99),检出限为11 cfu/ml。Jin等[17]同样利用上转换纳米颗粒与金纳米棒之间的荧光共振能量转移机制建立适配体标记待检测物与互补链竞争结合的生物传感器,实现水和牛奶样品中的大肠杆菌ATCC8739检测。检测范围为5~106cfu/ml,检出限为3 cfu/ml。
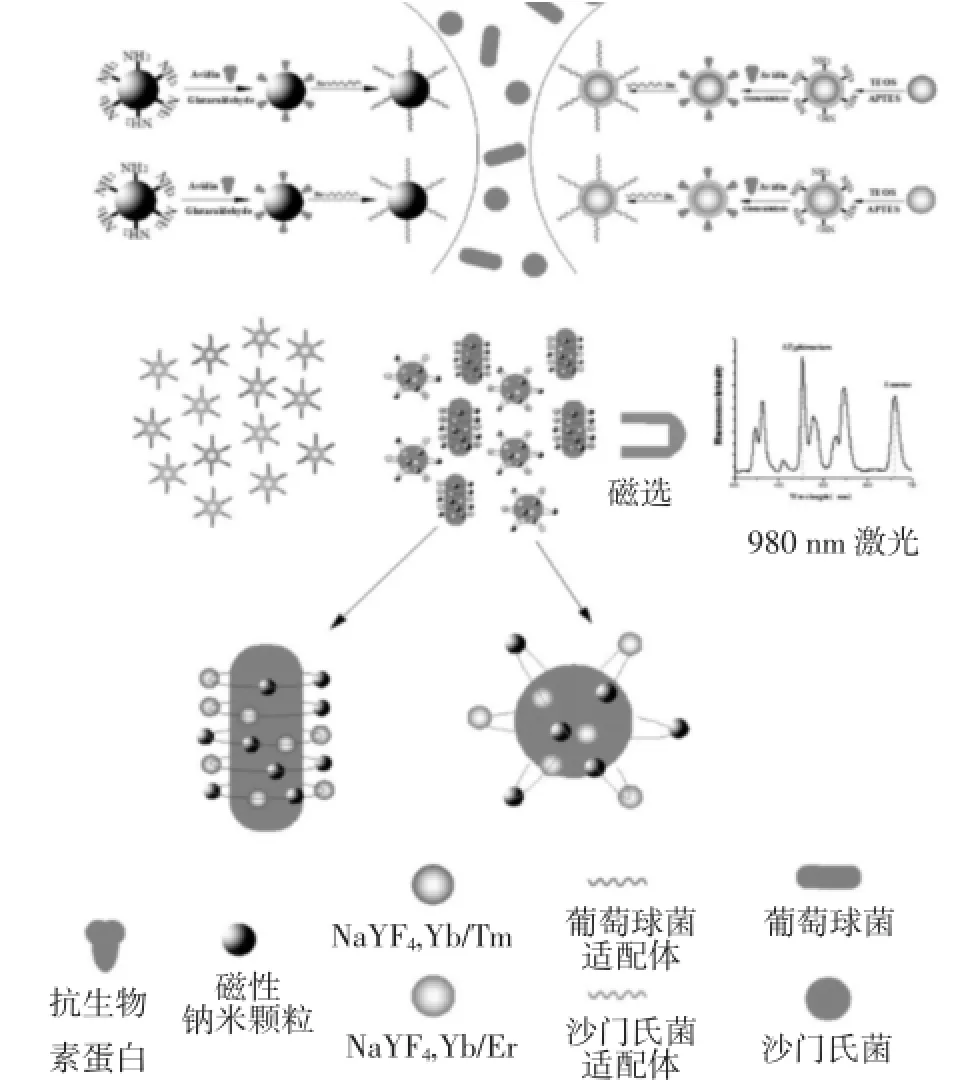
图1 构建生物功能化纳米颗粒及其检测原理
3.2 抗生素快速检测
抗生素是能够抑制微生物生长的化学物质。抗生素常滥用于养殖业,用于治疗或预防动物疾病。抗生素在农作物、动物性食品中均有残留,通过食物链富集进入人体,影响人体健康[18],因此受到广泛关注。常用抗生素检测方法如液相、气相及酶联免疫法存在许多不足,急需灵敏、高效的检测技术。如图2所示,Liu等[19]将生物素化恩诺沙星的寡核苷酸适配体固定在上转换纳米颗粒表面以捕获恩诺沙星。当适配体与靶标结合发生折叠后,加入甲基丙烯酸单体形成分子印迹聚合物,洗脱后进行二次捕获。该传感器可检测鱼肉样品中的抗生素,检测范围0.04~0.12 ng/ml,回收率为87.05%~96.24%。
如图3所示,Li等[20]将上转换纳米颗粒标记的适配体通过π-π键作用吸附于石墨烯表面,产生上转换颗粒荧光猝灭。加入待检测物时,适配体发生构象改变,脱离石墨烯表面,上转换颗粒荧光恢复。基于该原理构建了基于适配体的荧光共振能量转移传感器,可特异性检测卡那霉素。检测范围0.03~3 nmol/L,检出限为18 pmol/L。Zhang等[21]建立了待检测物与互补链竞争结合适配体的荧光共振能量转移传感器。互补链标记绿色荧光染料,上转换颗粒标记适配体,上转换颗粒在477 nm处的发射光会被荧光染料吸收,在530 nm处出现荧光增强,加入待检测物后,上转换颗粒荧光恢复。该传感器检测范围0.1~10 ng/ml,检出限为0.054 ng/ml。
3.3 农兽药残留快速检测
农药残留的快速检测方法主要有色谱法、光谱分析、酶抑制法、免疫分析等,具有操作复杂、费时的缺点,例如:难以保持酶活性,不能同时检测多种农药残留等[22]。目前,基于适配体的上转换生物传感器应用于农兽药检测的研究报道较少。Hu等[23]合成了硅壳包覆氨基化修饰的NaYF4:Yb,Ho上转换纳米颗粒,构建了免标记的共振能量转移传感器检测啶虫脒,具有良好的特异性,其检测范围50~1 000 nmol/L,检出限为3.2 nmol/L。Guo等[24]合成了适配体修饰的Mn2+离子交换上转换纳米颗粒,构建了电化学发光传感器,用于检测水样中的双酚A,检测范围0.05~100 ng/ml,检出限为0.037 ng/ml。
3.4 生物毒素快速检测
生物毒素是微生物的代谢产物,具有较强毒性,大多数有致癌、致畸、致突变作用。准确的检测技术是预防毒素通过食物链进入人体必不可少的手段。筛选出的适配体可以以多种生物毒素为靶标,包括:蓖麻毒素,霍乱毒素,金黄色葡萄球菌毒素,赭曲霉和相思子毒素等[25-27]。

图2 适配体上转换分子印迹聚合物制备、识别及其检测原理

图3 石墨烯上转换共振能量转移传感器的构建及其检测原理
如图4,Wu等[28-29]建立了核酸外切酶催化循环信号放大机制的适配标记的上转换纳米颗粒和荧光素共振能量转移传感器,可特异性检测牛奶中的葡萄球菌肠毒素B,具有较高的灵敏度,检测范围0.001~1 ng/ml,检出限为0.3 pg/ml;此外,将Fe3O4磁性纳米颗粒的快速磁分离特性应用到传感器的构建,研发了上转换荧光磁分离适配体传感检测玉米中的赭曲霉毒素A,检测范围0.1 pg/ml~1 ng/ml;随着研究深入,利用“发夹”分子信标5'端上的巯基与金纳米颗粒连接,将3'端上的氨基与氨基化的上转换纳米颗粒连接,构建了金颗粒-分子信标-上转换颗粒复合物共振能量转移传感器检测伏马菌毒素B1,检出限为0.01 ng/ml,该方法对15份玉米样本进行检测,将结果与传统酶联免疫吸附法比较,并进行加标回收率测试,证实该方法高具有特异性且准确、可靠。如图5所示,Lv等[30]将新兴纳米材料二硫化钼作为能量受体吸收上转换荧光,构建共振能量转移传感器,检测水中的微囊藻毒素,检测范围在0.01~50 ng/ml,检出限为0.002 ng/ml。

图4 酶催化循环放大信号的适配体共振能量转移传感器原理

图5 二硫化钼-上转换传感器原理
3.5 重金属快速检测
重金属是指密度>5 g/cm3的金属,约有45种,如:汞、铜、铅、镉、铁、锌、锰、钙、铬等。从食品安全方面考虑,最需关注的是汞、镉、铅、铬,以及类金属砷等物质。工业排放大量重金属物质污染水、空气、土壤,造成严重的环境污染[31-33]。这些物质会在农作物、水产品和其他食品中富集,通过食物链进入人体,引起急性或慢性的食品中毒,危害健康。近些年发展了一些快速重金属检测方法,如:酶分析法、试纸法、免疫分析法等,但与传统的检测方法相比,这类检测方法只能对被检物进行定性或半定量检测,且灵敏度和准确性较低[34-36]。急需用于食品中重金属快速检测的新技术。如图6所示,Chen等[37]合成了980 nm激发、804 nm发射的掺杂Tm3+的上转换纳米颗粒及在806 nm处有吸收峰的金纳米棒;将Hg2+的适配体修饰氨基,互补链修饰巯基,分别标记到上转称钠米颗粒和金钠米棒上;形成T-Hg2+-T结构促使2种颗粒距离拉近,引起荧光猝灭。基于以上原理构建了荧光共振能量转移适配体传感器,可检测饮用水、湖水及血样中的Hg2+残留,检测范围5~100 nmol/L,检出限为2 nmol/L。利用相同原理,Wu等[38]建立了可同时检测鱼、虾中的Hg2+、Pb2+重金属残留的适配体共振能量转移传感器,检测范围分别为0.5~500 nmol/L、0.1~100 nmol/L,检测灵敏度高,检测范围较宽。
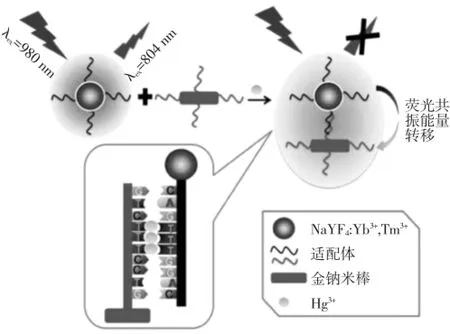
图6 T-Hg2+-T结构的金棒-上转换共振能量转移传感器原理
4 问题与展望
综上所述,基于适配体的上转换发光生物传感技术在食品安全快速检测中虽得到了广泛的应用,但该技术目前仍然存在许多不足之处,亟待改进。其主要有:①食品中有机染料、食物过敏源等靶标物的适配体筛选尚无相关报道。其原因主要为食品污染物大部分属于小分子物质,筛选困难、周期长、亲和力和特异性不高等缺点限制了适配体技术在食品中小分子污染物快速检测领域的应用。②目前,与适配体技术结合应用最多的是基于上转换的荧光共振能量转移传感器构建。但液相荧光猝灭机制的发生条件严格且需要专业的检测设备,不易现场监督筛查携带。③传感器检测样品不能多通道同时多靶标快速检测且样品前处理复杂,导致检测效率较低。针对上述问题,未来的研究方向应该集中于以下几个方面:①简单、高效的小分子物质体外筛选技术的研究。②便携式快速定量检测试剂盒以及配套设备的研发。③将适配体上转换技术与其他新兴纳米材料、酶等结合探索免标记可视化的检测技术。总之,适配体技术在食品安全检测领域具有巨大的应用潜力和发展前景。
利益冲突无
[1]Kole PL,Venkatesh G,Kotecha J,et al.Recent advances in sample preparation techniques for effective bioanalytical methods.Biomed Chromatogr,2011,25(1-2):199-217.DOI:10.1002/bmc.1560.
[2]Zhang L,Huang YJ,Wang JY,et al.Hierarchical flowerlike gold nanoparticles labeled immuno-chromatography test strip for highly sensitive detection of Escherichia coil O157:H7[J].Langmuir,2015, 31(19):5537-5544.DOI:10.1021/acs.langmuir.5b00592.
[3]Oguri S,Yoneya Y.Assay and biological relevance of endogenous histamine and its metabolites:application of microseparation techniques[J].J Chromatogr B,2002,781(1-2):165-179.DOI: 10.1016/S1570-0232(02)00534-2.
[4]Wang FM,Li W,Wang JS,et al.Detection of telomerase on upconversion nanoparticle modified cellulose paper[J].Chem Commun, 2015,51(58):11630.DOI:10.1039/c5cc03902a.
[5]汤轶伟,高子媛,魏立巧,等.标记免疫层析技术在食品安全检测中应用进展[J].食品安全质量检测学报,2014,5(7):1913-1917.
Tang YW,Gao ZY,Wei LQ,et al.Progress on immunolabelling chromatographic techniques in food safety detection[J].J Food Saf Qual,2014,5(7):1913-1917.
[6]Nyk M,Kumar R,Ohulchanskyy TY,et al.High contrast in vitro and in vivo photoluminescence bioimaging using nearinfrared to near infraredup-conversioninTm3+and Yb3+doped fluoride nanophosphors [J].Nano Lett,2008,8(11):3834-3838.DOI:10.1021/nl802223f.
[7]李向丽,谭贵良,张娜,等.上转换发光纳米技术及其在食品安全检测中应用研究进展[J].现代食品科技,2014,30(8):280-287. DOI:10.13982/j.mfst.1673-9078.2014.08.025.
Li XL,Tan GL,Zhang N,et al.Upconversion fluorescent nanoparticles technology in food inspection[J].Modern Food Sci Technol,2014,30(8):280-287.DOI:10.13982/j.mfst.1673-9078. 2014.08.025.
[8]Berezovski M,Musheev M,Drabovich A,et al.Non SELEX selection of aptamers[J].J Am Chem Soc,2006,128(5):1410-1411.DOI:10. 1021/ja056943j.
[9]Ellington AD,Szostak JW.In vitro selection of RNA molecules that bind specific ligands[J].Nature,1990,346(6287):818-822.DOI: 10.1038/346818a0.
[10]Warsinke A,Nagel B.Towards separation-free electrochemical affinity sensors by using antibodies,aptamers and molecularly imprintedpolymers—areview[J].Anal Lett,2006,39(13):2507-2556. DOI:10.1080/00032710600853903.
[11]Tombelli S,Minunni M,Mascini M.Analytical applications of aptamers[J].Biosens Bioelectron,2005,20(12):2424-2434.DOI:10. 1016/j.bios.2004.11.006.
[12]Tombelli S,Minunni M,Mascini M.Aptamers-based assays for diagnostics,environmental and food analysis[J].Biomol Eng,2007, 24(2):191-200.DOI:10.1016/j.bioeng.2007.03.003.
[13]Song S,Wang L,Li J,et al.Aptamer-based biosensors[J].Trends Anal Chem,2008,27(2):108-117.DOI:10.1016/j.trac.2007.12.004.
[14]Bruno J,Maria C,Taylor P,et al.A novel screening method for competitive FRET-aptamers applied to E.coli assay development[J]. J Fluores,2010,20(6):1211-1223.DOI:10.1007/s10895-010-0670-9.
[15]DuanN,WuSJ,ZhuCQ,etal.Dual-colorupconversion fluorescence and aptamer-functionalized magnetic nanoparticlesbased bioassay for the simultaneous detection of Salmonella Typhimurium and Staphylococcus aureus[J].Anal Chim Acta,2012, 723(8):1-6.DOI:10.1016/j.aca.2012.02.011.
[16]Cheng KY,Zhang JG,Zhang LP,et al.Aptamer biosensor for Salmonella typhimurium detection based on luminescence energy transfer from Mn2+-doped NaYF4:Yb,Tm upconverting nanoparticles to gold nanorods[J].Spectrochim Acta A Mol Biomol Spectrosc, 2017,171:168-173.DOI:10.1016/j.saa.2016.08.012.
[17]Jin BR,Wang SR,Lin M,et al.Upconversion nanoparticles based FRET aptasensor for rapid and ultrasenstive bacteria detection[J]. Biosens Bioelectron,2017,90:525-533.DOI:10.1016/j.bios.2016. 10.029.
[18]Zhang J,Zhang B,Wu Y,et al.Fast determination of the tetracyclines in milk samples by the aptamer biosensor[J].Analyst, 2010,135(10):2706-2710.DOI:10.1039/c0an00237b.
[19]Liu XY,Ren J,Su LH,et al.Novel hybrid probe based on double recognition of aptamer molecularly imprinted polymer grafted on upconversion nanoparticles for enrofloxacin sensing[J].Biosens Bioelectron,2017,87:203-208.DOI:10.1016/j.bios.2016.08.051.
[20]Li H,Sun DE,Liu YJ,et al.An ultrasensitive homogeneous aptasensor for kanamycin based on upconversion fluorescence resonance energy transfer[J].Biosens Bioelectron,2014,55:149-156. DOI:10.1016/j.bios.2013.11.079.
[21]Zhang H,Fang C,Wu S.Upconversion luminescence resonance energy transfer-based aptasensor for the sensitive detection of oxytetracycline[J].Anal Biochem,2015,489(4):44-49.DOI:10. 1016/j.ab.2015.08.011.
[22]Bharat C.A TEF-based dioxin kit utilizing fluorescent aptamers [EB/OL].[2017-01-01].http://cfpub.epa.gov/ncer_abstracts/index. cfm/fuseaction/display.abstractDetail/abstract/7965/report/0.
[23]Hu WW,Chen QS,Li HH,et al.Fabricating a novel label-free aptasensor for acetamiprid by fluorescence resonance energy transfer between NH2-NaYF4:Yb,Ho@SiO2and Au nanoparticles[J].Biosens Bioelectron,2016,80:398-404.DOI:10.1016/j.bios.2016.02.001.
[24]Guo XF,Wu SJ,Duan N,et al.Mn(2+)-doped NaYF4:Yb/Er upconversion nanoparticle-based electrochemiluminescent aptasensor for bisphenol A[J].Anal Bioanal Chem,2016,408(14):3823-3831. DOI:10.1007/s00216-016-9470-7.
[25]Cruz-Aguado J,Gregory P.Determination of ochratoxin a with a dna aptamer[J].J Agric Food Chem,2008,56(22):10456-10461.DOI: 10.1021/jf801957h.
[26]Maureen M,Bradley C R,De Girolamo A,et al.Screening and initialbinding assessment of fumonisin B1 aptamers[J].Int J Mol Sci,2010, 11(12):4864-4881.DOI:10.3390/ijms11124864.
[27]Lili H,Elise L,Belamaranahally V,et al.Aptamer-based surfaceenhanced Raman scattering detection of ricin in liquid foods[J]. Chem Sci,2011,2(8):1579-1582.DOI:10.1039/C1SC00201E.
[28]Wu SJ,Duan N,Ma XY,et al.A highly sensitive fluorescence resonance energy transfer aptasensor for staphylococcal enterotoxin B detection based on exonuclease-catalyzed target recycling strategy [J].Anal Chim Acta,2013,782:59-66.DOI:10.1016/j.aca.2013. 04.025.
[29]吴世嘉.基于上转换荧光纳米探针的高灵敏微生物毒素检测方法研究[D].无锡:江南大学,2013.
Wu SJ.Research of the sensitive detection methods for microbial toxins based on upconversion nanoparticles as lables[D].Wuxi: Jiangnan University,2013.
[30]Lv JJ,Zhao S,Wu SJ,et al.Upconversion nanoparticles grafted molybdenum disulfide nanosheets platform for microcystin-LR sensing[J].Biosens Bioelectron,2017,90:203-209.DOI:10.1016/j. bios.2016.09.110.
[31]Kim M,Um H,Bang S,et al.Arsenic removal from vietnamese groundwater using the arsenic-binding DNA aptamer[J].Environ Sci Tech,2009,43(24):9335-9340.DOI:10.1021/es902407g.
[32]Li L,Li B,Qi Y,et al.Label-free aptamer-based colorimetric detection of mercury ions in aqueous media using unmodified gold nanoparticles as colorimetric probe[J].Anal Bioanal Chem,2009, 393(8):2051-2057.DOI:10.1007/s00216-009-2640-0.
[33]Lin Y,Liu C,Chang H.Fluorescence detection of mercury(II)and lead(II)ions using aptamer/reporter conjugates[J].Talanta,2011,84 (2):324-329.DOI:10.1016/j.talanta.2011.01.016.
[34]Yang YH,Wang ZJ,Yang MH,et al.Inhibitive determination of mercury ion using a renewable urea biosensor based on selfassembled gold nanoparticlea[J].Sens Actuators B Chem,2006,114 (1):1-8.DOI:10.1016/j.snb.2005.04.005.
[35]Elhand F,Morales-rubio A,De.M.Determination of total arsenic in soft drinks by hydride generation atomic fluorescence spectrometry [J].Food Chem,2007,105(3):1195-1200.DOI:10.1016/j.foodchem. 2007.02.025.
[36]Wang H,Wang YX,Jin JY,et al.Gold nanoparticle based colorimetric and"turn-on"fluorescent probe for mercury(II)ions in aqueous solution[J].Anal Chem,2008,80(23):9021-9028.DOI: 10.1021/ac801382k.
[37]Chen HQ,Yuan F,Wang SZ,et al.Near-infrared to near-infrared upconverting NaYF4:Yb3+,Tm3+nanoparticles-aptamer-Au nanorods light resonance energy transfer system for the detection of mercuric (II)ions in solution[J].Analyst,2013,138(8):2392-2397.DOI: 10.1039/c3an36921h.
[38]Wu SJ,Duan N,Shi Zh,et al.Dual fluorescence resonance energy transfer assay between tunable upconversion nanoparticles and controlled gold nanoparticles for the simultaneous detection of Pb2+and Hg2+[J].Talanta,2014,128:327-336.DOI:10.1016/j.talanta. 2014.04.056.
Application of aptamer-based upconverting phosphor biosensing technology in rapid detection for food safety
Ren Shuyue,Li Qiaofeng,Gao Zhixian
Institute of Health and Environment Medicine,Military Medical Sciences,Tianjin Key Laboratory of Risk Assessment and Control Technology for Environment and Food Safety,Tianjin 300050,China(Ren SY,Gao ZX);School of Public Health,Zhengzhou University,Zhengzhou 450001,China(Li QF)
The rapid detection technology in food safety plays a vital role in the field of preventive medicine. The traditional physical and chemical detection methods have some limitations,such as costly,difficult to operate and high requirements on environment,can not meet the needs of quality and safety on-site rapid screening,and are gradually replaced by emerging sensor detection technologies.The aptamer-upconversion biosensor technology is a novel rapid detection technology,which is based on the combination of functionalized upconversion nanomaterials and aptamer technology.Compared with the traditional immunofluorescence technology,it has advantages in sensitivity,specificity and stability,and is widely used in rapid detection.In this paper,the upconversion luminescence and aptamer technologies were briefly introduced,and the aptamer-based upconverting phosphor biosensing technology and its application in rapid detection of food safety were summarized.Based on the current research status,the bottleneck and the future development trend of this technology were analyzed,which provides a reference for the application of this technology in food safety and other fields.
Aptamer;Upconverting phosphor;Biosensors;Food safety;Rapid detection
Gao Zhixian,E-mail:gaozhx@163.com
国家自然科学基金(21477162);天津市科技支撑计划项目(14ZCZDSF0021)
2016-10-10)
高志贤,Email:gaozhx@163.com
10.3760/cma.j.issn.1673-4181.2016.06.010
