SLCO1B1/ApoE基因多态性与瑞舒伐他汀疗效及安全性的相关性研究
2016-04-11王仲朝李军刘龙梅何颖娜
王仲朝李军刘龙梅何颖娜
030001太原,山西省心血管病医院心内科(王仲朝、李军、刘龙梅);050200石家庄,河北中医学院药学院,河北省心脑血管病中医药防治重点实验室(何颖娜)
SLCO1B1/ApoE基因多态性与瑞舒伐他汀疗效及安全性的相关性研究
王仲朝李军刘龙梅何颖娜
030001太原,山西省心血管病医院心内科(王仲朝、李军、刘龙梅);050200石家庄,河北中医学院药学院,河北省心脑血管病中医药防治重点实验室(何颖娜)
目的探讨SLCO1B1与ApoE基因多态性对瑞舒伐他汀的降脂疗效和安全性的相关性。方法采用纳米磁珠法提取全血基因组DNA,PCR-焦磷酸测序法检测SLCO1B1与ApoE基因多态性。152名受试者口服瑞舒伐他汀10 mg/d,通过检测用药前以及用药8周后的低密度脂蛋白胆固醇(LDL-C)水平,评价降脂疗效;通过随访用药期间肌痛的发生,评价肌病不良反应的发生频率。结果152名受试者SLCO1B1 521T>C基因型分布为TT 73.7%,TC 23.7%,CC 2.6%;ApoE基因型分布为ε3/ε3 65.8%,ε3/ε2 13.2%,ε4/ε3 21.0%,未见ε4/ε4、ε2/ε2、ε4/ε2基因型。瑞舒伐他汀治疗8周后,APOE ε3/ε3,ε3/ε3与ε4/ε3基因组比较,患者血浆中的LDL-C下降水平有统计学意义(P<0.05);SLCO1B1 521T>C 3种基因型发生肌痛的频率明显不同(P<0.05)。结论SLCO1B1/ApoE基因多态性与瑞舒伐他汀疗效及安全性具有相关性,联合检测SLCO1B1与ApoE基因型有助于预测疗效和不良反应,实现瑞舒伐他汀的个体化用药。
SLCO1B1;ApoE;基因多态性;瑞舒伐他汀;关联研究
Fund program:NationalNaturalScienceFoundationofChina(81441014);HealthDepartmentYouthFoundation of Shanxi Province,China(201201022)
0 引言
冠状动脉粥样硬化性心血管病(冠心病)是威胁人类健康的主要杀手之一[1]。低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)水平与冠心病危险的关系密切。有效降低LDL-C水平可以阻止动脉粥样硬化发展,从而降低冠心病的发病率及死亡率[2-3]。目前,他汀类药物是最有效的降低血浆LDL-C水平的药物,可有效降低心血管疾病风险。但是,不同个体对他汀类药物治疗的反应性存在很大差异,即使调整他汀类药物剂量,仍有部分患者达不到预期效果,其不良反应也同样存在个体差异,该差异除受患者的年龄、性别、肝肾功能和药物相互作用等因素影响,还与参与药物代谢的酶、转运蛋白及药物靶受体等的基因多态性密切相关。
SLCO1B1和载脂蛋白E(ApoE)是人体内影响他汀类药物的药代动力学和药效动力学的2个重要基因[4]。SLCO1B1基因编码有机阴离子转运多肽1B1(organic anion transporting polypeptide 1B1,OATP1B1)。OATP1B1是分布在肝细胞膜上的一种主动转运体。SLCO1B1基因遗传变异对他汀类药物降脂疗效的影响尚不确定,但SLCO1B1单核苷酸多态性显著降低OATP1B1对其底物的摄取能力,使他汀类药物的血浆及肝脏药物浓度升高,进而导致不良反应发生风险增加[5],尤其是521T>C位点的变化与他汀类药物相关的肌病不良反应的危险性强相关[6-7]。ApoE是血浆脂蛋白的重要成分,通过与LDL受体结合调节体内的血脂水平。ApoE具有显著遗传多态性,且其各基因型与冠心病严重程度及血脂质代谢水平有较密切的关系[8]。ApoE基因多态性可导致患者LDL-C水平差异,并对他汀类药物的调脂疗效产生不同反应,其多态性是他汀类药物调脂疗效个体化差异的标记物之一[9]。
瑞舒伐他汀作为一种亲水性羟甲基戊二酰辅酶A还原酶(HMG-CoA)抑制剂是目前降低LDL-C效果最强的他汀类药物,但在临床应用中存在较大的个体间疗效差异。长期使用瑞舒伐他汀可能出现肌病、横纹肌溶解症等不良反应,并呈个体差异现象,这些不良反应通常与瑞舒伐他汀的血药浓度相关。目前,国内外关于遗传多态性对瑞舒伐他汀影响的研究多集中在药代动力学相关方面。本研究从药效学角度,探讨SLCO1B1和ApoE基因多态性与瑞舒伐他汀的疗效及不良反应的相关性,为个体化用药提供依据。
1 资料与方法
1.1 临床资料
选取2015年9月~2016年6月山西省心血管病医院心内科高血脂症患者152例,平均年龄(60.5±8.4)岁,排除标准为急性冠脉综合征患者、严重的肝肾功能不全患者、入院前已较长时间(大于1月)应用他汀降脂治疗者及联合用药(如:他汀联合贝特或依折麦布)降脂的患者。
1.2 方法
1.2.1 主要材料与仪器
瑞舒伐他汀钙(美国阿斯利康公司,10 mg/片),TGuide S32磁珠法血液基因组提取试剂盒(北京天根生化科技有限公司),SLCO1B1基因分型检测试剂盒(焦磷酸测序法)、ApoE基因分型检测试剂盒(焦磷酸测序法)(长沙三济生物科技有限公司)。Arktik多功能PCR仪(美国Thermo Fisher Scientific公司),QIAGEN PyroMark Q24焦磷酸测序仪(德国QIAGEN公司),AU5800系列全自动生化分析仪(美国贝克曼库尔特公司)。
1.2.2 标本采集
检测受试者SLCO1B1 521T>C、ApoE的基因多态性。所有受试者口服瑞舒伐他汀10 mg进行降脂治疗,每晚1次,连续服用8周。用药前及用药8周后空腹采静脉血,EDTA抗凝血分离血浆及白细胞层,进行基因型测定;促凝血分离血清,检测LDL-C水平,依据LDL-C水平变化率评价不同基因型组降脂疗效。此外,于治疗期内随访肌痛等不良反应。
1.2.3 SLCO1B1及ApoE基因型测定
取受试者EDTA抗凝静脉血约2 ml,采用纳米磁珠法提取外周血基因组DNA,用PCR-焦磷酸测序法检测患者ApoE和SLCO1B1 521T>C基因型。PCR扩增及焦磷酸测序引物序列分别为:SLCO1B1 521T>C引物序列:前引物5'-GTT GTT TAA AGG AAT CTG GGT CAT 3'(加生物素标记),后引物5'-AGC GAA ATC ATC AAT GAT AGA AAG-3',测序引物5'-CAC GAA GCA TAT TAC CCA T-3';ApoE引物序列:前引物5'-CCCCGGCCTGGTACACTG-3'(加生物素标记),后引物5'-GGGCGCGGACATGGAGG-3',测序引物5'-GAC ATG GAG GAC GTG-3'(112T>C)和5'-CCG ATG ACC TGC AGA-3'(158C>T)。
1.3 统计学方法
应用SPSS 15.0软件进行统计学分析,计数资料以率表示,采用χ2检验,正态分布的计量资料以均数±标准差(x±s)表示,组间均数比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 SLCO1B1 521T>C和ApoE的基因型分析
SLCO1B1(521T>C)基因型分布为TT 73.7%,TC 23.7%,CC 2.6%;ApoE 2个位点(158C>T和112T>C)的基因型分布为ε3/ε3 65.8%,ε3/ε2 13.2%,ε4/ε3 21.0%,未见ε4/ε4、ε2/ε2、ε4/ε2基因型。(表1)
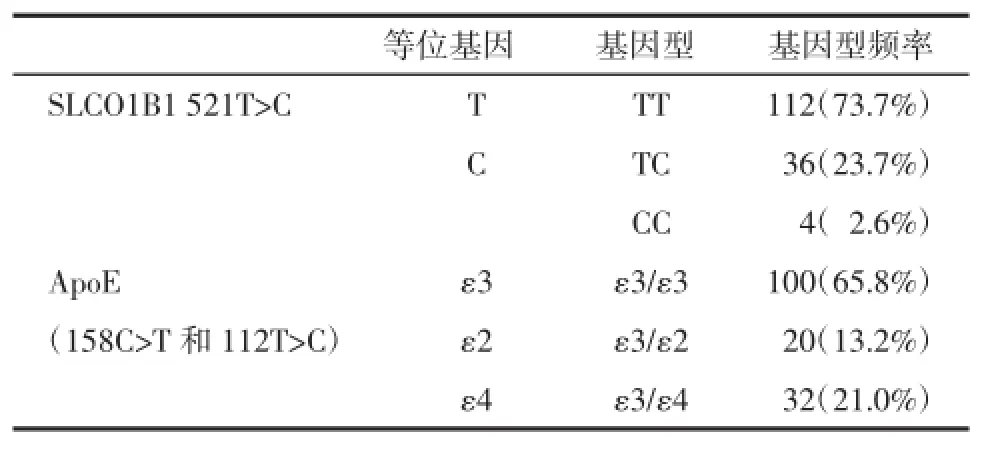
表1 SLCO1B1与ApoE基因型分布
2.2 ApoE基因多态性与LDL-C水平相关性
服用药物8周后LDL-C水平变化如表2所示,瑞舒伐他汀对ε3/ε2基因型LDL-C水平降低作用最强,对ε4/ε3基因型LDL-C水平降低作用最弱,经过统计分析发现差异具有统计学意义(P<0.05),可认为瑞舒伐他汀对不同ApoE基因型降脂疗效有差异。

表2 瑞舒伐他汀治疗后ApoE各基因型组LDL-C变化率
2.3 ApoE基因多态性与肌病不良反应相关性
服用药物8周后,152名受试者中,有5.3%出现相关性肌病不良反应,表现为肌痛。其中TT、TC、CC基因型的肌痛发生率分别为2.6%、13.9和25.0%,与TT基因型相比,TC和CC基因型的肌痛发生率显著增加,差异均具有统计学意义(均P<0.05)。(表3)

表3 瑞舒伐他汀治疗后SLCO1B1 521T>C各基因型组的肌痛发生频率
3 讨论与结论
药物的体内代谢、转运及药物作用靶点基因的遗传变异及其表达水平的变化可影响药物的体内浓度和敏感性,导致药物反应性个体差异[10]。本研究从药效学的角度研究了药物代谢转运体基因SLCO1B1和作用靶点基因ApoE的多态性对瑞舒伐他汀的降脂疗效和安全性的影响。
采用纳米磁珠法提取外周血基因组DNA。纳米磁珠是运用纳米技术对超顺磁性纳米颗粒的表面进行改良和表面修饰,制备而成的超顺磁性氧化硅纳米磁珠,能与核酸分子特异性地识别和高效结合[11]。DNA的抽提方法很多,如传统的酚-氯仿法、盐析法、滤膜离心柱法等的步骤繁杂、费时长、收率低,需接触有毒试剂,且很难实现自动化操作。以纳米磁珠为载体的提取技术,利用在高盐低pH值条件下核酸通过静电作用、疏水作用和氢键作用吸附到磁珠氧化硅壳层表面形成磁珠核酸复合物,在低盐高pH值条件下核酸与磁珠解吸附的原理,实现对核酸的提取、纯化。该方法具有操作简单,快速,提取效率高,产物纯度高,能够实现高通量,自动化操作等优点,尤其适合大批量的DNA提取纯化[12]。
ApoE基因含3种等位基因ε2、ε3,ε4,可组成ε3/ε3、ε3/ε2、ε4/ε3、ε4/ε4、ε2/ε2、ε4/ε2 6种基因型,其多态性可能与他汀类药物疗效存在关联性[9]。有研究发现,ApoE基因型与总胆固醇(total cholesterol,TC)变化无关,与LDL-C变化有关[13-14]。本研究统计了ApoE基因型分布频率分别为ε3/ε3 65.8%,ε3/ε2 13.2%,ε3/ε4 21.0%;口服瑞舒伐他汀(10 mg)治疗8周后,3种基因型LDL-C水平下降有差异,以ε3/ε2组下降最为显著,ε3/ε3组下降幅度居中,ε3/ε4下降幅度最小,组间差异具有统计学意义(P<0.05)。因此,推测ApoE基因多态性与瑞舒伐他汀降低LDL-C水平的作用相关,监测ApoE基因多态性有助于预测瑞舒伐他汀的疗效。
瑞舒伐他汀在体内只有10%被CYP450酶代谢,大部分是原形排泄,所以负责转运的转运体OATP1B1将会很大程度的影响其在体内的药物分布。有研究证实,编码OATP1B1的SLCO1B1基因多态性对中国人的瑞舒伐他汀药代动力学影响较大,SLCO1B1 521T>C多态性与瑞舒伐他汀的血药浓度等药代动力学参数呈现的个体差异密切相关,而瑞舒伐他汀血药浓度越高发生肌病、横纹肌溶解症等副反应的风险随之升高[7]。本研究统计SLCO1B1 521T>C基因型分布频率,野生纯合子TT为73.7%,突变杂合子TC为23.7%,突变纯合子CC为2.6%;研究过程中随访了受试者用药期间(8周)肌病不良反应(临床表现为肌痛)的发生频率,TT、TC、CC 3种基因型肌痛的发生频率分别为2.6%、13.9%和25.0%,差异有统计学意义(P<0.05)。因而,推测SLCO1B1521T>C多态性与瑞舒伐他汀的肌病不良反应的个体差异相关,TC与CC基因型发生肌病不良反应的风险增加,监测SLCO1B1 521T>C的基因多态性将有助于预测瑞舒伐他汀发生不良反应的危险性。
综上所述,SLCO1B1/ApoE基因多态性与瑞舒伐他汀的不良反应和降脂疗效具有相关性。在实际应用中,联合检测SLCO1B1和ApoE基因型,有助于预测瑞舒伐他汀的不良反应和降脂疗效,提高其安全性和有效性,实现瑞舒伐他汀的个体化用药。
利益冲突无
[1]Wang H,Naghavi M,Allen C,et al.Global,regional,and national life expectancy,all-cause mortality,and cause-specific mortality for 249 causes of death,1980-2015:a systematic analysis for the global burden of disease study 2015[J].Lancet,2016,388(10053):1459-1544.DOI:10.1016/S0140-6736(16)31012-1
[2]Baigent C,Keech A,Kearney P M,et al.Efficacy and safety of cholesterol-lowering treatment:prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins[J]. Lancet,2005,366(9493):1267-1278.DOI:10.1097/01.aog. 0000190364.51653.bf
[3]de Keyser CE,Eijgelsheim M,Hofman A,et al.Single nucleotide polymorphisms in genes that are associated with a modified response to statin therapy:the Rotterdam Study[J].Pharmacogenomics,2011, 11(1):72-80.DOI:10.1038/tpj.2010.11
[4]Sortica V A,Fiegenbaum M,Lima L O,et al.SLCO1B1 gene variability influences lipid-lowering efficacyon simvastatin therapy in Southern Brazilians[J].Clin Chem Lab Med,2012,50(3):441-448.DOI:10.1515/cclm.2011.804
[5]Rodrigues A C,Perin P M,Purim S G,et al.Pharmacogenetics of OATP transporters reveals that SLCO1B1 c.388A>G variant is determinant of increased atorvastatin response[J].Int J Mol Sci, 2011,12(9):5815-5827.DOI:10.3390/ijms12095815
[6]Link E,Parish S,Armitage J,et al.SLCO1B1 variants and statininduced myopathy-a genomewide study[J].N Engl J Med,2008, 359(8):789-799.DOI:10.1056/NEJMoa0801936
[7]隋双明,温金华,李新华,等.OATP1B1基因位点521T→C的突变对瑞舒伐他汀在中国健康人体内药代动力学特征的影响[J].药学学报,2011,46(6):695-700.DOI:10.16438/j.0513-4870.2011. 06.018
Sui SM,Wen JH,Li XH,et al.Effect of OATP1B1 521T→C heterogenesis on pharmacokinetic characterstics of rosuvastatin in Chinese volunteers[J].Acta Pharmaceutica Sin,2011,46(6):695-700.DOI:10.16438/j.0513-4870.2011.06.018
[8]Wu K,Bowman R,Welch AA,et al.Apolipoprotein E polymorphisms, dietary fat and fibre,and serum lipids:the EPIC Norfolk study[J]. Eur Heart J,2007,28(23):2930-2936.DOI:10.1093/eurheartj/ ehm482
[9]Hatters DM,Peters-Libeu CA,Weisgraber KH.Apolipoprotein E structure:insights into function[J].Trends Biochem Sci,2006,31(8): 445-454.DOI:10.1016/j.tibs.2006.06.008
[10]孙丹,孙玉坤,惠福海.载脂蛋白E基因多态性与阿托伐他汀调脂疗效的相关性[J].沈阳药科大学学报,2011,28(2):157-161. DOI:10.14066/j.cnki.cn21-1349/r.2011.02.008
Sun D,Sun YK,Hui FH.Correlation between polymorphisms of ApoE gene and the lipid regulatory effect of atorvastatin[J].J Shenyang Pharm Univ,2011,28(2):157-161.DOI:10.14066/j.cnki. cn21-1349/r.2011.02.008
[11]Lin C,Zhang Y,Zhou X,et al.Naked-eye detection of nucleic acids through rolling circle amplification and magnetic particle mediated aggregation[J].Biosens Bioelectron,2013,47:515-519.DOI:10.1016/ j.bios.2013.03.056
[12]Sun N,Deng C,Liu Y,et al.Optimization of influencing factors of nucleic acid adsorption onto silica-coated magnetic particles: applicationtoviralnucleicacidextractionfromserum[J].JChromatogr A,2014,1325(2):31-39.DOI:10.1016/j.chroma.2013.11.059
[13]Zintzaras E,Kitsios GD,Triposkiadis F,et al.APOE gene polymorphisms and response to statin therapy[J].Pharmacogenomics J,2009,9(4):248-257.DOI:10.1038/tpj.2009.25
[14]Hu M,Mak VW,Tomlinson B.Polymorphisms in apolipoprotein E and apolipoprotein A-V do not influence the lipid response to rosuvastatin but are associated with baseline lipid levels in Chinese patients with hyperlipidemia[J].J Clin Lipidol,2012,6(6):585-592. DOI:10.1016/j.jacl.2012.02.005
SLCO1B1/ApoE gene polymorphisms associated with efficacy and safety of rosuvastatin
Wang Zhongchao, Li Jun,Liu Longmei,He Yingna
Department of Cardiology,Cardiovascular Disease Hospital of Shanxi Province,Taiyuan 030001,China(Wang ZC,Li J,Liu LM);Department of Pharmacy,Hebei University of Chinese Medicine,Hebei Key Laboratory of Chinese Medicine Research on Cardio-cerebrovascular Disease,Shijiazhuang 050200,China(He YN)
ObjectiveTo investigate the association between SLCO1B1/ApoE gene polymorphisms and lipid-lowering efficacy and safety of rosuvastatin.MethodsDNA samples were extracted from blood using nano paramagnetic particle method.The SLCO1B1 521T>C and ApoE gene polymorphisms were screened by PCR-pyrophosphate sequencing method.Totally 152 patients received rosuvastatin orally at a dose of 10 mg/d.The lipidlowering efficacy was evaluated through detecting serum low-density lipoprotein cholesterol(LDL-C)level before and 8 weeks after the treatment.The incidence of myopathic adverse effect was assessed by follow-up of the occurrence of myalgia.ResultsThe gene distribution of SLCO1B1 521T>C was 73.7%,23.7%and 2.6%respectively for TT,TC and CC in 152 patients,and the distribution of ApoE gene was 65.8%,13.2%and 21.0%respectively for ε3/ε3, ε3/ε2 and ε4/ε3.The genotype ε4/ε4,ε2/ε2 and ε4/ε2 were not detected.After orally receiving rosuvastatin 10 mg daily for 8 weeks,the decreased LDL-C levels showed significant differences(P<0.05)among ApoE genotype ε3/ε2, ε3/ε3 and ε4/ε3 groups,and the frequencies of myalgia showed significant differences in the three genotype groups of SLCO1B1 521T>C(P<0.05).ConclusionThe gene polymorphism of SLCO1B1/ApoE was correlated with efficacy and safety of rosuvastatin.The combined detection of SLCO1B1/ApoE genes can be utilized to predict efficacy and risk,and then realize individualized medication.
SLCO1B1;ApoE;Gene polymorphism;Rosuvastatin;Correlation research
He Yingna,Email:heyingna2002@163.com
国家自然科学基金(81441014);山西省卫生厅青年基金(201201022)
2016-09-15)
何颖娜,Email:heyingna2002@163.com
10.3760/cma.j.issn.1673-4181.2016.06.009
