基于1型糖尿病大鼠模型的呼吸丙酮与血糖及血β-羟基丁酸相关性研究
2016-04-11袁渊陈珠英黄河赵晓萌王振南孙美秀
袁渊 陈珠英 黄河 赵晓萌 王振南 孙美秀
300192天津,中国医学科学院北京协和医学院生物医学工程研究所
基于1型糖尿病大鼠模型的呼吸丙酮与血糖及血β-羟基丁酸相关性研究
袁渊 陈珠英 黄河 赵晓萌 王振南 孙美秀
300192天津,中国医学科学院北京协和医学院生物医学工程研究所
目的 1型糖尿病(T1D)和某些2型糖尿病患者经常患有酮症(高血酮),呼吸丙酮是糖尿病的一种潜在生物标志物。本研究使用T1D大鼠模型研究呼吸丙酮与血糖(BG)及血β-羟基丁酸(BHB)的关系。方法 使用基于光腔衰荡光谱技术的呼吸丙酮分析仪测定了20只T1D大鼠和18只健康大鼠的呼吸气体丙酮浓度,并同时测定了其BG和血液BHB浓度。结果 与健康大鼠组相比,T1D大鼠组的呼吸丙酮、BG和血液BHB间的差异均具有统计学意义(P<0.05)。T1D大鼠和健康大鼠的呼吸丙酮与血液BHB呈显著正相关性,而与BG呈显著负相关性;但当T1D大鼠接受胰岛素治疗且血糖浓度趋向正常值时,其呼吸丙酮和血糖浓度的关系由负相关变为正相关。健康大鼠的呼吸丙酮浓度与血糖浓度则无相关性。多元线性回归分析显示,T1D大鼠的呼吸丙酮可用于其血液BHB的预测,使用10只健康大鼠和10只T1D大鼠对该回归模型进行了验证。结论 使用大鼠动物模型进行呼吸气体研究是可行的,其有助于解决人类呼吸分析研究中的定量关系问题。
呼吸分析; 光腔衰荡光谱技术; 糖尿病大鼠模型; 呼吸丙酮; 血糖; β-羟基丁酸
Fund program:National Natrual Science Foundation of China(81471701)
0 引 言
通过检测生物标志物的异常浓度或多个呼出气体的特定模式,呼吸分析可提供一种潜在的疾病诊断和治疗状态监控的无创方法。一直以来,呼吸丙酮被认为是1型糖尿病(type 1 diabetes,T1D)的一种生物标志物[1-4]。早在20世纪50年代就有关于定量测量T1D和2型糖尿病(type 2 diabetes,T2D)患者呼吸丙酮的报道[4]。研究结果表明,T1D患者确实具有较高的呼吸丙酮浓度[4]。然而,针对3 000样本(包括T1D患者、T2D患者及健康人)的40多项关于呼吸丙酮与血糖(blood glucose,BG)关系的研究显示,呼吸丙酮浓度与BG水平可能呈正相关[5-7]、负相关[8]、或无相关性[9-10]。因此,T1D/T2D患者呼吸丙酮浓度与BG水平的定量关系仍不明确,其相关关系以及与其他生物信息学参数间的关系尚需进一步研究。
高血糖、T1D和某些T2D患者经常患有酮症(高血酮)。在严重情况下,这类患者血清中的酮体(乙酰乙酸(acetoacetate,AA),血β-羟基丁酸(beta-hydroxybutyrate,BHB),丙酮)浓度会超过25mmol/L[11-12]。在青少年T1D患者病情管理中,测定血液BHB浓度已成为常规检查[9,13]。有报道表明,采用生酮饮食治疗顽固性癫痫时,可用呼吸丙酮值预测血液的BHB[14-16]。然而,关于T1D患者的呼吸丙酮和血液BHB之间关系的研究较少,仅有一项涉及113例年轻T1D患者的研究,其结果认为呼吸丙酮可用于血液BHB和AA的预测[10]。
先前的研究显示,自然个体的呼吸丙酮浓度与其生物学和生活习惯差异相关,如年龄、性别、饮食等[17-19]。因此,本研究的目的旨在生理差异最小的条件下测量呼吸丙酮浓度,并分析其与BG和血液BHB的相关性。因动物实验参数容易控制[20-22],因此使用动物模型进行呼吸分析研究能保证获得实验信息的可靠性。大鼠有超过98%的DNA与人类相同,因此T1D大鼠模型用于呼吸丙酮与BG和血液BHB相关关系的研究是可行的。目前,已有多项关于大鼠呼吸气体的研究,包括哮喘[22-23]、生酮饮食[16]、败血症[24-25]、帕金森病[20]、神经纤维瘤病[26]、过敏性气道炎症[27]、肺部疾病[28-29]及脂肪性肝炎[30]等。然而,关于糖尿病大鼠的呼吸丙酮研究未见报道。
本研究使用基于光腔衰荡光谱技术(cavity ringdownspectroscopy,CRDS)的呼吸丙酮分析仪测定20只T1D大鼠和18只健康大鼠的呼吸丙酮含量,分析呼吸丙酮与其BG和血液BHB的关系。气相色谱-质谱技术(gas chromatography-mass spectrometry, GC-MS)样品制备过程复杂,测试过程耗时,设备体积庞大。与之相比,CRDS在痕量气体分析领域具有优势,且已被广泛接受[31]。
1 材料与方法
1.1 主要材料与仪器
Sprague-Dawley雄性大鼠(北京华阜康生物科技股份有限公司),链脲佐菌素(streptozotocin,STZ)(美国Sigma-Aldrich公司),苏木精-伊红(天津怡生园生物科技有限公司),氮气(中国大方特殊气体公司)。
雅培FreeStyleOptium血糖仪(瑞士Roche公司),三通玻璃阀(天津怡生园生物科技有限公司),ALCV8S小动物呼吸机(上海奥尔科特生物科技有限公司),Optium Xceed血液BHB仪(美国Abbott公司),MPL-F-266nm型Q开关Nd:YAG激光器(长春新产业光电技术有限公司),不锈钢腔体、镜座(美国CRD Optics Inc公司),高反射镜(美国Los Gatos Research公司),870B微型压力计(美国MKS公司),SC5D真空泵(德国Oerlikon公司),GPIB-USB-HS连接线(美国NS公司)。
1.2 方法
1.2.1 大鼠动物模型
动物实验方案经中国医学科学院生物医学工程研究所动物研究伦理委员会批准。实验共使用38只Sprague-Dawley雄性大鼠(体质量200~300 g,10周龄),均饲养于环境受控室中(18~25℃,相对湿度40%~70%),每笼饲养数小于5只。实验期间,大鼠自由喂食市售大鼠粒料与自来水。
使用单次静脉注射STZ法建立T1D大鼠模型。STZ可引起大鼠胰岛β细胞严重受损,并导致其胰岛素分泌减少。本研究中,STZ按质量浓度20 mg/ml溶解于柠檬酸-柠檬酸钠缓冲液(pH 4.4),并在10 min内注射。每只大鼠的单次静脉注射剂量为45 mg/kg。STZ注射后1周后,采用血糖仪测量尾静脉血BG值,非空腹BG>16.7 mmol/L的大鼠被认为患有T1D。使用苏木精-伊红染色法分析1只健康大鼠和4只STZ建模T1D大鼠的胰腺切片。
图1A~C是健康大鼠的胰腺活检病理图像,图1D~F、G、H、I分别为4只T1D大鼠的病理图像。如图所示,健康大鼠的胰岛有明显的胰岛边界和大量健康β细胞,但4只T1D大鼠胰岛组织结构萎缩,正常形状β细胞减少,并有局部炎症。证明其胰岛已经衰竭,表明T1D大鼠模型成功建立。
1.2.2 呼吸气体采集方法
图2A、B分别为大鼠呼吸气体采样装置的示意图与实物图。呼吸样本采集前,采用腹膜内注射水合氯醛水溶液(10%)的方法对大鼠进行麻醉,剂量为0.03 ml/kg。
分别使用气管切开和口腔插管法对呼吸气体样本进行采集(图3)。大鼠气管切开插管过程用时约5 min,分为3个步骤:①在麻醉大鼠的颈部切开一个5~8 mm的切口(图4A)。②在气管上,连同环状软骨挑开约1 mm的切口(图4B)。③通过切口将定制三通玻璃阀的一端(直径1 mm)插入大鼠气管(图4B、D)。
口腔插管法采用一端连接定制玻璃阀的柔性管通过麻醉大鼠的口腔插入气管。玻璃阀的另外2个端口分别连接小动物呼吸机的进气口和出气口(图2)。实验中,呼吸机的呼吸频率、呼吸率及潮气量依每只大鼠调适以保证自然呼吸。如图2所示,小动物呼吸机背板上的2个端口分别为连接室内空气的进气口和聚氟乙丙烯采集袋的出气口。采样袋用来收集大鼠的呼吸气体,其容积为1 L,可在6 h内保持呼吸气体新鲜。实验中,所有呼吸样本均在非禁食状态下采集。呼吸样本在便携式保温箱内保存并在6 h内进行呼吸丙酮的检测。大鼠BG和血液BHB浓度分别使用血糖仪和血液BHB仪测定。气体采集后,采用在其尾静脉注射1~2 ml空气的方式处死大鼠。
1.2.3 光腔衰荡光谱呼吸丙酮分析仪
图5为CRDS呼吸气体分析仪的原理图[32]。其中:仪器光源为Q开关Nd:YAG激光器,激光头尺寸为238.5mm×88.0mm×74.0mm,工作波长为266nm,脉冲重复频率为1 kHz,单脉冲能量为4.5 μJ。样品室由50 cm不锈钢腔体(内径3.81 cm)、镜座、高反射镜(反射率R=99.995 6%,曲率半径ROC=1 m)组成。样品室有3个接口:1个为气体样本进样孔,其余2个分别连接870B微型压力计和SC5D真空泵。每次测量后,需使用高纯氮气冲洗腔体(>99.99%),以确保气室不被污染。光衰荡由光电倍增管捕获,并通过数字示波器进行A/D转换后由GPIB-USB连接线传输至计算机。利用自行开发的软件进行数据处理。
1.2.4 呼吸丙酮浓度计算
使用背景减除法计算样本中丙酮的绝对浓度[7,33-34]。空气Aatm和呼吸气体的吸光度Abreath由公式(1)、(2)表示
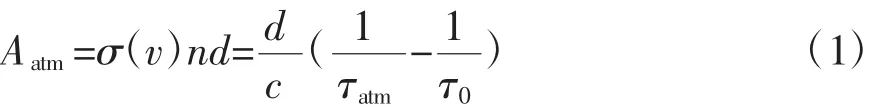

式中:σ(v)为丙酮的跃迁谱线吸收截面,n为样本浓度,d为两面反射镜间的距离,c为光速,τatm和τbreath分别为空气和呼吸样本在1 atm下的衰荡时间,τ0为真空状态下的衰荡时间。
本研究以空气的吸光度作为背景基线。因此,呼吸气体中的呼吸丙酮吸光度(上限值)可由公式(3)表示

式中:ΔA为吸光度差。在大气压力和室温下,丙酮在266 nm处吸收截面为4.5×10-20cm2/mol[35]。
本研究应用背景减除法是基于假设吸光度差仅由丙酮吸收导致。文献[33]中,通过研究其他气体分子和高浓度的呼吸挥发性化合物(VOCs)的吸光度,该假设已得到验证。此外,已有大量关于大鼠呼吸气体的研究,且实验大鼠有超过98%的DNA与人类相同,由此可认为大鼠呼吸气体与人类呼吸气体相似。本研究在对大鼠呼吸丙酮测试前,利用GC-MS对CRDS呼吸分析仪的性能与可靠性进行了验证[32,36]。因此,可认为本研究大鼠呼吸气体的方法是可行的。
1.3 统计学方法
使用IBM SPSS Statistics 19.0软件进行数据分析,实验数据以均值±标准差(x±s)表示。大鼠呼吸丙酮浓度与体质量数据符合正态分布,采用独立样本检验分析;BG和BHB数据不符合正态分布,采用kruskal-wallis检验分析。以P<0.05为差异具有统计学意义。
2 结果与讨论
2.1 2种气体采集方法比较
气管切开术对大鼠损伤较大且更耗时,而口腔插管法对大鼠损伤较小[19-20],如能保证其可靠性,则口腔插管法是优选的呼吸气体采集方法。分别采用以上2种方法测试了15只T1D大鼠呼吸样本的呼吸丙酮浓度(图6)。结果显示,其拟合方程斜率k=1.04,表明2种采样方法所测得的丙酮浓度是一致的,证实了口腔插管法采集大鼠呼吸气体的可靠性。本研究选择口腔插管法采集大鼠呼吸气体。
2.2 呼吸丙酮与血糖的关系
大鼠的呼吸丙酮浓度以体积分数φ表示。本实验共测定了20只T1D大鼠(N1组)和18只健康大鼠(N2组)的呼吸丙酮、BG和血液BHB浓度,结果见表1。如表所示,N1组与N2组的呼吸丙酮差异显著,有统计学意义(P<0.001)。T1D大鼠呼吸丙酮的体积分数φ=(1.9~4.3)×10-6及平均值φ=(3.0± 0.6)×10-6均高于健康大鼠((1.4~2.8)×10-6和(2.3± 0.4)×10-6)。
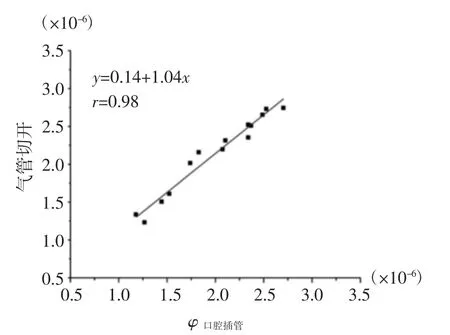
图6 气管切开术和口腔插管法采集呼吸丙酮浓度比较
先前许多研究分析了人类T1D患者的呼吸丙酮和BG,但关于呼吸丙酮浓度和BG间的关系尚无统一定论。有研究结果表明,当使用特定数据处理方法[7]或采样控制方法[5-6]时,呼吸丙酮浓度与BG存在一定正相关性[5-6];但也有研究未发现呼吸丙酮与BG间的相关关系[9-10]。本研究结果表明,T1D大鼠的呼吸丙酮浓度与其血糖存在负相关性(n=20, r=-0.678,P<0.05)(图7A)。值得注意的是,本研究中T1D大鼠的BG水平很高,高于大多数糖尿病患者可承受的BG值。如图7B所示,健康大鼠呼吸丙酮浓度与BG之间无相关性。
应该强调的是,根据本研究中“T1D大鼠呼吸丙酮与BG水平呈负相关”的结果不能确定得出“该结果与已报道的基于人类受试者的研究结果相符(或不符)”。目前,许多文献报道了人类受试者(健康人,T1D或T2D患者)呼吸丙酮的研究,但呼吸丙酮和血糖有何关系仍无统一定论,且没有某项研究能充分考虑如采样规模、纵向实验时间、横向比较、干扰控制、采样精度、校准测量方法、分类和纯化受试者类型以及生理差异控制等因素的影响。从这个角度看大鼠模型作为一个独立抽样目标,可能为解决某些研究(如2个变量之间是否存在相关关系)中的上述问题提供一个较好的方法,而不一定要进行人体试验。

表1 T1D大鼠和健康大鼠呼吸丙酮体积分数与BG和BHB浓度(x±s)

图7 1型糖尿病大鼠和健康大鼠呼吸丙酮与血糖的关系
本研究还对4只随机选择的大鼠在连续6 h内的呼吸丙酮浓度与BG的变化趋势进行了研究(图8)。4只大鼠分别为:健康大鼠1只,STZ注射后3 d(3DSI)大鼠1只,STZ诱导T1D大鼠2只,其呼吸丙酮浓度体积分数范围分别为(1.9~2.5)×10-6、(1.9~6.1)×10-6、(2.1~7.5)×10-6、(1.9~4.3)×10-6;BG浓度最高值出现对应的时刻(时:分)分别为13:43(20.1 mmol/L)、11:33(26.5 mmol/L)、10:15(25.4 mmol/L)、9:41(29.6 mmol/L)。如图8B~D所示,T1D大鼠和3DSI大鼠的呼吸丙酮与BG呈负相关趋势,这与本研究中针对20只T1D大鼠的结果一致。
此外,为了探讨BG浓度变化对呼吸丙酮的影响,本研究随机选择5只T1D大鼠进行连续5 d的胰岛素治疗,每只大鼠的注射剂量为8 u/kg,并在第3天和第5天对大鼠进行呼吸气体分析。结果显示,当T1D大鼠的BG水平由极高下降到接近健康大鼠的水平时,其呼吸丙酮与BG的关系由负相关(图7A)变为弱正相关(图9)。表明呼吸丙酮和BG的关系会随BG范围而发生变化。
2.3 呼吸丙酮与血液BHB的关系
如表1所示,T1D大鼠与健康大鼠的血液BHB浓度分别为(1.2±0.3)mmol/L与(0.9±0.2)mmol/L,两者的差异具有统计学意义(P<0.05),该结果与人类受试者的情况一致。如T1D患者频发酮症,其血液中的酮体水平较高,临床常规检查常见血酮水平达1~2 mmol/L的患者,而健康个体的血酮浓度均低于0.5 mmol/L[11]。
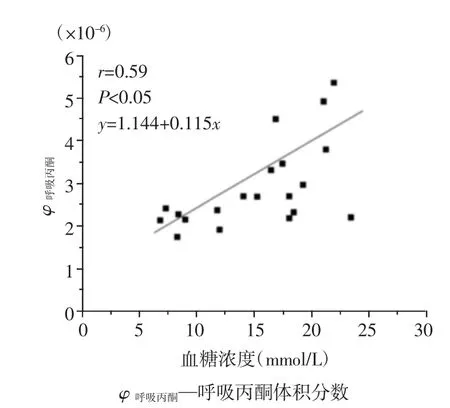
图9 经胰岛素治疗的1型糖尿病大鼠呼吸丙酮与血糖的关系

图8 大鼠呼吸丙酮与血糖浓度在连续6 h内的变化关系
如图10A所示,T1D大鼠的呼吸丙酮和血液BHB浓度关系呈显著正相关(相关系数r=0.644,P<0.05)。虽然本研究是在大鼠模型上开展的,但此结果进一步证实了近期涉及113例年轻T1D患者的研究结果[9],即:呼吸丙酮和血液BHB浓度呈显著正相关关系。此外,这2个参数间类似的正相关关系也存在于健康人空腹酮症[37-38]和营养酮症[14-15]。
为了进一步验证呼吸丙酮与血液BHB浓度的关系,笔者随机选择健康大鼠1只、3DSI大鼠1只和STZ诱导T1D大鼠2只,进行连续6 h的呼吸丙酮浓度测量,其呼吸丙酮体积分数范围分别为(1.5~2.2)×10-6、(1.9~6.1)×10-6、(2.5~8.0)×10-6和(2.0~3.6)×10-6。如图11所示,4只大鼠的呼吸丙酮与血液BHB浓度存在正相关性,且血液BHB浓度随时间而升高,证实了呼吸丙酮浓度可用于血液BHB的预测。
2.4 多元线性回归分析
使用多元线性回归进行呼吸丙酮浓度的敏感性分析[39],即各因素对大鼠模型呼吸丙酮浓度的影响,包括BG和血液BHB浓度、体质量及大鼠类型(0—健康大鼠,1—T1D大鼠)。拟合的呼吸丙酮回归方程为
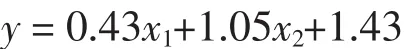
式中:y为呼吸丙酮,x1为大鼠类型,x2为血液BHB浓度。回归模型的决定系数R2=0.684,其具有统计学意义(P<0.001)。表2所示,证明血液BHB浓度(回归系数为1.05)和大鼠类型(回归系数为0.43)是大鼠呼吸丙酮的主要影响因素,而BG浓度和体质量对大鼠呼吸丙酮浓度无显著影响(P>0.05)。
为进一步验证T1D大鼠呼吸丙酮对于血液BHB的预测能力,额外选取了10只健康大鼠与10只T1D大鼠进行呼吸丙酮的测定(图12)。结果显示其相关系数r=0.95,表明该模型具有良好的血液BHB预测能力。
3 结 论
本研究使用基于CRDS的呼吸丙酮分析仪测定了T1D大鼠和健康大鼠呼吸气体中的丙酮含量。该呼吸丙酮分析仪的准确性经过了气相色谱-质谱联用仪(GC-MS)的验证。经口腔插管法与气管切开法比较后,选择口腔插管法对大鼠进行呼吸气体的采集。
采用20只T1D大鼠和18只健康大鼠,采集与测定了其呼吸样本呼吸丙酮的含量,并同时测定了BG和血液BHB浓度。结果显示,T1D大鼠组的呼吸丙酮、BG和血液BHB浓度与健康大鼠组比较,其差异均有统计学意义(P<0.05)。T1D大鼠和健康大鼠的呼吸丙酮含量与血液BHB浓度呈显著正相关性,而T1D大鼠的呼吸丙酮含量与BG呈显著负相关性。但是,当T1D大鼠的BG趋向正常值时(接受胰岛素治疗),其呼吸丙酮和BG的关系即由负相关转为弱正相关;此外,健康大鼠的呼吸丙酮浓度与BG浓度无相关性。多元线性回归分析显示,T1D大鼠的呼吸丙酮可用于其血液BHB浓度的预测,并使用额外的10只健康大鼠和10只T1D大鼠对此回归模型进行了验证。该结果与近期一项涉及人类T1D患者的研究结果相符[9],但仍需更大样本的进一步验证。
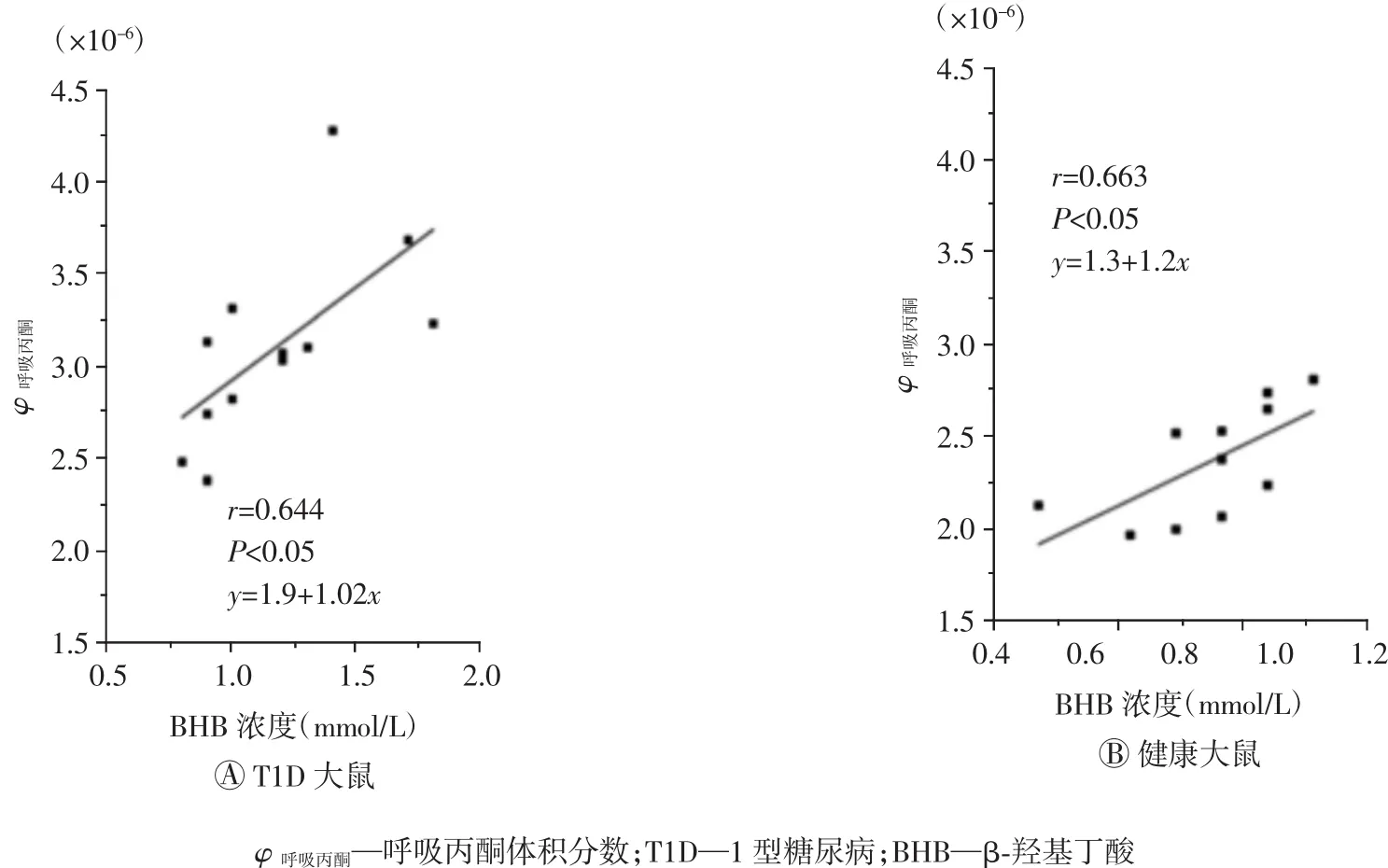
图10 T1D大鼠和健康大鼠呼吸丙酮与BHB关系
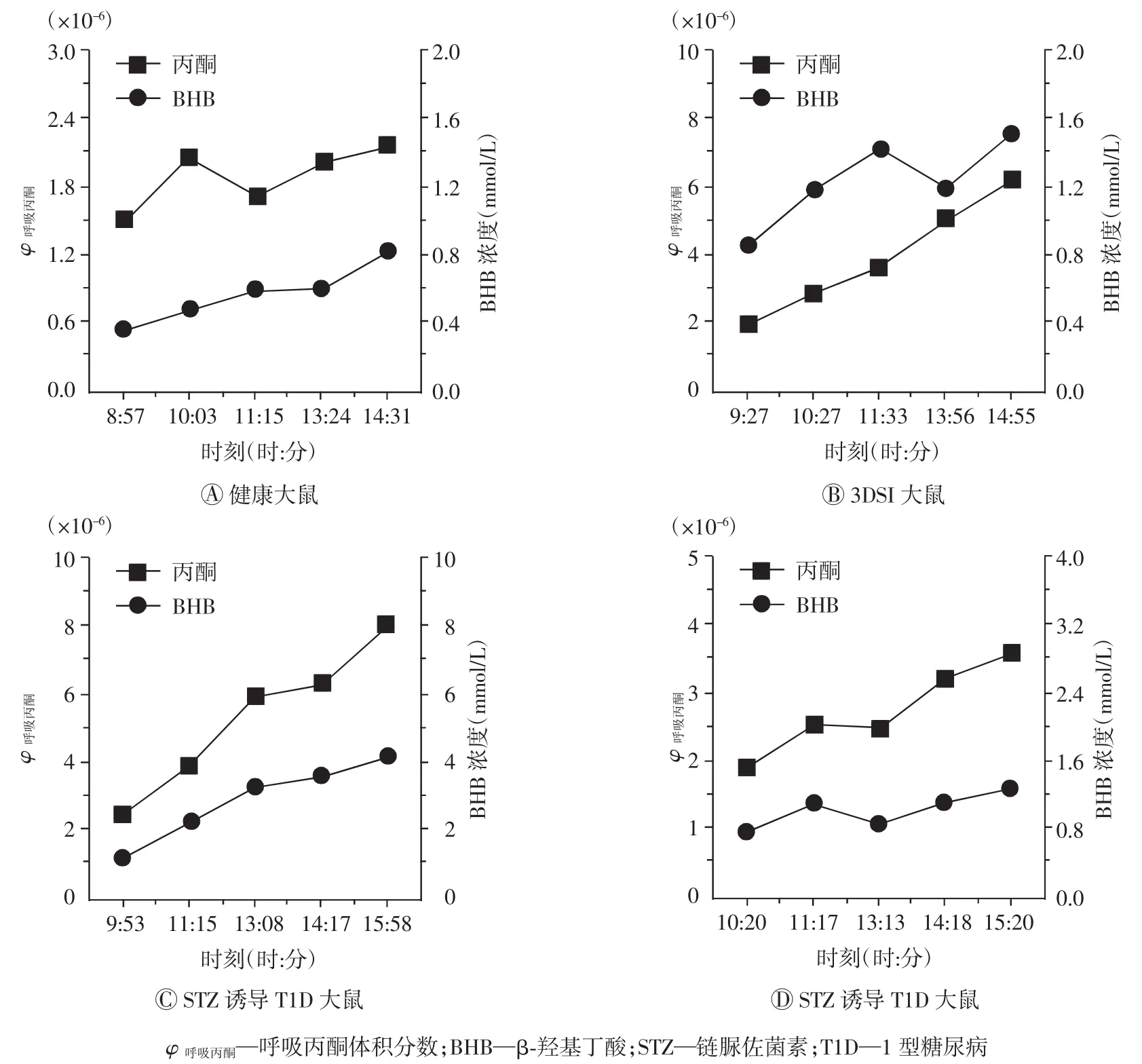
图11 大鼠呼吸丙酮与BHB连续6 h的变化关系
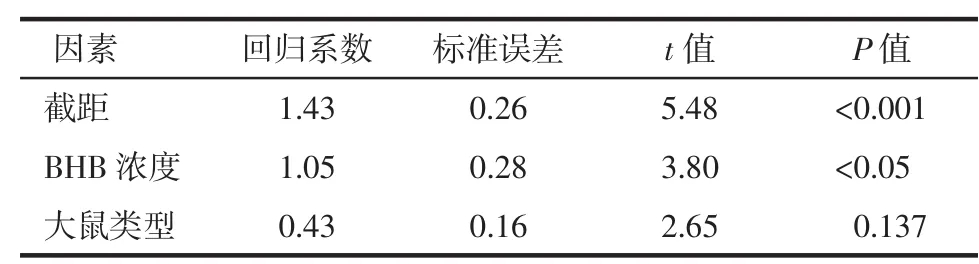
表2 BHB结果的多元回归分析
注:BHB—β-羟基丁酸
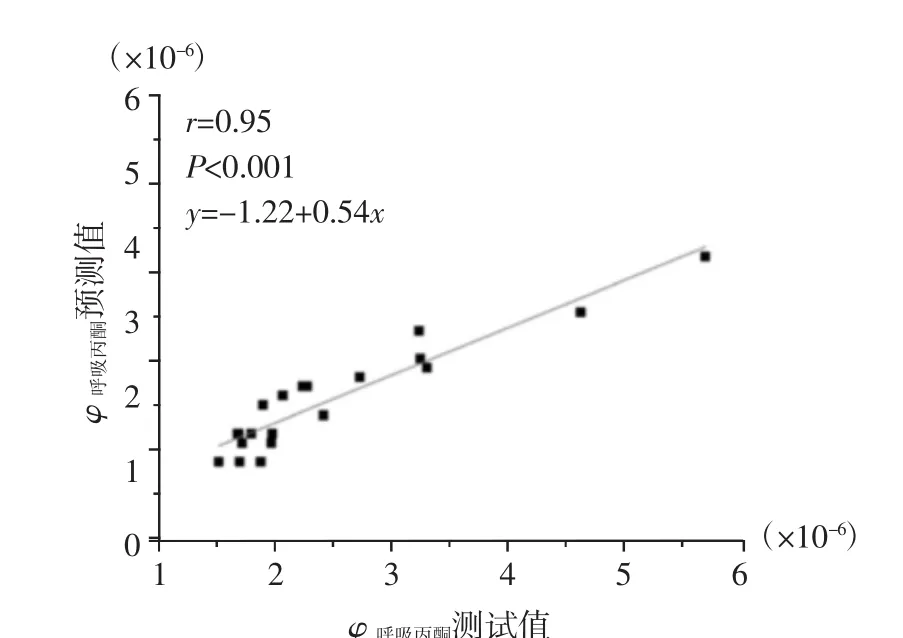
图12 1型糖尿病大鼠血液β-羟基丁酸回归曲线验证
本研究进一步证明了使用大鼠动物模型进行呼吸气体研究是可行的。因T1D动物模型比人类受试者的标准化更好(生理差异小),且使用腔衰荡呼吸分析仪检测速度快,无需对样品进行预处理,可在短时间内进行大量样本分析。因此,使用T1D大鼠模型和腔衰荡呼吸分析法进行呼吸分析,有助于解决呼吸气体分析中定量关系的问题。
利益冲突 无
(图1~5见插页5-5、5-6)
[1]Di Natale C,Paolesse R,Martinelli E,et al.Solid-state gas sensors for breath analysis:a review[J].Anal Chim Acta,2014,824:1-17. DOI:10.1016/j.aca.2014.03.014.
[2]Deng CH,Zhang XM,Li N.Investigation of volatile biomarkers in lung cancer blood using solid-phase microextraction and capillary gas chromatography-mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci,2004,808(2):269-277.DOI:10.1016/j. jchromb.2004.05.015.
[3]Anderson JC,Lamm WJ,Hlastala MP.Measuring airway exchange of endogenous acetone using a single-exhalation breathing maneuver[J]. J Appl Physiol(1985),2006,100(3):880-889.DOI:10.1152/ japplphysiol.00868.2005.
[4]Wang ZN,Wang CJ.Is breath acetone a biomarker of diabetes?A historical review on breath acetone measurements[J].J Breath Res,2013,7(3):037109.DOI:10.1088/1752-7155/7/3/037109.
[5]Tassopoulos CN,Barnett D,Fraser TR.Breath-acetone and bloodsugar measurements in diabetes[J].Lancet,1969,293(7609):1282-1286.DOI:10.1016/S0140-6736(69)92222-3.
[6]Turner C,Walton C,Hoashi S,et al.Breath acetone concentration decreases with blood glucose concentration in type I diabetes mellitus patients during hypoglycaemic clamps[J].J Breath Res, 2009,3(4):046004.DOI:10.1088/1752-7155/3/4/046004.
[7]Wang CJ,Mbi A,Shepherd M.A study on breath acetone in diabetic patients using a cavity ringdown breath analyzer:exploring correlationsofbreathacetonewithbloodglucoseandglycohemoglobina1C[J]. IEEE Sens J,2010,10(1):54-63.DOI:10.1109/JSEN.2009.2035730.
[8]Rydosz A.A negative correlation between blood glucose and acetone measured in healthy and type 1 diabetes mellitus patient breath[J].J Diabetes Sci Technol,2015,9(4):881-884.DOI:10.1177/ 1932296815572366.
[9]Blaikie TP,Edge JA,Hancock G,et al.Comparison of breath gases, including acetone,with blood glucose and blood ketones in children and adolescents with type 1 diabetes[J].J Breath Res,2014,8(4): 046010.DOI:10.1088/1752-7155/8/4/046010.
[10]Nelson N,Lagesson V,Nosratabadi AR,et al.Exhaled isoprene and acetone in newborn infants and in children with diabetes mellitus[J]. Pediatr Res,1998,44(3):363-367.DOI:10.1203/00006450-199809000-00016.
[11]Jain SK,McVie R,Bocchini JA.Hyperketonemia(ketosis),oxidative stress and type 1 diabetes[J].Pathophysiology,2006,13(3):163-170. DOI:10.1016/j.pathophys.2006.05.005.
[12]Alberti KGMM,Zimmet P,DeFronzo RA,et al.International textbook of diabetes mellitus[M].2nd ed.Chichester:John Wiley& Sons,1997:1215-1229.
[13]Laffel LM,Wentzell K,Loughlin C,et al.Sick day management using blood 3-hydroxybutyrate(3-OHB)compared with urine ketone monitoring reduces hospital visits in young people with T1DM:a randomized clinical trial[J].Diabet Med,2006,23(3):274-284. DOI:10.1111/j.1464-5491.2005.01771.x.
[14]Musa-Veloso K,Likhodii SS,Rarama E,et al.Breath acetone predicts plasma ketone bodies in children with epilepsy on a ketogenic diet[J].Nutrition,2006,22(1):1-8.DOI:10.1016/j.nut. 2005.04.008.
[15]Musa-Veloso K,Likhodii SS,Cunnane SC.Breath acetone is a reliable indicator of ketosis in adults consuming ketogenic meals[J]. Am J Clin Nutr,2002,76(1):65-70.
[16]Likhodii SS,Musa K,Cunnane SC.Breath acetone as a measure of systemic ketosis assessed in a rat model of the ketogenic diet[J].Clin Chem,2002,48(1):115-120.
[17]Schwarz K,Pizzini A,Arendacká B,et al.Breath acetone-aspects of normal physiology related to age and gender as determined in a PTRMS study[J].J Breath Res,2009,3(2):027003.DOI:10.1088/1752-7155/3/2/027003.
[18]Spanel P,Dryahina K,Smith D.The concentration distributions of some metabolites in the exhaled breath of young adults[J].J Breath Res,2007,1(2):026001.DOI:10.1088/1752-7155/1/2/026001.
[19]Spanel P,Dryahina K,Rejskova AA,et al.Breath acetone concentration;biological variability and the influence of diet[J]. Physiol Meas,2011,32(8):N23-N31.DOI:10.1088/0967-3334/32/ 8/N01.
[20]Tisch U,Aluf Y,Ionescu R,et al.Detection of asymptomatic nigrostriatal dopaminergic lesion in rats by exhaled air analysis using carbon nanotube sensors[J].ACS Chem Neurosci,2012,3(3): 161-166.DOI:10.1021/cn200093r.
[21]Wolf A,Baumbach JI,Kleber A,et al.Multi-capillary column-ion mobility spectrometer(MCC-IMS)breath analysis in ventilated rats: a model with the feasibility of long-term measurements[J].J Breath Res,2014,8(1):016006.DOI:10.1088/1752-7155/8/1/016006.
[22]Vautz W,Nolte J,Bufe A,et al.Analyses of mouse breath with ion mobility spectrometry:a feasibility study[J].J Appl Physiol,2010, 108(3):697-704.DOI:10.1152/japplphysiol.00658.2009.
[23]Neuhaus S,Seifert L,Vautz W,et al.Comparison of metabolites in exhaled breath and bronchoalveolar lavage fluid samples in a mouse model of asthma[J].J Appl Physiol,2011,111(4):1088-1095.DOI: 10.1152/japplphysiol.00476.2011.
[24]Guaman AV,Carreras A,Calvo D,et al.Rapid detection of sepsis in rats through volatile organic compounds in breath[J].J Chromatogr B Analyt Technol Biomed Life Sci,2012,881-882:76-82.DOI: 10.1016/j.jchromb.2011.12.001.
[25]Fink T,Wolf A,Maurer F,et al.Volatile organic compounds during inflammation and sepsis in rats a potential breath test using ionmobility spectrometry[J].Anesthesiology,2015,122(1):117-126. DOI:10.1097/ALN.0000000000000420.
[26]Ebeler SE,Clifford AJ,Shibamoto T.Quantitative analysis by gas chromatography of volatile carbonyl compounds in expired air from mice and human[J].J Chromatogr B Biomed Sci Appl,1997,702 (1-2):211-215.DOI:10.1016/S0378-4347(97)00369-1.
[27]Sethi JM,Choi AM,Calhoun WJ,et al.Non-invasive measurements of exhaled NO and CO associated with methacholine responses in mice[J].Respir Res,2008,9(1):1-14.DOI:10.1186/1465-9921-9-45.
[28]Wilhelm J,Vanková M,Maxová H,et al.Hydrogen peroxide production by alveolar macrophages is increased and its concentration is elevated in the breath of rats exposed to hypoxia: relationship to lung lipid peroxidation[J].Physiol Res,2003,52(3): 327-332.
[29]Weicker S,Karachi TA,Scott JA,et al.Noninvasive measurement of exhaled nitric oxide in a spontaneously breathing mouse[J].Am J Respir Crit Care Med,2001,163(5):1113-1116.DOI:10.1164/ ajrccm.163.5.2007025.
[30]Aprea E,Morisco F,Biasioli F,et al.Analysis of breath by proton transfer reaction time of flight mass spectrometry in rats with steatohepatitis induced by high-fat diet[J].J Mass Spectrom,2012, 47(9):1098-1103.DOI:10.1002/jms.3009.
[31]Wang C,Sahay P.Breath analysis using laser spectroscopic techniques:breath biomarkers,spectral fingerprints,and detection limits[J].Sensors(Basel),2009,9(10):8230-8262.DOI:10.3390/ s91008230.
[32]Gong ZY,Sun MX,Jiang CY,et al.A ringdown breath acetone analyzer:performance and validation using gas chromatographymass spectrometry[J].J Anal Bioanal Tech,2014,S7:013.DOI: 10.4172/2155-9872.S7-013.
[33]Wang CJ,Surampudi AB.An acetone breath analyzer using cavity ringdown spectroscopy:an initial test with human subjects under various situations[J].Meas Sci Technol,2008,19(10):934-939. DOI:10.1088/0957-0233/19/10/105604.
[34]Wang CJ,Mbi A.A new acetone detection device using cavity ringdown spectroscopy at 266 nm:evaluation of the instrument performance using acetone sample solutions[J].Meas Sci Technol, 2007,18(8):2731-2741.DOI:10.1088/0957-0233/18/8/051.
[35]NIST Chemistry WebBook.Acetone UV/VIS spectrum,acetone IR spectrum[EB/OL].[2016-09-15].http://webbook.nist.gov/chemistry.
[36]Sun MX,Chen ZY,Gong ZY,et al.Determination of breath acetone in 149 type 2 diabetic patients using a ringdown breath-acetone analyzer[J].Anal Bioanal Chem,2015,407(6):1641-1650.DOI: 10.1007/s00216-014-8401-8.
[37]Prabhakar A,Quach A,Wang D,et al.Breath acetone as biomarker for lipid oxidation and early ketone detection[J].Glob J Obes, Diabetes Metab Syndr,2014,1(1):12-19.DOI:10.17352/2455-8583.000003.
[38]Tanda N,Hinokio Y,Washio J,et al.Analysis of ketone bodies in exhaled breath and blood of ten healthy Japanese at OGTT using a portable gas chromatograph[J].J Breath Res,2014,8(4):046008. DOI:10.1088/1752-7155/8/4/046008.
[39]Jobson JD.Applied multivariate data analysis[M].New York: Springer,1991:219-398.
Correlations of breath acetone with blood glucose and blood beta-hydroxybutyrate using type 1 diabetic ratmodel
Yuan Yuan,Chen Zhuying,Huang He,Zhao Xiaomeng,Wang Zhennan,Sun Meixiu
Institute of Biomedical Engineering,Chinese Academy of Medical Sciences&Peking Union Medical College,Tianjin 300192,China
Sun Meixiu,Email:meixiu_sun@126.com
Objective The breath acetone is a potential biomarker for diabetic diagnosis,because some of type 2 and type 1 diabetic(T1D)patients frequently experience ketosis.This paper aims to study the correlations of breath acetone with blood glucose(BG)and blood beta-hydroxybutyrate(BHB)using T1D rat model.Methods Breath acetone values from the 20 T1D and 18 healthy rats were determined using a cavity ringdown spectroscopy based breath analyzer.Simultaneous BG and blood BHB levels were also measured.Results The results showed that breath acetone,BG,and blood BHB in the T1D rat group all have significant difference with that in the healthy rat group(P<0.05).A significant positive relationship between breath acetone and blood BHB was found to exist in both the T1D and healthy rats,and a significant negative relationship between breath acetone and BG was found in the T1D rats.However,the relationship between breath acetone and BG shifts from negative to weakly positive when T1D rats were treated by insulin.No correlation between breath acetone and BG was found in the healthy rats.The multiple linear regression analysis revealed that breath acetone had the predictive nature for blood BHB in T1D rats,and the predictable ability of the model was verified by testing the breath acetone and simultaneous blood BHB from additional 10 healthy rats and 10 T1D rats.Conclusions The findings of this study suggest the usage of rat model is feasible and may help address the question of quantitative correlations in human breath analysis.
Breath analysis; Cavity ringdown spectroscopy; Diabetic rat model; Breath acetone; Blood glucose;Beta-hydroxybutyrate
孙美秀,Email:meixiu_sun@126.com
10.3760/cma.j.issn.1673-4181.2016.05.002
国家自然科学基金(81471701)
2016-09-11)
