载TGF-β1纳米粒的胶原/丝素蛋白复合支架的制备与表征
2016-04-11方哲翔王建华程娘梅张其清
方哲翔 王建华 程娘梅 张其清
350002福州大学生物和医药技术研究院(方哲翔、王建华、程娘梅);300192天津,中国医学科学院 北京协和医学院生物医学工程研究所(张其清)
载TGF-β1纳米粒的胶原/丝素蛋白复合支架的制备与表征
方哲翔 王建华 程娘梅 张其清
350002福州大学生物和医药技术研究院(方哲翔、王建华、程娘梅);300192天津,中国医学科学院 北京协和医学院生物医学工程研究所(张其清)
目的 构建一种载转化生长因子β1(TGF-β1)纳米粒的双层胶原/丝素蛋白复合支架。方法 制备载TGF-β1的壳聚糖-肝素(Ch-Hep)纳米粒,检测其形态、粒径、Zeta电位和包封率。制备不同胶原和丝素蛋白质量比(2∶8、3∶7、7∶3、8∶2、10∶0)的5种胶原/丝素蛋白复合材料,分别检测其吸水率、孔隙率、热水溶失率和生物相容性;选择其中2种综合性能良好的复合材料分别作为复合支架的疏松层和致密层,构建载TGF-β1纳米粒的双层胶原/丝素蛋白复合支架,观察其形态并进行体外释放动力学研究。结果 Ch-Hep纳米粒的平均粒径为(718.2±73.6)nm,Zeta电位为(25.5±0.8)mV,对TGF-β1的包封率为(84.82±1.57)%。随着胶原/丝素蛋白复合材料中胶原含量的增加,材料的吸水率、孔隙率逐渐增加,热水溶失率逐渐降低;5种材料对骨髓间充质干细胞(BMSCs)均有促生长和增殖的作用。综合考虑后选用质量比为3∶7和7∶3的胶原/丝素蛋白复合材料分别作为复合支架的致密层和疏松层,构建的胶原/丝素蛋白复合支架为双层结构,一侧结构致密,另一侧疏松多孔。体外释放动力学研究表明,复合支架对TGF-β1具有定向时空控制性释放作用。结论 载TGF-β1纳米粒的双层胶原/丝素蛋白复合支架对TGF-β1具有良好的时空控制释放作用,有望作为生长因子的控缓释支架材料应用于软骨组织工程。
胶原; 丝素蛋白; 转化生长因子β1; 纳米粒
Fund program:National Natural Science Foundation of China(31271023);Natural Science Foundation of Fujian Province(2012J01209)
0 引 言
近年来,由创伤、肿瘤、骨质疏松等多种原因引起的关节软骨缺损发病率逐年增加,对人类健康造成了极大的威胁,组织工程技术的出现为软骨缺损治疗带来了新希望。对与关节软骨缺损相关的生长因子、种子细胞和支架材料的研究使关节软骨缺损的再生修复成为可能,其中载生长因子的控缓释支架材料的构建是其重要的研究方向之一。
本研究选取壳聚糖和肝素制备载转化生长因子 β1(transforming growth factor-β1,TGF-β1)的纳米粒,并将其复合于致密程度不同的双层胶原/丝素蛋白复合材料中,构建载TGF-β1纳米粒的胶原/丝素蛋白复合支架并进行体外释放动力学研究,为其在软骨缺损治疗中的应用提供理论基础和实验数据。
1 材料与方法
1.1 主要材料与仪器
蚕茧(江苏苏豪国际集团股份有限公司),牛腱胶原(福建省博特生物科技有限公司),壳聚糖(相对分子质量为1×105,脱乙酰度为90%)(生工生物工程(上海)股份有限公司),肝素钠(上海丽臣商贸有限公司),TGF-β1(美国Sigma-Aldrich公司),BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司),DMEM/F-12(1∶1)培养基(美国HyClone公司),I型胶原酶(美国Gibco公司),骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)(福州大学生物和医药技术研究院自制)。
DNM-9602酶标仪(北京普朗新技术有限公司),HH.CP-TCO2恒温培养箱(上海齐欣科学仪器有限公司),AFZ-1001-U超纯水系统(美国艾科浦国际有限公司),JEM-100CXII透射电镜(日本电子株式会社),XL30ESEM-TMP环境扫描电镜(荷兰Philips-FEI公司),Zetasizer Nano S90粒度分析仪(英国Malvern仪器有限公司),TP114电子天平(赛多利斯科学仪器(北京)有限公司),Biofuge PrimoR冷冻离心机(美国Thermo Fisher Scientific公司),DF-101S磁力搅拌器(上海雷磁新泾仪器公司)。
1.2 方法
1.2.1 载TGF-β1的壳聚糖-肝素纳米粒的制备和表征
分别配制质量浓度为2 mg/ml的壳聚糖溶液和1 mg/ml的肝素钠溶液;将0.4 mg TGF-β1溶于0.2 ml水中,加入5 ml肝素钠溶液混合过夜;在4℃下以700 r/min搅拌,将2 ml壳聚糖溶液逐滴滴入肝素钠混合溶液中,即得载TGF-β1的壳聚糖-肝素(chitosan-heparin,Ch-Hep)纳米粒。
吸取适量载TGF-β1的Ch-Hep纳米粒滴于铜网上,于空气中自然干燥过夜,用透射电镜观察其形态;将载TGF-β1的Ch-Hep纳米粒用0.8 μm滤膜过滤,用粒度分析仪检测其粒径和Zeta电位。
1.2.2 载TGF-β1的Ch-Hep纳米粒的包封率测定
按BCA试剂A∶试剂B的体积比为50∶1配制BCA工作液;配制质量浓度为0.5 mg/ml的牛血清白蛋白(bovine serum albumin,BSA)标准品溶液;将BSA溶液按0、1、2、4、8、12、16、20 μl分别加入96孔板中,各孔稀释至20 μl,配成不同质量浓度的BSA标准品溶液;每孔加入200 μl BCA工作液,室温放置30 min,于546 nm处测定吸光度(absorbance,OD)值;以标准品BSA含量(μg)为横坐标,以平均OD值为纵坐标,绘制BCA试剂盒蛋白浓度标准曲线;将1.2.1节中制备的载TGF-β1的Ch-Hep纳米粒的肝素钠混合液在8 000 r/min、4℃条件下离心10 min,用BCA试剂盒检测上清液中TGF-β1的含量,计算Ch-Hep纳米粒的包封率。

1.2.3 胶原/丝素蛋白复合材料的制备
将蚕茧剪碎后放入质量浓度为5 g/L的Na2CO3溶液中,100℃水浴30 min,取出清洗,60℃烘干,即得经脱胶处理后的丝素丝;在80℃下,用CaCl2/ H2O/C2H5OH溶液(摩尔比为1∶8∶2)溶解脱胶后的丝素丝,浴比为1∶25,过滤透析3 d,得到丝素蛋白溶液;取培养皿称取质量,培养皿中加入丝素蛋白溶液,称取质量,置于80℃烘箱8 h后,每30分钟取出称取质量,直至质量不再变化。式中:M0为培养皿质量,M1为加入丝素蛋白溶液后的质量,M2为置烘箱后的恒定质量。

取适量牛腱胶原加入0.1 mol/L醋酸溶液中,搅拌使其溶解,制得质量浓度为6 g/L的胶原溶液,静置1 h后取出放入4℃冰箱备用;按丝素蛋白的检测浓度,将胶原和丝素蛋白分别按质量比2∶8、3∶7、7∶3、8∶2、10∶0缓慢混合,磁力搅拌4 h后冻干,得5组胶原/丝素蛋白复合材料;将胶原/丝素蛋白复合材料浸入1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)/ N-羟基琥珀酰亚胺(NHS)交联剂中交联8 h,水洗除去交联剂后冻干即得胶原/丝素蛋白复合材料。
1.2.4 胶原/丝素蛋白复合材料的筛选
将各组胶原/丝素蛋白复合材料剪成1 cm×1 cm小块,称取质量;浸入磷酸盐缓冲液(phosphate buffered saline,PBS)(pH7.4)中,37℃水浴24 h后取出,吸干表面水分,称取质量,按下式计算吸水率

式中:W0为复合材料浸入PBS后的质量,W1为复合材料干燥状态下的质量。
将各组胶原/丝素蛋白复合材料小块浸入无水乙醇中;8 min后负压脱气至无气泡逸出,记录此时无水乙醇体积;用镊子取出样品,记录剩余乙醇体积,按下式计算孔隙率

式中:V1为复合材料浸入的无水乙醇体积,V2为脱气后的无水乙醇体积,V3为取出复合材料后的无水乙醇体积。
将各组胶原/丝素蛋白复合材料小块称取质量;浸入PBS(pH7.4)中,37℃水浴24 h,放入烘箱烘干,称取质量,按下式计算热水溶失率
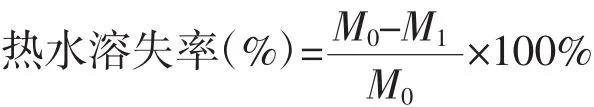
式中:M0为复合材料干燥状态下的质量,M1为复合材料浸入PBS再烘干后的质量。
将各组胶原/丝素蛋白复合材料放入培养板,每孔加入1.0 ml DMEM/F-12培养基,每组材料表面接种1×105个骨髓间充质干细胞,放入培养箱培养5 h;再将材料转至新的培养板,每3天换液1次;分别于接种后的第1、3和5天用PBS清洗,每孔加入200 μl噻唑蓝(thiazolyl blue tetrazolium bromide, MTT)溶液,继续培养4 h,吸弃孔中溶液,加入600 μl二甲基亚砜后振荡30 min,分别于490 nm处测定OD值。
1.2.5 载TGF-β1纳米粒的双层胶原/丝素蛋白复合支架的制备与表征
根据1.2.4节的检测结果,选取胶原和丝素蛋白质量比分别为3∶7和7∶3的胶原/丝素蛋白复合材料制备双层胶原/丝素蛋白复合支架,其中3∶7作为致密层材料,7∶3作为疏松层材料。
制备时将疏松层胶原/丝素蛋白材料用双蒸水润湿后平铺,表面滴加载TGF-β1的Ch-Hep纳米粒溶液,4~8℃风干至表面无流动液体;将致密层胶原/丝素蛋白材料润湿后平铺于疏松层之上,4~8℃风干,即得载生长因子的双层胶原/丝素蛋白复合材料;用液氮脆断制样,导电胶固定,喷金5 min后用扫描电镜观察。
1.2.6 载TGF-β1纳米粒的双层胶原/丝素蛋白复合支架的体外释放动力学研究
将自行设计的流池法简易检测装置[1]置于37℃水浴锅内;将载TGF-β1纳米粒的双层胶原/丝素蛋白复合支架置于滤器内,在恒流泵作用下,液体从双层材料流出,流出方向分别为疏松层→致密层(SM)和致密层→疏松层(MS);流入的释放液分别为PBS(pH7.4)和质量浓度为0.5 mg/ml的Ⅰ型胶原酶;调整恒流泵流速为0.5 ml/h,每24小时收集1次;采用BCA试剂盒检测收集液中TGF-β1的含量,绘制TGF-β1的释放曲线。
1.3 统计学方法
采用SPSS18.0统计学软件处理数据,数据以均数±标准差(x±s)表示,数据比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 载TGF-β1的Ch-Hep纳米粒的表征
由透射电镜结果(图1A)可看出,载TGF-β1的Ch-Hep纳米粒形状不规则,呈颗粒状,中间加深部分为TGF-β1。载TGF-β1的Ch-Hep纳米粒粒径呈正态分布,分布范围集中,平均粒径为(718.2± 73.6)nm(图1B),Zeta电位为(25.5±0.8)mV(图1C)。
2.2 载TGF-β1的Ch-Hep纳米粒包封率的测定
以平均OD值与对应的BSA浓度绘制蛋白含量标准曲线,结果如图2所示,蛋白浓度标准曲线方程为y=0.001 1x+0.123 3,r=0.994 9,表明BSA在0~500 μg/ml范围内与OD值成线性关系。根据蛋白浓度标准曲线方程计算得出,Ch-Hep纳米粒的包封率为(84.82±1.57)%。
2.3 不同质量比胶原/丝素蛋白复合材料的吸水率、孔隙率、热水溶失率和生物相容性检测
由图3A可知,不同质量比的胶原/丝素蛋白复合材料均具有良好的吸水率,随着胶原含量的增加,胶原/丝素蛋白复合材料的吸水率逐渐升高。胶原/丝素蛋白复合材料的孔隙率见图3B,其中胶原和丝素蛋白质量比为2:8和3:7的复合材料的平均孔隙率均<40%,质量比为7:3、8:2和10:0的复合材料的平均孔隙率均>60%,两种不同孔隙率的复合材料可分别用作致密层和疏松层材料。图3C显示不同质量比胶原/丝素蛋白复合材料的热水溶失率均<8%,且随着胶原比例的增加,复合材料的热水溶失率呈逐渐降低的趋势。BMSCs在胶原/丝素蛋白复合材料上的增殖情况如图3D所示。以纯胶原材料(胶原和丝素蛋白的质量比为10∶0)为对照,BMSCs在其余4组复合材料(胶原和丝素蛋白的质量比分别为2∶8、3∶7、7∶3、8∶2)上均能生长和增殖,第1天细胞增殖速率较低;第3~5天细胞生长速度明显加快,细胞数量显著增加(P<0.05);第5天胶原和丝素蛋白质量比为7∶3、3:7组的细胞增殖率分居第1和第2位,均表现出显著地促细胞增殖作用(P<0.05)。综合考虑后选用质量比为3∶7和7∶3的胶原/丝素蛋白复合材料分别作为复合支架的致密层和疏松层。
2.4 载TGF-β1纳米粒的双层胶原/丝素蛋白复合支架的表征
由复合支架横截面的扫描电镜图可看出,构建的胶原/丝素蛋白复合支架为双层结构,一侧疏松多孔,另一侧结构致密。(图4)

图2 BCA法试剂盒测定蛋白含量标准曲线

图4 载转化生长因子β1的双层胶原/丝素蛋白复合支架的扫描电镜图(×4 000)
2.5 载TGF-β1纳米粒的双层胶原/丝素蛋白复合支架的释放动力学研究
图5A为载TGF-β1纳米粒的双层胶原/丝素蛋白复合支架在PBS释放液中的释放曲线,从中可看出,TGF-β1从疏松层→致密层(SM)较致密层→疏松层(MS)释放速率低;而在胶原酶释放液(图5B)中正好相反,TGF-β1从疏松层→致密层(SM)的释放速率高于致密层→疏松层(MS)。比较两种释放液环境下TGF-β1的释放速率发现,胶原酶释放液中TGF-β1的释放速率均高于PBS释放液,但两者间差异无统计学意义(P>0.05)。
3 讨论与结论
因创伤、肿瘤、骨质疏松等多种原因造成的软骨缺损是临床常见问题,对人类健康造成了极大的威胁。关节软骨因无血管、淋巴等特点而使其自愈能力受限,因此有效修复软骨缺损是亟待解决的临床难题。近年来,软骨组织工程技术[2]为软骨缺损修复提供了一种新的治疗策略,现已发展至第3代[3],即将表面接种种子细胞的载生长因子的生物材料直接植入缺损处,以诱导新组织的生成。
TGF-β1是软骨损伤修复常用的生长因子,但应用时存在半衰期短和在体内易扩散等问题,难以有效发挥TGF-β1的生物学效应。常见的解决方法是为TGF-β1选择合适的控缓释载体材料,从而使TGF-β1得到良好的时空控制性释放。纳米粒是近年发展起来的药物输送系统,具有缓释生长因子、提高因子稳定性和生物利用度等优点,在组织工程领域具有广阔的应用前景。研究结果表明,壳聚糖缓释系统在负载生长因子的同时,可与组织工程支架直接复合[4]并促进软骨细胞的黏附和增殖[5]。肝素纳米载体对生长因子具有良好的亲和性,能使生长因子均匀地分散于其中,从而实现有效地控制释放[6]。本研究结果表明,选用壳聚糖和肝素制备载TGF-β1的Ch-Hep纳米粒,其粒径较小,Zeta电位稳定,包封率高,是载TGF-β1的较理想载体。
软骨损伤修复过程存在炎症增生期、清除期和重塑期等,不同时期种子细胞的生长速度亦不同。良好的软骨组织工程支架材料不仅要为种子细胞的正常生长及细胞间信号传导提供必要的微环境,同时还要能对所载生长因子具有时空控制性释放作用。胶原是构建软骨组织工程支架的常用材料[7-9],能模拟体内基质环境,加快细胞黏附、迁移,促进软骨损伤的自我修复[10]。丝素蛋白能维持软骨细胞的正常生长状态和性能,可用于软骨及骨的重建和再生[11-13]。基于前期的研究基础[14-16],本研究利用胶原和丝素蛋白材料制备了不同质量比的5种胶原/丝素蛋白复合材料,并选取其中2种综合性能良好的胶原/丝素蛋白复合材料分别作为复合支架的疏松层和致密层,构建了载TGF-β1纳米粒的双层胶原/丝素蛋白复合支架。
为考察胶原/丝素蛋白复合支架对所载TGF-β1的释放行为,本研究模拟了体液环境,考察在PBS和胶原酶两种介质中,复合支架疏松层→致密层(SM)和致密层→疏松层(MS)两种不同取向对生长因子释放的影响。在PBS释放液中,TGF-β1从疏松层→致密层(SM)较致密层→疏松层(MS)的释放速率低,其影响因素主要与扩散有关;在胶原酶释放液中,TGF-β1从疏松层→致密层(SM)较致密层→疏松层(MS)的释放速率高,表明疏松材料更易受胶原酶消化降解的影响。胶原酶释放介质中的释放模式更符合生物体内的实际情况,因此致密层→疏松层(MS)取向更利于软骨的缺损修复。本研究构建的胶原/丝素蛋白复合支架双侧结构的不同导致TGF-β1的释放速率不同,具有定向时空控制释放的特点,这与其他文献报道的结果相一致[1,17]。
本研究采用胶原和丝素蛋白设计并构建了一种载TGF-β1纳米粒的双层异相结构复合支架,对TGF-β1具有定向时空控制释放性。后续将进一步开展BMSCs在载TGF-β1纳米粒的胶原/丝素蛋白复合支架上的黏附、增殖及修复软骨缺损动物模型的研究,为阐明载TGF-β1纳米粒的胶原/丝素蛋白复合支架材料修复软骨缺损的机理奠定实验依据和理论基础。
利益冲突 无
(图1、3见插页5-7,图5见插页5-8)
[1]Li XE,Wang JH,Su GH,et al.Spatiotemporal control over growth factor delivery from collagen-based membrane[J].J Biomed Mater Res A,2012,100A(2):396-405.DOI:10.1002/jbm.a.33282.
[2]Mano JF,Reis RL.Osteochondral defects:present situation and tissue engineering approaches[J].J Tissue Eng Regen Med,2007, 1(4):261-273.DOI:10.1002/term.37.
[3]Bright P,Hambly K.A systematic review of reporting of rehabilitation in articular-cartilage-repair studies of third-generation autologous chondrocyte implantation in the knee[J].J Sport Rehabil,2014, 23(3,SI):182-191.DOI:10.1123/JSR.2013-0045.
[4]Thein-Han WW,Misra R.Biomimetic chitosan-nanohydroxyapatite composite scaffolds for bone tissue engineering[J].Acta Biomater, 2009,5(4):1182-1197.DOI:10.1016/j.actbio.2008.11.025.
[5]Lu GY,Sheng BY,Wei YJ,et al.Collagen nanofiber-covered porous biodegradable carboxymethyl chitosan microcarriers for tissue engineering cartilage[J].Eur Polym J,2008,44(9):2820-2829.DOI: 10.1016/j.eurpolymj.2008.06.021.
[6]Tang DW,Yu SH,Ho YC,et al.Heparinized chitosan/poly(γglutamic acid)nanoparticlesformulti-functionaldelivery of fibroblast growth factor and heparin[J].Biomaterials,2010,31(35): 9320-9332.DOI:10.1016/j.biomaterials.2010.08.058.
[7]Stark Y,Suck K,Kasper C,et al.Application of collagen matrices for cartilage tissue engineering[J].Exp Toxicol Pathol,2006,57(4): 305-311.DOI:10.1016/j.etp.2005.10,005.
[8]吴军成,霍然,吕仁荣.软骨组织工程中支架材料的文献回顾[J].中国组织工程研究,2012,16(3):522-526.DOI:10.3969/j.issn. 1673-8225.2012.03.032. Wu JC,Huo R,Lyu RR.Literature review of scaffold materials in cartilage tissue engineering[J].Chin J Tissue Eng Res,2012,16(3): 522-526.DOI:10.3969/j.issn.1673-8225.2012.03.032.
[9]Yan JH,Li XM,Liu LR,et al.Potential use of collagen-chitosanhyaluronan tri-copolymer scaffold for cartilage tissue engineering[J]. Artif Cells Blood Substit Immobil Biotechnol,2006,34(1):27-39. DOI:10.1080/10731190500430024.
[10]Zhang W,Chen JL,Tao JD,et al.The use of type 1 collagen scaffold containing stromalcell-derived factor-1 to create a matrix environment conducive to partial-thickness cartilage defects repair [J].Biomaterials,2013,34(3):713-723.DOI:10.1016/j.biomaterials. 2012.10.027.
[11]Wang YZ,Blasioli DJ,Kim HJ,et al.Cartilage tissue engineering with silk scaffolds and human articular chondrocytes[J].Biomaterials,2006,27(25):4434-4442.DOI:10.1016/j.biomaterials.2006.03.050.
[12]Fan HB,Liu HF,Toh SL,et al.Enhanced differentiation of mesenchymal stem cells co-cultured with ligament fibroblasts on gelatin/silk fibroin hybrid scaffold[J].Biomaterials,2008,29(8): 1017-1027.DOI:10.1016/j.biomaterials.2007.10.048.
[13]苗宗宁,潘宇红,祝建中,等.丝素蛋白支架材料复合骨髓间充质干细胞构建组织工程化软骨[J].中国组织工程研究与临床康复,2008,12(27):5243-5247.DOI:10.3321/j.issn:1673-8225.2008. 27.008. Miao ZN,Pan YH,Zhu JZ,et al.Constructing tissue engineered cartilage with silk fibroin compound bone marrow mesenchymai stem cells[J].J Clin Rehabil Tissue Eng Res,2008,12(27):5243-5247. DOI:10.3321/j.issn:1673-8225.2008.27.008.
[14]王建华,李学敏,陶晓军,等.碱性成纤维细胞生长因子/双层胶原基复合材料制备及其生物安全性[J].中国组织工程研究与临床康复,2011,15(47):8801-8804.DOI:10.3969/j.issn.1673-8225. 2011.47.015. Wang JH,Li XM,Tao XJ,et al.Preparation and biological safety of basic fibroblast growth factor/double-layered collagen composite[J]. J Clin Rehabil Tissue Eng Res,2011,15(47):8801-8804.DOI: 10.3969/j.issn.1673-8225.2011.47.015.
[15]Wang JH,Cheng NM,Yang Q,et al.Double-layered collagen/silk fibroin composite scaffold that incorporates TGF-β1 nanoparticles for cartilage tissue engineering[J].J Biomater Tissue Eng,2015, 5(5):357-363.DOI:10.1166/jbt.2015.1323.
[16]Wang JH,Yang Q,Cheng NM,et al.Collagen/silk fibroin composite scaffold incorporated with PLGA microsphere for cartilage repair[J]. Mater Sci Eng C Mater Biol Appl,2016,61:705-711.DOI:10.1016/ j.msec.2015.12.097.
[17]Li X,Su G,Wang J,et al.Exogenous bFGF promotes articular cartilage repair via up-regulation of multiple growth factors[J]. Osteoarthr Cartilage,2013,21(10):1567-1575.DOI:10.1016/j.joca. 2013.06.006.
Preparation and characterization of collagen/silk fibroin composite scaffold incorporating TGF-β1nanoparticles
Fang Zhexiang,Wang Jianhua,Cheng Niangmei,Zhang Qiqing
Institute of Biomedical and Pharmaceutical Technology,Fuzhou University,Fuzhou 350002,China(Fang ZX,Wang JH,Cheng NM);Institute of Biomedical Engineering,Chinese Academy of Medical Sciences&Peking Union Medical College,Tianjin 300192,China(Zhang QQ)
Zhang Qiqing,Email:zhangqiq@126.com
Objective To construct a double layered collagen/silk fibroin composite scaffold incorporating transforming growth factor-β1(TGF-β1)nanoparticles.Methods The chitosan-heparin(Ch-Hep)nanoparticles incorporating TGF-β1 were prepared and the morphology,particle size,Zeta potential and encapsulation efficiency of the nanoparticles were observed and detected.Five kinds of collagen/silk fibroin composites that had different mass ratio of collagen to silk fibroin(2∶8,3∶7,7∶3,8∶2,10∶0)were prepared,and water absorption,porosity,loss rate in hot water and biocompatibility of the composites were determined.Two kinds of the collagen/silk fibroin composites were selected as the dense and loose layers to construct double layer collagen/silk composite scaffold incorporating TGF-β1 nanoparticles,and the morphology and in vitro TGF-β1 release kinetics of the composite scaffold were observed. Results The average particle size,Zeta potential and encapsulation efficiency of Ch-Hep nanoparticles were(718.2±73.6)nm,(25.5±0.8)mV and(84.82±1.57)%,respectively.As the content of collagen in the composite increased,the water absorption and porosity of composites increased gradually,whereas the loss rate in hot water of the composites decreased gradually.All of the collagen/silk fibroin composites could promote the growth and proliferation of bone mesenchymal stem cells(BMSCs).Based on overall evaluation,collagen/silk fibroin composites with mass ratio of 3∶7 and 7∶3 were selected as the dense layer and loose layer of collagen/silk fibroin composite scaffold.The collagen/silk fibroin composite scaffold constructed was made up of two layers with one dense layer and another loose and porous layer.In vitro TGF-β1 release kinetics study showed that the composite scaffold had the ability of controlling spatiotemporal release of TGF-β1.Conclusions The collagen/silk fibroin composite scaffoldincorporating TGF-β1 nanoparticles can control the spatiotemporal release of TGF-β1,and thus has the potential for the application in cartilage tissue engineering as the sustained and controlled release scaffold of growth factor.
Collagen; Silk fibroin;Transforming growth factor-β1;Nanoparticles
张其清,Email:zhangqiq@126.com
10.3760/cma.j.issn.1673-4181.2016.05.003
国家自然科学基金(31271023);福建省自然科学基金(2012J01209)
2016-08-10)
