浅谈水的电离
2016-04-11张怀玉
张怀玉
(云南省大理州鹤庆县第一中学)
浅谈水的电离
张怀玉
(云南省大理州鹤庆县第一中学)
水是一种极弱的电解质,能发生微弱的电离,酸、碱和能水解的盐都会对水的电离平衡产生影响,那么,在酸、碱和能水解的盐溶液中,由水电离出的氢离子浓度是多少呢?从酸或碱的溶液中为“小数字”的原则和能水解的盐溶液中为“大数字”原则两个方面就酸、碱和能水解的盐溶液中由水电离出的氢离子浓度阐述了几点看法。
溶液;水;电离;浓度;氢离子;氢氧根离子
水是一种极弱的电解质,能发生微弱的电离:H2O⇌H++OH-其中c(H+)c(0H-)=KW(水的离子积),KW只受温度的影响。常温下的纯水中,c(H+)=c(OH-)=1×10-7mol/L,则KW=1×10-14。KW不仅适用于纯水,还适用于任何稀的电解质的水溶液。那么,酸、碱和能水解的盐对水的电离平衡有何影响呢?其中,由水电离出的氢离子浓度又是多少呢?
一、在酸或碱的溶液中为“小数字”的原则

例2.常温下,在PH=11的NaOH溶液中,c(H+)aq=1×10-11,有两个电离:NaOH⇌Na++OH-,H2O⇌H++OH-,由此可知c(H+)水=c(H+)aq=1×10-11小于纯水中的氢离子浓度(1×10-7),则碱抑制水的电离。可将KW的值1×10-14视为1×10-11和1×10-3的积,则碱溶液中由水电离出的氢离子浓度就为组成KW的两个数中的“小数字”。
综上所述,酸或碱都抑制水的电离,在酸或碱的水溶液中,由水电离出的氢离子浓度为组成KW的两个数字中的“小数字”。
二、在能水解的盐溶液中为“大数字”原则
例3.常温下,在PH=5的NH4Cl溶液中,c(H+)aq=1×10-5,存在

其中c(H+)水=c(H+)aq=1×10-5mol/L,大于纯水中的氢离子浓度(1×10-7),则NH4+的水解促进了水的电离。可将KW的值视为1× 10-5与1×10-9的积,则NH4Cl溶液中,由水电离出的氢离子浓度为组成KW的两个数中的“大数字”。
例4:常温下,在PH=9的Na2CO3溶液中,c(H+)aq=1×10-9,存在:
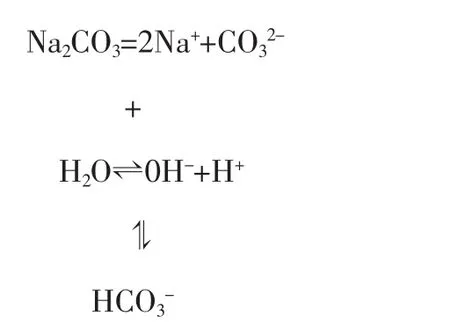
综上所述,盐的水解促进了水的电离,在能水解的盐溶液中,由水电离出的H+浓度为组成KW的两个数字中的“大数字”。
三、综合练习
1.判断由水电离出的H+浓度为1×10-12mol/L的溶液的酸碱性。
解析:可将KW的值视为1×10-12与1×10-2的积,c(H+)水为组成KW的两个数字中的“小数字”,则该溶液为酸溶液或碱溶液,溶液呈酸性或碱性。
2.常温下,在PH=5的硫酸溶液中,由水电离出的氢离子浓度为多少?
解析:c(H+)aq=1×10-5mol/L,可将KW的值视为1×10-5与1× 10-9的积,在酸溶液中,由水电离出的氢离子浓度为组成KW的两个数字中的“小数字”,故c(H+)水=1×10-9.
杨国明.浅谈外界条件对水电离程度的影响[J].化学教学,2007(3).
·编辑 李建军
