重组人胸腺肽α1在大肠杆菌中的表达纯化与鉴定
2016-04-11尹凤红肖清江周卫东陈清西厦门大学生命科学学院福建厦门36110厦门特宝生物工程股份有限公司福建厦门3610
尹凤红,肖清江,周卫东,陈清西(1.厦门大学生命科学学院,福建厦门36110;.厦门特宝生物工程股份有限公司,福建厦门3610)
重组人胸腺肽α1在大肠杆菌中的表达纯化与鉴定
尹凤红1,2,肖清江2,周卫东2,陈清西1*
(1.厦门大学生命科学学院,福建厦门361102;2.厦门特宝生物工程股份有限公司,福建厦门361022)
摘要:采用大肠杆菌作为宿主表达重组人胸腺肽α1(rh Tα1)融合蛋白,纯化获得rh Tα1并对其鉴定.于300 L发酵罐进行中试发酵表达rh Tα1融合蛋白;经异丙基-β-D-硫代吡喃半乳糖苷(IPTG)诱导,离心发酵液收集菌体,菌体经破碎、离心、亲和层析捕获,获得融合蛋白;每升发酵液可获得约170 mg硫氧环蛋白-胸腺肽α1融合蛋白.融合蛋白经肠激酶酶切后,再经亲和层析、反相层析、体积排阻层析等纯化步骤,获得高纯度rh Tα1;通过本纯化工艺获得的rh Tα1原液经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和高效液相色谱-排阻法(HPLC-SEC)的检测纯度均大于99%;采用玫瑰花环形成率测定rh Tα1活性与市售化学合成标准品一致;质谱分析分子质量为3 066.59 u,与去乙酰化的rh Tα1理论分子质量(3 066 u)一致;N端测序结果与理论值一致.综上结果,说明本工艺可实现工业化规模生产.
关键词:重组人胸腺肽α1(rh Tα1);表达;纯化
胸腺素α1(thymosin-alpha 1,Tα1)作为免疫调节因子,可以启动T淋巴细胞的成熟,刺激分泌干扰素及各种淋巴细胞介素,以及增强自然杀伤细胞介导的细胞毒性.对Tα1的临床研究主要集中在治疗乙型肝炎及丙型肝炎方面,能够显著增强机体免疫力,对肝炎病毒的复制繁殖具有显著抑制作用[1-3];也有关于Tα1治疗肺癌等肿瘤及其他免疫缺陷疾病的报道[4-5]. 1977年Goldstein等首次在胸腺组织内发现:人的Tα1是由28个氨基酸组成、N端乙酰化的酸性多肽,其分子质量为3 108 u,等电点为4.2,分子中有6对重复氨基酸残基;氨基酸序列为Ser-Asp-Ala-Ala-Val-Asp-Thr-Ser-Ser-Glu-Ile-Thr-Thr-Lys-Asp-Leu-Lys-Glu-Lys-Lys-Glu-Val-Val-Glu-Glu-Ala-Glu-Asn[6].
目前Tα1生产工艺主要有两种:一种是生化提取法,另一种是化学合成法.生化提取材料来源受限,有效成分Tα1含量低(质量分数小于1%),成本高;化学合成的Tα1虽然已经临床应用,但价格昂贵,在合成过程中污染环境.当前临床用药以合成法生产的胸腺五肽和Tα1为主[7].通过查询中国食品药品监督管理局(CFDA)官网,采用基因工程技术生产的重组人胸腺肽α1(rh Tα1)暂未有获批产品.有关基因工程技术表达纯化的rh Tα1暂时还停留在实验室水平,发酵规模从摇瓶至20 L发酵罐不等[8-9].本文采用基因工程技术,构建高效表达rh Tα1的表达菌株,在中试规模下,发酵表达并分离纯化,获得高纯度、高活性的rh Tα1,为工业化规模生产打下基础.
1 材料和方法
1.1材 料
大肠杆菌(Escherichia coli)基因工程菌株TOP10/p Thio His A-Tα1由本实验室构建并保存;酵母提取物和蛋白胨为Oxoid公司产品,丙烯酰胺为Promega公司产品;Chelating Sepharose Fast Flow (CS)、Q Sepharose Fast Flow(QFF)、SOURCE 30RPC及Sephadex G-25 Medium(G-25)填料为GE公司产品;Tα1标准品(日达仙)购自SciClone公司;其他试剂均为国产分析纯.
主要仪器:30和300 L全自动发酵罐,B.Braun Biotech公司;全温振荡器,哈尔滨东明医疗器械厂;离心机,Beckman公司;P2B005A01超滤膜,Millipore公司;Basic 100蛋白纯化仪,GE公司;基质辅助激光解吸电离/飞行时间质谱仪(MALDI-TOF MS), Bruker公司;N端蛋白序列分析仪,日本岛津公司.
1.2方 法
1.2.1rhTα1融合蛋白的发酵表达
取工程菌株TOP10/p Thio His A-Tα1,按1∶400(体积比,下同)接种至150 m L LB培养基,于1 L三角瓶中,37℃,200~250 r/min培养6~8 h为一级种;一级种子按1∶200接种至24 L LB培养基,于30 L种子罐中,37℃,200~250 r/min培养6~8 h为二级种.
二级种按1∶6接种到含150 L LB培养基的D300发酵罐中,37℃,溶氧量(DO)30%~60%(体积分数)培养;待菌液在600 nm下吸光度(OD600)达到3.0,将1.5 L含1 mmol/L异丙基-β-D-硫代吡喃半乳糖苷(IPTG)的氮源(10%酵母粉+20%蛋白胨,质量分数)补料液以750 m L/h的流速补进发酵罐中诱导表达,过程中补加碳源(50%葡萄糖,质量分数)或2 mol/L NaOH以维持p H 7.0,诱导总时长约7 h.
1.2.2菌体收集和破碎
发酵完毕,离心收集菌体,菌体用p H 8.0的含20 mmol/L NaCl的50 mmol/L Tris-HCl缓冲液重悬后采用35 MPa高压破碎2次;再用高速冷冻离心机以10℃,10 000 r/min离心40 min,获得上清液.
1.2.3rhTα1融合蛋白的捕获初步纯化
离心上清液,上样CS层析柱,采用p H 8.0的含20 mmol/L NaCl的50 mmol/L Tris-HCl缓冲液和p H 8.0的含20 mmol/L NaCl和50 mmol/L咪唑的50 mmol/L Tris-HCl缓冲液,以线性梯度方式洗脱目的蛋白,按峰收集目的样.
1.2.4rhTα1融合蛋白的酶解
亲和层析捕获的rh Tα1融合蛋白,用截留分子质量为5 ku的超滤膜(0.1 m2)浓缩,通过超滤将溶液替换成p H 8.0的含1 mmol/L CaCl2的50 mmol/L Tris-HCl缓冲体系,收集样品,并调节质量浓度至1 mg/m L;按摩尔比为1∶30(酶∶底物)的比例,加入肠激酶(EK)并混匀,4~8℃酶切16 h.
1.2.5rh Tα1的分离纯化
取EK酶切后的样品,首先通过CS层析柱初步纯化,上样至预先用p H 8.0的含20 mmol/L NaCl的50 mmol/L Tris-HCl缓冲液平衡的CS柱,根据214 nm的紫外检测谱图收集样品.进一步应用QFF层析柱纯化,将CS柱穿透样上样至预先用p H 8.0的含20 mmol/L NaCl的50 mmol/L Tris-HCl缓冲液平衡的QFF层析柱,用p H 8.0的含250 mmol/L NaCl 的50 mmol/L Tris-HCl缓冲液洗脱目的多肽.然后将经QFF柱纯化后的目的多肽通过SOURCE 30RPC层析柱进行精细纯化,用流动相0.07%(体积分数,下同)三氟乙酸、2.0%乙腈和流动相0.07%三氟乙酸、80.0%乙腈梯度洗脱,按峰收集目的多肽.再用QFF层析柱纯化,采用p H 8.0的含400 mmol/L NaCl的50 mmol/L Tris-HCl缓冲液洗脱目的样品,收集获得rh Tα1.最后,精细分离纯化后的样品以不高于20%柱床体积上样至G-25分子筛,用p H 7.0的10 mmol/L磷酸钠缓冲液洗脱,收集目的样;0.22μm过滤膜过滤除菌,分装即得rh Tα1原液,-65℃以下冻存.
1.2.6rhTα1的纯度检测和理化性质鉴定
参考脱E受体法[10]测定Tα1活性,显微镜下计数不少于200个淋巴细胞的玫瑰花环,计算玫瑰花环形成率.rh Tα1融合蛋白发酵菌体诱导表达、菌体破碎及CS柱捕获情况采用甘氨酸-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(glycine-SDS-PAGE)检测;rh Tα1的纯度鉴定采用三甲基甘氨酸(tricine)-SDS-PAGE及高效液相色谱-排阻法(HPLC-SEC)分析检测. Tricine-SDS-PAGE电泳的积层胶浓度为5%(质量分数,下同),间隙胶浓度10%,分离胶浓度16%;上样量20μg,电压80~160 V,考马斯亮蓝G250染色.用于HPLC-SEC分析的样品稀释至0.2 mg/m L,取50μL上样(10μg),按面积归一化法[11]计算其纯度.
1.2.7rhTα1的氨基酸序列分析及分子质量质谱鉴定
采用Edman降解法[12]检测rh Tα1的N末端15个氨基酸序列,检测分析委托中国医学科学院基础医学研究所中国协和医科大学基础医学院中心实验室进行,仪器为PE/ABI PROCISE 491测序仪,检测程序为PL-PVDF-protein.
采用Bruker公司REFLEXTMⅢ型MALDI-TOF MS测定rh Tα1分子质量;基质为α-氰基-4-羟基肉桂酸(HCCA).
2 结果与分析
2.1rhTα1融合蛋白的发酵表达
不同诱导时间的发酵液进行取样,扫描后取相同OD600的菌体,高温破碎,15% glycine-SDS-PAGE检测,结果见图1(a).rh Tα1融合蛋白表观分子质量约为19ku,随着诱导时间的延长,目的产物逐渐增加,诱导4 h后表达稳定,随着时间的延长可获得更多生物量的积累.利用软件Smart View2001分析计算得到细胞裂解蛋白中融合蛋白所占比例为40%(质量分数).300 L发酵罐最终可获得发酵液约190 L,离心可获得3.3 kg菌体.
2.2菌体破碎
菌体破碎后进行glycine-SDS-PAGE电泳检测,结果见图1(b).在高压破碎的离心沉淀(泳道7,菌体高压破碎的离心沉淀重悬后进行煮沸裂解)中无目标蛋白检出,而破碎后上清(泳道8)中含有rh Tα1融合蛋白,证明细胞破碎完全,破碎条件合适.
2.3rhTα1融合蛋白的捕获初步纯化
通过基因工程设计与构建,发酵表达的rh Tα1融合蛋白N末端带有6个组氨酸(His),可特异地与CS层析填料结合,基于这个原理,采用CS层析填料来捕获rh Tα1融合蛋白,并与其他蛋白或杂质分离.含有rh Tα1融合蛋白的破碎上清通过CS层析柱后,rh Tα1融合蛋白特异地结合到层析柱上,而其他蛋白或杂质则穿透或被冲洗去除,然后通过洗脱液洗脱获得高纯度的rh Tα1融合蛋白.
电泳检测结果见图1(b),从中可看出:CS柱穿透样(泳道9)及层析柱清洗样(泳道3)均为杂质;目的洗脱样(泳道10)为高纯度的rh Tα1融合蛋白.纯化洗脱谱图见图2(a),结果显示在该纯化条件下,采用CS层析柱捕获分离效果良好,可获得高纯度的rh Tα1融合蛋白.3.3 kg菌体破碎并经亲和层析捕获后可获得融合蛋白约33 g,由此推算每升发酵液可获得目的蛋白173 mg,产量基本满足工业化规模生产.

图1 rh Tα1融合蛋白发酵菌体诱导表达、菌体破碎及CS柱捕获的glycine-SDS-PAGE检测Fig.1 Glycine-SDS-PAGE analyses of induced expression, bacteria crushing of rh Tα1 fermentation strain and CS column capture of the rh Tα1 fusion protein

图2 rh Tα1的分离纯化层析谱图Fig.2 Chromatographic spectra for isolation and purification of rh Tα1
2.4rhTα1融合蛋白的酶切
通过基因工程设计,表达的rh Tα1融合蛋白N末端的6个His纯化标签通过EK酶切识别氨基酸序列与rh Tα1连接,因此采用EK酶切rh Tα1融合蛋白以获得rh Tα1.
EK酶切的rh Tα1融合蛋白tricine-SDS-PAGE检测图谱见图3(a),由泳道1和泳道3可见,4~8℃酶切16 h后融合蛋白酶切效率达85%以上.
2.5rhTα1的纯化
2.5.1rh Tα1的初步分离纯化
rh Tα1融合蛋白经EK酶切后,目的蛋白rh Tα1 与His纯化标签断裂分开,因此采用CS层析柱结合His纯化标签,则穿透样为rh Tα1.由于穿透样品浓度低且体积大,不利于进行后续纯化处理,因此采用QFF层析柱浓缩CS层析柱穿透样品.因Tα1一级结构中无含苯环的氨基酸,280 nm检测收集样品不灵敏,故改用214 nm.
CS及QFF层析柱纯化洗脱谱图分别见图2(b) 和(c),电泳检测图谱见图3(a).由图可见:CS层析柱的穿透样表观分子质量大于2.5 ku,为rh Tα1;经QFF层析柱浓缩后,无明显杂质.
2.5.2rh Tα1的精细分离纯化
为了获得高纯度的rh Tα1,进一步采用反相分离技术分离去除rh Tα1的相关蛋白或杂质后,再用QFF层析柱去除有机溶剂和浓缩目的样品.纯化洗脱谱图见图2(d)和(e),电泳检测图谱见图3(b),由图可见精细纯化后再浓缩可获得高纯度的rh Tα1.
2.5.3rhTα1的原液制备
QFF层析柱精细纯化后的rh Tα1用G-25分子筛脱盐替换为p H 7.0的10 mmol/L磷酸钠缓冲液,收集目的样,其洗脱谱图见图2(f).由图可见,目的样品峰与电导率(cond)峰分离效果良好,脱盐充分.G-25层析柱收集到的样品用0.22μm过滤膜过滤除菌,分装即得rh Tα1原液,-65℃以下冻存.
2.6rhTα1原液的活性、纯度检测及理化性质鉴定
2.6.1rhTα1原液活性检测
胸腺肽可使脱E受体后的胸腺T细胞恢复其E受体功能,从而反映胸腺肽的生物活性.参考脱E受体法[10]测定玫瑰花环增加率反映Tα1活性,结果见表1.自制rh Tα1的玫瑰花环增加率为50.0%,市售化学合成Tα1标准品(日达仙)的玫瑰花环增加率为53.3%,相比空白均有明显提高;自制样品花环增加率为标准品的95.5%,表明两者活性相当.

图3 rh Tα1分离纯化样品的tricine-SDS-PAGE检测Fig.3 Tricine-SDS-PAGE analyses of isolation and purification of rh Tα1

表1 rh Tα1活性检测Tab.1 Activety assay of rh Tα1 %
2.6.2rhTα1纯度检测
采用tricine-SDS-PAGE检测rh Tα1的纯度,结果如图4所示.以市售Tα1标准品作为参照,分别控制上样量5%,2%,1%(质量分数),电泳结果表明:原液样品中无可见杂蛋白,样品的电泳纯度大于99%.
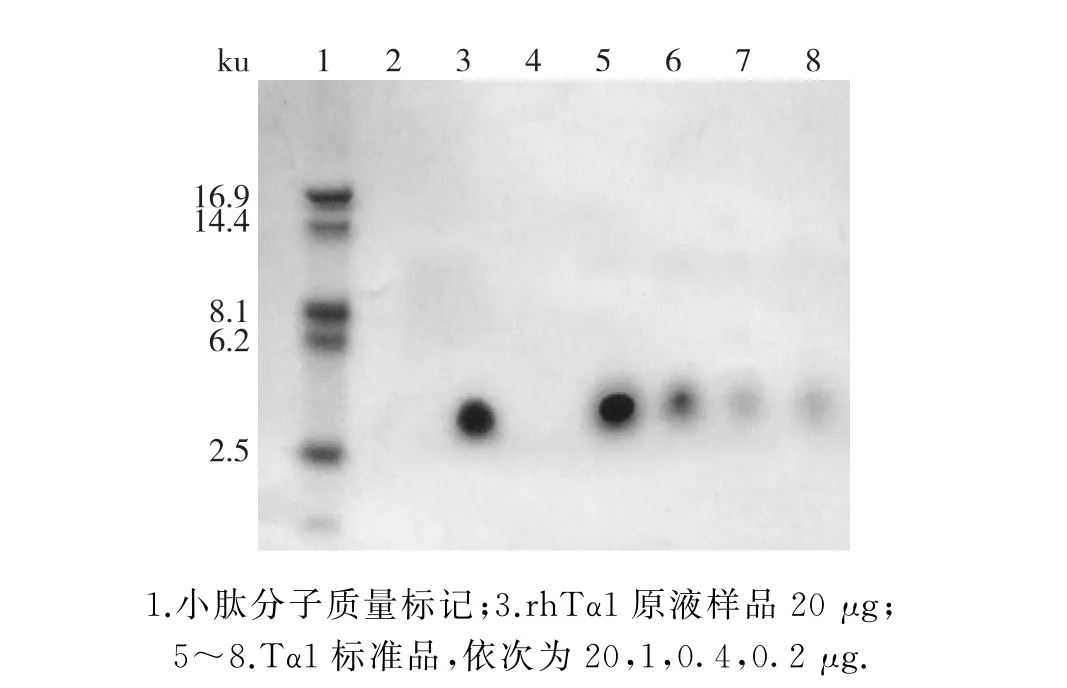
图4 rh Tα1原液样品的tricine-SDS-PAGE检测Fig.4 Tricine-SDS-PAGE analysis of purity of rh Tα1 product sample
采用HPLC-SEC进行样品的关键纯度检测(图5),结果显示检测样品中rh Tα1的峰面积占总面积的99.84%,表明有关杂质远小于5%的注册标准[13].
2.6.3rh Tα1鉴定
N端序列测定是蛋白质及多肽一级结构确认的重要组成部分,也是重组蛋白药物质量控制的必检项目.经测定rh Tα1样品N端15个氨基酸序列为SDAAVDTSSEITTKD,与已知的rh Tα1 N端氨基酸序列一致.此外,用MALDI-TOF MS测定分子质量,结果显示原液样品rh Tα1分子质量为3 066.59 u(图6),大小与去乙酰化的Tα1理论分子质量(3 066 u)一致.
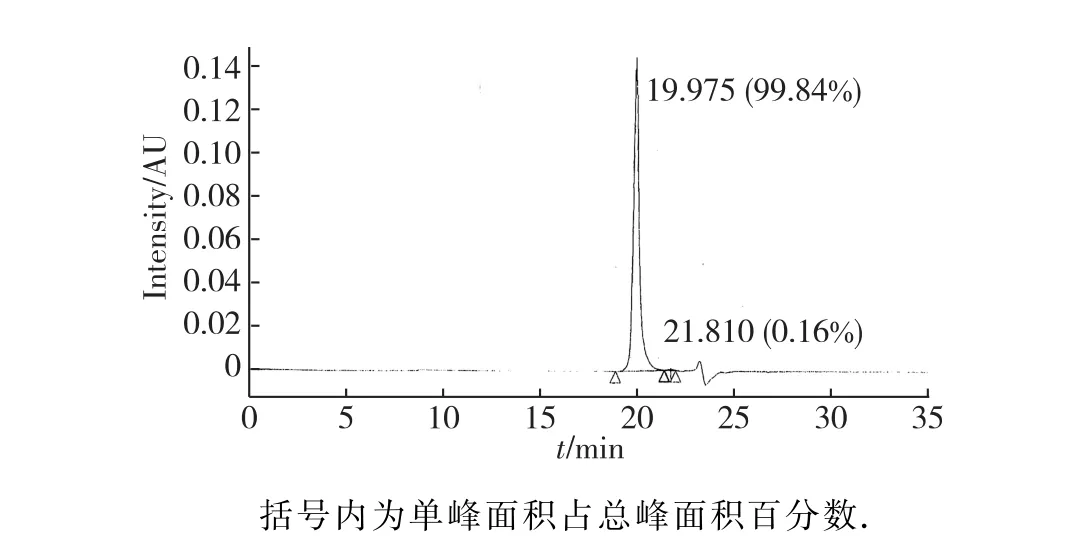
图5 rh Tα1原液样品的HPLC-SEC检测图Fig.5 HPLC-SEC analysis of purity of rh Tα1 product sample
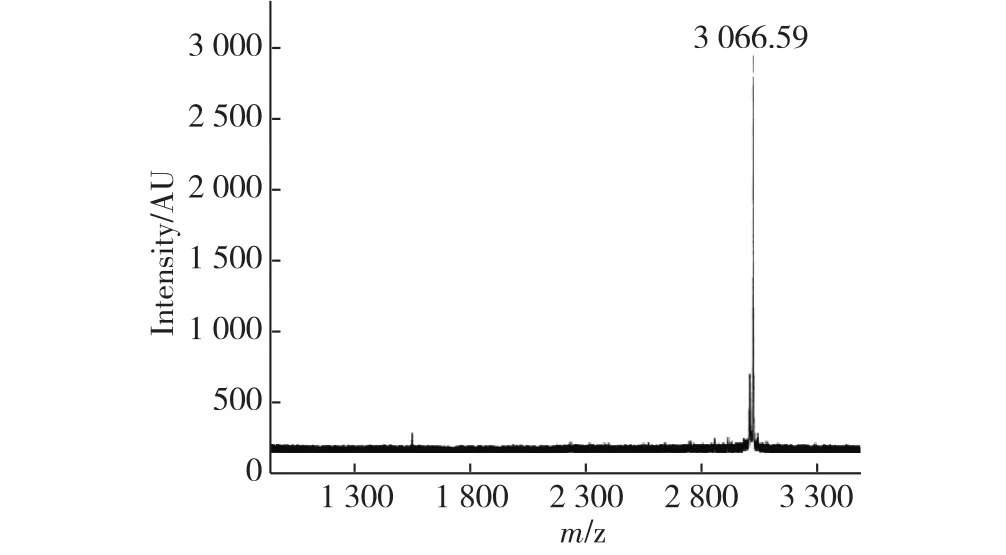
图6 MALDI-TOF MS测定rh Tα1分子质量Fig.6 Identification of molecular weight of rh Tα1 by MALDI-TOF MS
3 讨 论
目前常用的制备低分子质量多肽的基因工程重组技术有2种:1)通过串联多个目标基因来获得高表达,虽然该方法已有较多成功例子,但是本实验室尝试使用4段或2段多肽串联表达,结果均未成功获得目的蛋白,因此放弃该方法;2)通过融合表达,其优点是融合蛋白携带纯化标签,可通过亲和层析高效获得高纯度的目的蛋白,大大简化了下游纯化工作,因此本实验室采用第2种方法制备rh Tα1.
本方法主要分为3个阶段:1)采用CS亲和层析捕获带有纯化标签的目标蛋白,快速与细胞破碎后释放的酶、核酸、菌体蛋白、内毒素以及色素分离,有利于融合蛋白的稳定;2)EK酶切后的蛋白首先用CS亲和层析纯化,存在于酶解混合物中的硫氧还蛋白以及少量未被酶解的融合蛋白,由于分子中仍存在His标签序列被吸附于CS柱上,而酶解释放出来的游离rh Tα1则出现在穿透样中;3)将穿透目标样品用QFF柱浓缩后,再经RPC反相层析进行精细纯化,用QFF柱再次浓缩后替换缓冲体系,即为rh Tα1纯品.
样品的活性检测、纯度分析及鉴定:参考脱E受体法测定活性,与市售标准品(日达仙)活性相当;用MALDI-TOF MS检测rh Tα1分子质量为3 066.59 u,与去乙酰化的Tα1理论分子质量相符; rh Tα1样品N端15个氨基酸序列为SDAAVDTSSEITTKD,鉴定结果与已知Tα1的N端氨基酸序列一致;SDS-PAGE检测结果表明rh Tα1纯度超过99%;HPLC-SEC检测纯度达99.84%,远小于5%的注册标准.
相关报道采用基因工程重组技术得到N端未乙酰化的Tα1,其全部化学性质和体外生物活性与化学合成的Tα1及天然的Tα1相一致[14],本实验室结论与其一致.用该方法生产Tα1比用化学合成生产的成本大为降低;与生化提取方法相比,又具有操作简单、易于放大、工艺取材不受限制以及活性高等优点.本研究方法可获得高纯度的rh Tα1,为其工业化生产提供了可靠的技术支持.
参考文献:
[1] SUGAHARA S,ICHIDA T,YAMAGIWA S,et al.Thymosin-alpha1 increases intrahepatic NKT cells and CTLs in patients with chronic hepatitis B[J].Hepatol Research, 2002,24(4):346-354.
[2] SARUC M,YUCEYAR H,KUCUK M N,et al.Combination thymosin-alpha 1 and interferon-alpha 2b in the treatment of anti-HBe-positive chronic hepatitis B in Turkey[J].Hepatogastroenterology,2002,49(45):798-802.
[3] SARUC M,OZDEN N,TURKEL N,et al.Long-term outcomes of thymosin-alpha 1 and interferon-alpha 2b combination therapy in patients with hepatitis Be antigen (HBe Ag)negative chronic hepatitis B[J].Journal ofPharmaceutical Sciences,2003,92(7):1386-1395.
[4] GARACI E.Sequential chemo immunotherapy for advanced non-small cell lung cancer using cisplatin,etoposide,thymosin alpha l and interferon-alpha 2a[J].Europen Journal of Cancer 31A,1995,31:2403-2405.
[5] SCHULOF S R.An evaluation of two different schedules of synthetic thymosinα1 administration in patients with lung cancer[J].Preliminary Results,1960,6:601-613.
[6] GOLDSTEIN A L,LOW T L K,MC DOO M,et al.Thymosin-alpha 1:isolation and sequence analysis of an immunologically active thymic polypeptide[J].Proceeding of the National Academy of Science of the United States of America,1977,74:725-729.
[7] 王孟军.胸腺素类免疫调节剂研发现状分析[J].中国新药杂志,2014,23(20):2344-2348.
[8] 刘中禄,陶翠兰,莘旭妮,等.重组胸腺素α1 p MAL-C2x-Tα1/TB1工程菌的构建与表达[J].中国比较医学杂志, 2012,22(7):13-16.
[9] 熊燕燕,汤斌.胸腺肽α1在毕赤酵母中的表达及纯化[J].安徽工程大学学报,2013,28(2):4-6.
[10] 国家食品药品监督管理局.胸腺肽溶液质量标准:WS1-XG 042-2000-2003[J].中国药品标准,2003,4(6): 17-18.
[11] 国家药典委员会.中国药典:一部附录VID高效液相色谱法[M].2010版.北京:中国医药科技出版社,2010.
[12] KAMP R M,CHOLI-PAPADOPOULOU T.蛋白质结构分析:制备、鉴定与微量测序[M].施蕴渝,陈常庆,译.北京:科学出版社,2000:105-112.
[13] 王军志.生物技术药物研究开发和质量控制[M].北京:科学出版社,2007:661-663.
[14] RONALD W,HERBERT L.Production of biologically active Nα-desacetyl thymosin α1 in Escherichia coli through expression of a chemically sythesized gene[J]. Biochemistry,1980,19:6096-6104.
Expression,Purification and Identification of Recombinant Human Thymosin-alpha 1 in Escherichia coli
YIN Fenghong1,2,XIAO Qingjiang2,ZHOU Weidong2,CHEN Qingxi1*
(1.School of Life Science,Xiamen University,Xiamen 361102,China; 2.Amoytop Biotechnique Company of Xiamen,Xiamen 361022,China)
Abstract:In the present study,expression,purification and identification of recombinant human thymosin-alpha 1(rh Tα1)in Escherichia coli were reported.Firstly,bacteria expressing the rh Tα1 fusion protein were utilized in the 300 L fermentator,and protein was induced by IPTG.Then,bacteria were harvested by centrifugation,and cell lysate was obtained using high pressure crushes.The crude protein was purified using the affinity chromatograghy,and the yield of the fusion protein was up to 170 mg per 1 L culture. Furthermore,the crude protein was processed by enterokinase(EK)proteolysis,affinity chromatography,reversed phase chromatography and exclusion chromatography to obtain the high purity of rh Tα1.SDS-PAGE and HPLC-RPC analysis indicated that rh Tα1 could reach the purity of more than 99%.Additionally,rosette formation assay demonstrated that the activity of rh Tα1 was quite similar to that of the commercial standard product.Molecular weight of rh Tα1 by MALDI-TOF MS was 3 066.59 u,which agreed with the theoretic result(3 066 u),and the analysis of N-terminal of rh Tα1 showed an accordance with the theoretic data,which all implied a potential for the industrialization of rh Tα1.
Key words:recombinant human thymosin-alpha 1(rh Tα1);expression;purification
*通信作者:chenqx@xmu.edu.cn
基金项目:国家高技术研究发展计划(863)项目(2007AA021604)
收稿日期:2015-03-30 录用日期:2015-05-07
doi:10.6043/j.issn.0438-0479.2016.02.008
中图分类号:Q 356.1
文献标志码:A
文章编号:0438-0479(2016)02-0192-06
引文格式:尹凤红,肖清江,周卫东,等.重组人胸腺肽α1在大肠杆菌中的表达纯化与鉴定[J].厦门大学学报(自然科学版), 2016,55(2):192-197.
Citation:YIN F H,XIAO Q J,ZHOU W D,et al.Expression,purification and identification of recombinant human thymosinalpha 1 in Escherichia coli[J].Journal of Xiamen University(Natural Science),2016,55(2):192-197.(in Chinese)
