红枣贮藏期间主要病原真菌的分离、鉴定与ITS序列分析
2016-04-11郝莉花董彩文陈春生纵伟
郝莉花++董彩文+++陈春生++纵伟

摘要:为了解红枣贮藏期间主要病原真菌的污染情况,首先对红枣表面的真菌进行分离,然后经过形态观察,并结合 ITS 序列扩增、测序和序列比对,对分离的相关病原菌进行鉴定。结果显示,有8种真菌菌系在红枣表面上出现。其中,链格孢菌(Alternaria spp.)和青霉(Penicillium spp.) 是主要的菌株,而链孢霉属(Neurospora spp.)、纸葡萄穗霉(Stachybotrys chartarum)是在红枣贮藏期间新发现的2种真菌。本研究结果为控制红枣采后病害提供了依据。
关键词:红枣;贮藏期;病原真菌;ITS 序列分析
中图分类号: TS207.4文献标志码: A文章编号:1002-1302(2016)02-0304-04
收稿日期:2015-02-14
基金项目:国家质检总局科技项目(编号:2013QK232)。
作者简介:郝莉花(1979—),女,硕士,工程师,从事食品安全检测工作。E-mail:zzulispx@126.com。枣属于鼠李科枣属植物。枣树品种多、适应性强,其果实具有丰富的营养,受到消费者的青睐,但鲜枣在自然条件下不耐贮藏。目前,由于对贮藏期间枣中病原菌种类及侵染原因缺乏了解,不能采取有效的控制措施,导致病害现象时有发生,因真菌病害侵染而导致的腐烂率达到30%以上,引起红枣品质变差,难以食用,造成严重的损失[1-4]。因此,研究引起红枣病害的病原菌,从而控制其采后病害,具有重要的意义。近年来,已有研究从贮藏的红枣鲜果中分离并采用形态学的方法鉴定出贮藏过程中引起腐烂病害的一些主要病原真菌[5-8],但采用ITS序列分析红枣表面真菌的研究还少见报道。因此,本研究对红枣表面的真菌进行分离,通过 ITS 序列扩增、测序和序列比对,对分离的相关病原菌进行鉴定。为针对性地采取措施对致腐病原菌进行控制提供依据[9-10]。
1材料与方法
1.1材料与仪器
1.1.1材料干红枣产自河南省新郑市,放在无菌样品袋中,室温放置1个月。Taq 酶和dNTP购于TaKaRa 公司。真菌DNA提取试剂盒购于Omega 公司。
1.1.2培养基孟加拉红培养基(蛋白胨 5 g/L、 葡萄糖10 g/L、 磷酸二氢钾 1 g/L、 MgSO4·7H2O 0.5 g/L、 孟加拉红 0.033 g/L、 氯霉素 0.1 g/L、 琼脂 20 g/L),用蒸馏水溶解以上成分,然后及时加入孟加拉红溶液。氯霉素先用少量乙醇溶解后再加入到培养基中,121 ℃灭菌20 min。
马铃薯蔗糖琼脂培养基(PDA):先称取200 g马铃薯,洗净去皮切成小块,加水1 000 mL 煮沸30 min,纱布过滤后再加 2% 葡萄糖和 2%琼脂,121 ℃灭菌15 min。
1.1.2实验仪器PCR 仪产自德国 Eppendorf 公司,电泳仪和电泳槽产自北京六一生物科技有限公司,微量移液器产自德国Eppendorf 公司,洁净工作台产自江苏苏净集团有限公司,立式自动电热压力蒸汽灭菌器产自合肥华泰医疗设备有限公司,恒温培养箱产自上海鸿都电子科技有限公司。
1.2试验方法
1.2.1干枣贮藏期间病原菌的分离、纯化分别从3批样品袋中各随机选取20颗干枣。将每个干枣放入盛有100 mL无菌水的250 mL三角瓶中,置摇床上振荡30 min。从每瓶混合液中取 1 mL溶液加入灭菌平皿中,倒入适量的孟加拉红培养基混匀制成平板,每瓶混合液做3个平行平板,凝固后的平板置于28 ℃培养箱中培养,隔天进行观察。当培养出的菌落直径达到约1 cm 时,用接种针挑取少量菌丝接入另一个含PDA培养基的培养皿内进行培养;重复以上操作2~3次后可以得到纯化的菌种,保存备用。
1.2.2病原真菌总 DNA 的提取将试验菌株的菌丝接种到 PDA 液体培养基中,28 ℃、200 r/min 振荡培养2 d。过滤收集菌丝体,经过洗涤和干燥倒入液氮进行研磨,将匀浆液吸到1.5 mL 灭菌离心管中,按照试剂盒的操作步骤进行基因组 DNA的提取,0.8%琼脂糖凝胶电泳法检测 DNA。提取的DNA定量后稀释,作为PCR 反应的模板。
1.2.3rDNA-ITS 序列的扩增真菌ITS 区扩增通用引物为ITS-5 (5′-GGAAGTAAAAGTCGTAACAAGG-3′)和ITS-4 (5′-TCCTCCGCTTATTGATATGC-3′)。PCR 反应体系为50 μL(10×缓冲液 5 μL),dNTP (2.5 mmol/L) 2 μL,引物(10 μmol/L)各 2 μL,Taq DNA 聚合酶(5 U/μL)0.4 μL,用无菌水补足至总体积50 μL。PCR 反应程序为:95 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸 1 min,35 个循环;72 ℃延伸10 min。反应结束后取 5 μL PCR 产物加 1 μL 6×上样缓冲液,在2%琼脂糖凝胶上 120 V 电泳 35 min,用凝胶成像仪进行拍照。引物合成、PCR 产物纯化及测序由生工生物工程(上海)股份有限公司完成。
1.2.4主要病原真菌的形态显微镜观察真菌形态。
1.2.5序列比对和系统发育树的构建将测序结果输入NCBI 基因数据库,进行同源序列搜索,比较未知菌株与已知菌株相应序列的同源性。同时,提取相关菌株的ITS 区基因序列,与试验菌株序列一起用Clustal X 软件进行排列,用MEGA 6.0 软件按照相关参数和模型构建进化树。
2结果与分析
2.1菌株的分离纯化
干枣表面分离的病原菌样品在PDA 培养基中28 ℃培养4 d后生成的菌落,在颜色大小和菌落形态特征上都存在差异。28 ℃培养条件下XZJ2、XZJ3、XZJ4、XZJ7、XZJ10菌株在PDA 培养基上生长较好,在5 d内大量生长,可以看到较为密集的菌丝薄层,其中XZJ3和XZJ7开始分泌色素。而XZJ9在PDA 培养基上生长缓慢,5 d内仍然没有大量生长(图1)。
2.2基因组DNA 的提取
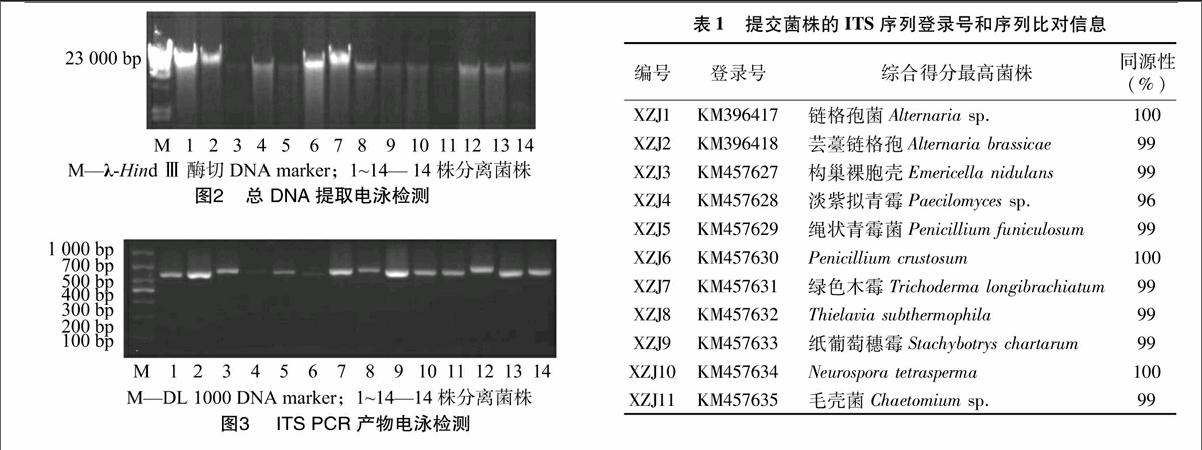
采用试剂盒提取真菌基因组DNA,经琼脂糖凝胶电泳分析(图2)。
利用DNA 试剂盒提取的真菌基因组DNA 条带比较清晰,能够用于下一步的PCR。
2.3rDNA-ITS PCR 扩增
以ITS5、ITS4 为引物,经PCR 得到的产物条带特异性好,约600 bp (图3)。
2.4红枣贮藏期真菌菌系
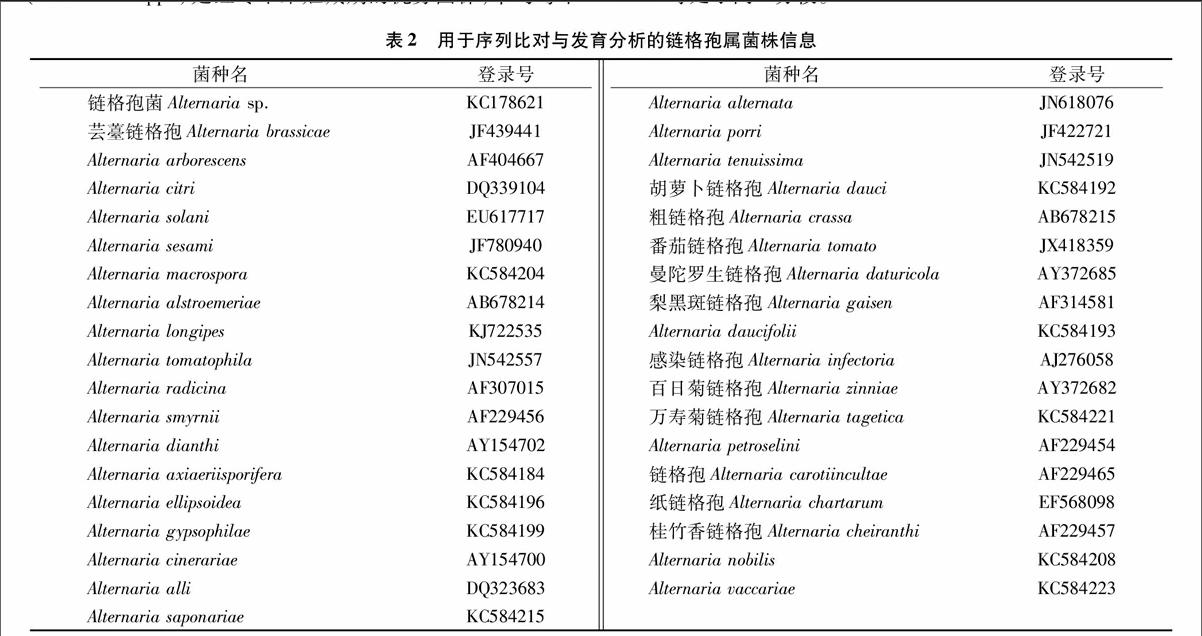
将扩增的各个分离菌株的ITS PCR产物送上海生工生物技术有限公司进行纯化和测序,得到的序列与GenBank 上的已知序列进行比对(表1)。试验结果表明,在红枣干果表面出现的真菌菌系主要有链格孢菌(Alternariaspp.)、青霉(Penicillium spp.)、木霉菌(Trichoderma spp.) 链孢霉属(Neurospora spp.)、毛壳属(Chaetomium spp.)、棱孢壳属(Thielavia spp.)。其中,链格孢菌(Alternaria spp.)和青霉(Penicillium spp.)是红枣干果贮藏期的优势菌株,平均每个
红枣表面上检出的菌落数分别是22、1.5个。
2.5ITS 区rDNA 同源性比对与系统发育分析
由于链格孢菌是主要的优势菌株,将分离得到的菌株XZJ1 和XZJ2 的ITS 区 rDNA 基因部分序列与NCBI 基因数据库内登录的已知菌株(表2)的相应序列进行比对,序列通过Clustal X 软件进行排列,然后利用MEGA 6.0 软件以NJ 法构建系统发育树(Bootstraps=1 000)(图4)。从链格孢菌的系统发育分析结果可以看出菌株XZJ1 和XZJ2 与Alternaria sp.、Alternaria brassicae、Alternaria alternata、Alternaria tenuissima 等处于同一分枝。
3结论
通过形态学并结合rDNA ITS 序列分析,从干枣中分离出7种真菌,分别是链格孢菌(Alternaria spp.)、青霉(Penicillium spp.)、木霉菌(Trichoderma spp.) 链孢霉属(Neurospora spp.)、毛壳属(Chaetomium spp.)、棱孢壳属(Thielavia spp.)、纸葡萄穗霉(Stachybotrys chartarum)、构巢裸孢壳(Emericella nidulans)。其中,链格孢菌(Alternaria spp.)和青霉(Penicillium spp.)是红枣干果贮藏期的优势病原菌,也是引起红枣鲜果病害的主要病原菌。同时,通过构建链格孢菌的系统进化树,发现本研究鉴定出的2个菌株XZJ1 和XZJ2 与Alternaria sp.、Alternaria brassicae、Alternaria alternata、Alternaria tenuissima 处于同一分枝,而这些链格孢菌菌株也在别的品种的红枣中发现[1,5,7-8,11-13]。除已经报道的真菌以外,本研究从红枣中还鉴定出2种新的真菌,即链孢霉属(Neurospora spp.)和纸葡萄穗霉(Stachybotrys chartarum), 这在以
前的红枣贮藏期真菌研究中未见报道。关于这2种真菌的作用还需进一步研究。同时,根据已经鉴定的引起红枣病害的真菌种类,对它们的ITS 序列进行比对、分析,从而设计特异性引物,对不同的病原菌种类进行PCR鉴定,从而建立红枣病原菌的快速检测方法[14-15]。
参考文献:
[1]甘瑾,唐文林,潘禄,等. 灵武长枣采后病原菌的分离及天然抗菌物质的筛选[J]. 西北农林科技大学学报:自然科学版,2007,35(10):81-86.
[2]刘炳仁. 冬枣高效栽培技术[M]. 北京:科学技术文献出版社,2007.
[3]王绪芬. 提高冬枣产量和品质的关键技术[J]. 北方园艺,2008(9):91-92.
[4]刁小琴,张有林,关海宁. 冬枣采后病害及其防治技术[J]. 中国果树,2006(1):42-45.
[5]沙月霞,邢敏,唐文林,等. 红枣贮藏期病原菌系的多样性[J]. 西北农业学报,2009,18(2):287-292.
[6]吴兴梅,孙蕾,刘元铅,等. 冬枣贮藏期主要病害的研究[J]. 经济林研究,2003,21(2):19-22.
[7]任玉锋,马爱瑛,刘雅琴,等. 灵武长枣采后主要病原真菌的鉴定[J]. Food Researchs & sdevelopment,2012,3(9):128-130.
[8]夏宏,夏青,王春生,等. 鲜枣贮藏期致腐病原菌种类研究[J]. 中国生态农业学报,2007,15(3):117-119.
[9]Ippolito A,Nigro F. Impact of preharvest application of biological control agents on postharvest diseases of fresh fruit and vegetables [J]. Crop Protection,2000,19:715-723.
[10]Janisiewicz W J,Tworkoski T J,Sharer C. Characterizing the mechanism of biological control of postharvest diseases on fruit with a simple method to study competition for nutrients [J]. Phytopathology,2000,90(11):1196-1200.
[11]刘万臣,关文强,刘兴华,等. 3种鲜枣贮藏期致病真菌的检测及定性研究[J]. 食品科技,2007(8):237-240.
[12]田蕴慧,薛梦林,赵国柱,等. 冬枣贮藏期病害病原菌的鉴定[J]. 果树学报,2010,27(3):422-426.
[13]李静琴,陈亮,岳贵龙,等. 冬枣储藏期致腐真菌分离鉴定及广谱拮抗菌株的筛选[J]. 河南工业大学学报:自然科学版,2013,34(2):62-66.
[14]Suanthie Y,Cousin M A,Woloshuk C P. Multiplex real-time PCR for detection and quantification of mycotoxigenic Aspergillus,Penicillium and Fusarium[J]. Journal of Stored Products Research,2009,45(2):139-145.
[15] Pedersen LH,Skouboe P,Boysen M,et al. Detection of Penicillium species in complex food samples using the polymerase chain reaction[J]. International Journal of Food Microbiology,1997,35(2):169-177.张瑶,蒙丽君,官菊芳,等. 基于生物条形码信号放大的电化学方法检测hIgG[J]. 江苏农业科学,2016,44(2):308-311.
