无血清微载体培养Vero细胞增殖传染性法氏囊病毒
2016-04-11吴培培冯磊唐应华褚轩王伟峰
吴培培++冯磊++唐应华++褚轩+王伟峰+侯继波
摘要:为了获得用生物反应器无血清培养基微载体悬浮培养Vero细胞增殖传染性法氏囊病毒(infectious bursal disease virus,IBDV)的工艺参数,通过驯化Vero细胞适应无血清微载体悬浮培养后,再优化传染性法氏囊病毒在此细胞上的增殖工艺参数,包括初始细胞密度、微载体浓度、IBDV的感染复数(MOI)、接种时间和病毒收获时间。结果表明:获得适应无血清培养的细胞株——V0株,建立细胞库。获得3 L反应器中培养V0细胞增殖IBDV工艺参数,其初始接种密度为3×105 cell/mL、微载体浓度为3 g/L、细胞培养1 d后按MOI为0.2接种IBDV,接毒后120 h收获病毒,可达最高病毒效价109.307 TCID50/mL。本研究获得的Vero细胞、IBDV以及各项工艺参数为后续大规模悬浮培养制备法氏囊疫苗提供了生物材料和技术支持。
关键词:无血清培养;Vero细胞;传染性法氏囊病毒(IBDV);微载体;生物反应器;增殖工艺
中图分类号: S858.31文献标志码: A文章编号:1002-1302(2016)02-0244-03
收稿日期:2015-02-03
基金项目:江苏省农业科技自主创新资金[编号:CX(15)5045]。
作者简介:吴培培(1982—),女,江苏南通人,硕士,助理研究员,从事兽用生物制品工程技术研究。 Tel:(025)84392018;E-mail:wupeipei2015@163.com。
通信作者:侯继波,男,山东德州人,博士,研究员,从事兽用生物制品工程技术研究。E-mail:houjibo@jaas.ac.cn。鸡传染性法氏囊病(infectious bursal disease,IBD),是由传染性法氏囊病毒(IBDV)引起的鸡的一种高度接触性传染病[1]。1980年以后该病传入我国并大面积暴发和持续流行,严重影响了我国养鸡业的发展,当前对于该病采用接种疫苗进行预防[2]。目前,国内生产IBDV疫苗大部分采用鸡胚成纤维细胞增殖病毒,在培养过程中需添加一定量胎牛血清或小牛血清,以提供细胞生长增殖所必需的各种生长因子。随着动物细胞无血清培养技术的不断进步,无血清培养已成为包括疫苗在内的生物技术药物生产的总趋势[3-4]。当前国内疫苗生产方式延用了传统的实验室滚瓶培养方式,由于每个转瓶的细胞质量、病毒产量和滴度都不同,导致疫苗的批间差很大。随着生物反应器的发展,大规模转瓶培养动物细胞疫苗工艺技术向生物反应器培养动物细胞疫苗工艺技术的转变成为必然[5-6]。本研究对从美国组织细胞标准菌种保藏中心(ATCC)引进的10%小牛血清培养的Vero细胞进行无血清驯化,最终获得无血清培养Vero细胞株;在实验室小规模微载体悬浮培养无血清Vero细胞,并优化IBDV的增殖条件,病毒能够高效增殖且免疫原性好,为后期大规模微载体悬浮培养无血清Vero细胞增殖IBDV提供研究基础。
1材料与方法
1.1细胞和病毒
Vero细胞由国家兽用生物制品工程技术研究中心(简称“中心”)购自ATCC,以10% FCS DMEM传代培养,并建立Vero细胞原始库;IBDV为中心保藏毒种。
1.2试剂与仪器
无血清培养基:不含血清,也不含任何动物来源成分的无血清培养基,购于GIBCO公司,设计用于数种肾脏来源细胞系的生长。笔者所在实验室通过培养基成分优化,添加适量的生长因子使该培养基更加适合细胞生长[7]。
微载体购自GE公司。用无Ca2+、Mg2+离子的磷酸缓冲液清洗并浸泡3 h后,经121 ℃高压蒸汽灭菌25 min,冷却后储于4 ℃密封待用。使用前用37 ℃的细胞培养液清洗2遍。
3 L动物细胞反应器购于荷兰Applikon Biotechnology公司,反应器培养工作体积0.5~2.7 L,具有溶氧(DO)、pH值、温度、转速及四气(N2、O2、CO2及空气) 控制系统。
1.3Vero细胞无血清适应培养[8]
将ATCC引进Vero细胞,采用无血清直接适应法培养。简述如下:Vero细胞在含10% 胎牛血清(FCS)的DMEM中培养至对数生长期,用胰酶消化后,离心,用无血清培养基重悬后计数,按照1×105 cell/mL细胞量,以无血清培养基培养,每天观察细胞形态和细胞活性,及时换液,去除死亡细胞,最终获得无血清培养Vero细胞株V0,并冻存。
1.4细胞接种量和微载体浓度的优化
将驯化后的V0细胞消化后以1×105、3×105、5×105 cell/mL的初始接种密度分别接种到含有1、3、5 g/L微载体中。细胞在3 L反应器中培养,pH值7.0~7.2、DO饱和度50%、搅拌转速60~80 r/min、温度37 ℃。每天取样观察细胞生长状态并计数。采用Nova 400全自动生化分析仪检测细胞培养基中的葡萄糖(Gluc)、谷氨酰胺(Gln)、乳酸(Lac)和铵离子(NH4+)等营养成分及代谢产物的含量,试验结果用OriginPro 8.0软件进行数据分析。
1.5病毒接种量和收获时间的优化
在3 L反应器中,V0细胞接种量为3×105 cell/mL、微载体浓度为3 g/L,pH值7.0~7.2、DO饱和度50%、搅拌转速60~80 r/min、温度37 ℃。培养1 d后,将IBDV病毒分别以不同的病毒感染复数(MOI)0.2、0.5、1感染V0细胞,37 ℃培养,分别于感染后的24、48、72、96、120、144 h取样收获病毒,反复冻融3次后,取上清在CEF细胞上检测病毒的50%组织细胞感染量(TCID50),筛选出合适的病毒接种量和收获时间。
2结果与分析
2.1获得适应无血清培养的Vero细胞
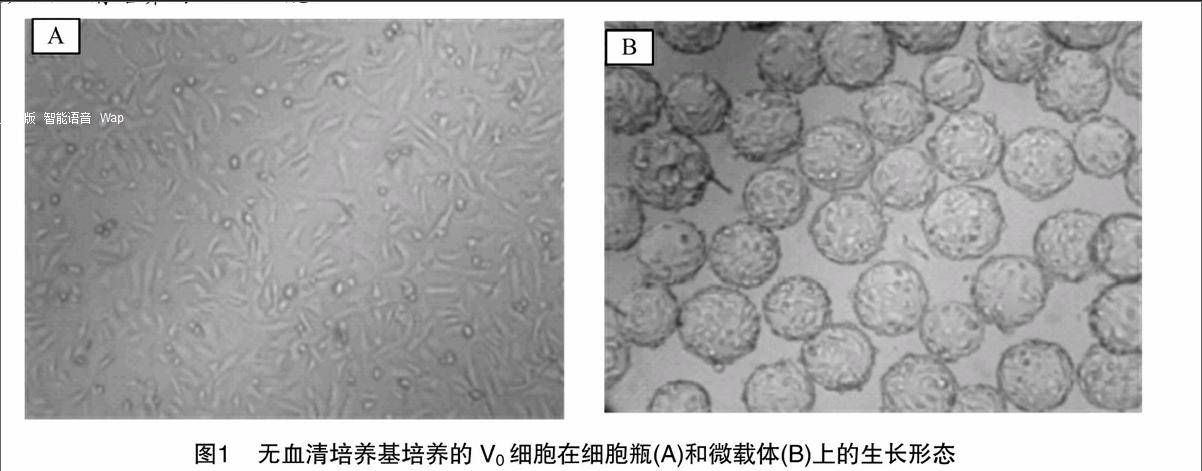
经直接无血清适应,筛选获得能在无血清培养基中生长的Vero细胞。在适应过程中,细胞外观表现为逐渐拉长,但仍为上皮样细胞样特性(图1-A)。细胞生长速度较有血清条件下缓慢,一般需2 d才能达到对数生长期。经逐步传代适应后,无血清培养细胞对数生长期提前至1 d,与正常有血清培养的Vero细胞生长接近。
2.2最佳初始接种密度为3×105 cell/mL
采用3 g/L的微载体,V0细胞的初始接种量分别为1×105、3×105、5×105 cell/mL,每天取样观察细胞状态、计数及培养基营养成分分析。细胞初始接种密度过低(1×105 cell/mL)时,细胞生长缺乏初始密度效应而造成生长相对缓慢,细胞终密度也相对较低。细胞初始接种密度为3×105 cell/mL时,接种后6 h细胞贴附到微载体上,细胞黏球率(每个微载体上黏附的细胞表面积占微载体总面积比例)为25%,培养2 d后细胞开始进入对数生长期,细胞黏球率为50%,培养至4 d,细胞达到最大密度1.18×106 cell/mL,黏球率95%以上(图1-B)。细胞密度过高(5×105 cell/mL),初始占球率就比较高,约50%左右,细胞生长空间有限。
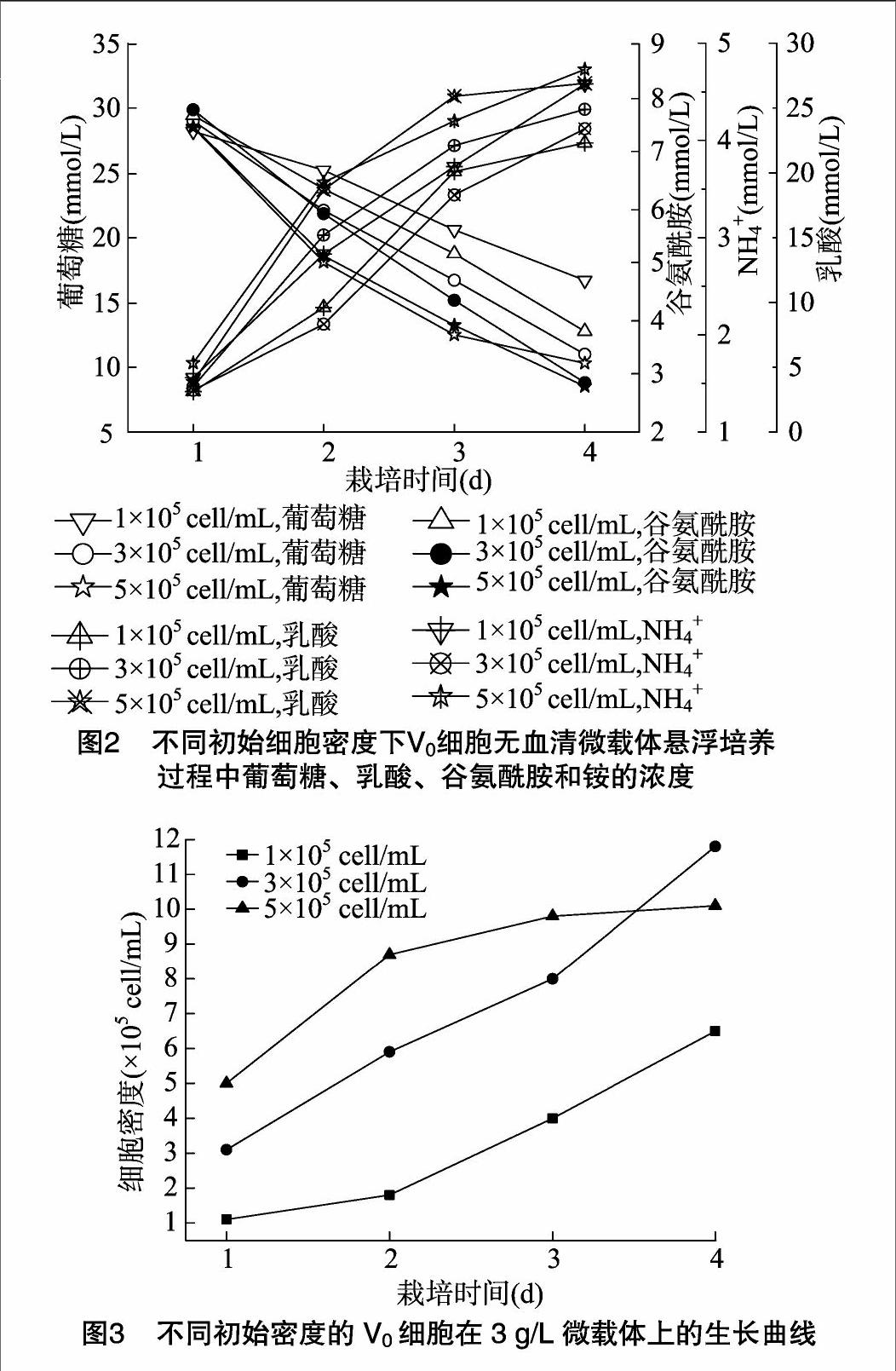
对不同初始密度接种的细胞培养条件进行取样检测,主要检测细胞培养基中的Gluc、Glu、Lac和NH4+营养成分及代谢产物的含量。检测结果(图2)表明,较高的初始接种密度(5×105 cell/mL)会导致细胞生长液中的Gluc、Glu消耗过快,在生长过程中累积较多的Lac和NH+4。细胞初始密度为3×105 cell/mL时,细胞均匀分布于每个微载体表面,同时也为后续预留了充裕的生长空间,细胞生长良好,最终获得较高细胞终密度。
2.3最佳微载体浓度为3 g/L
采用细胞的初始接种量3×105 cell/mL,微载体浓度分别为1、3、5 g/L,取样观察细胞状态、计算细胞数量,绘制细胞生长曲线,结果(图3)表明,微载体浓度偏低(1 g/L)时,细胞相对微载体偏多,导致初始黏球率高,在50%以上,细胞后期缺乏生长空间。微载体浓度为3 g/L时,接种后6 h细胞贴附到微载体上,黏球率约为25%;培养2 d后细胞生长进入对数生长期,黏球率约为50%,培养至4 d,细胞达到最大密度1.18×106 cell/mL,黏球率95%以上(图4)。微载体浓度偏高(5 g/L)时,会导致初始黏球率偏低,约10%以下,与微载体数量相比,细胞数量相对较低,细胞生长因缺乏初始密度效应而造成生长相对缓慢。
2.4最佳病毒接种量为0.2 MOI和收获时间为120 h
V0细胞微载体悬浮培养,初始接种密度3×105 cell/mL、微载体浓度3 g/L,培养24 h后,细胞100%贴附微载体,分别
按照0.2、0.5和1的MOI感染Vero细胞,37 ℃培养5 d后收获病毒液,反复冻融3次后,取上清在CEF细胞上检测病毒的TCID50。检测结果表明,接种0.2 MOI的IBDV,感染V0细胞120 h后,收获病毒,病毒效价可达109.368 TCID50/mL(表1)。IBDV病毒感染24 h后,取样观察细胞,细胞数量增多,无脱落现象,病毒效价没有增长;感染72 h后,细胞开始出现部分脱落现象,病毒效价开始增长;感染96~120 h,病毒效价明显增长,大部分细胞从微载体上脱落;感染144 h后,病毒效价开始降低(表1)。
3讨论与结论
在生物反应器中以持续搅拌的方式用微载体悬浮培养动物细胞,与滚瓶培养细胞方式相比,前者营养物质、气体及热量的传递更加充分均匀,为细胞生长及病毒增殖提供相对优质、恒定的培养环境,整个生物过程控制精确,易于重复。所以采用生物反应器微载体悬浮培养细胞,制备抗原,更有利于保证疫苗产品质量稳定,并有利于规模化放大[9]。以生物反应器微载体悬浮培养Vero细胞增殖IBDV技术将成为我国兽用疫苗生产的趋势。
本研究驯化获得无血清培养的Vero细胞株,并对其在实验室小规模培养条件下增殖IBDV的条件进行优化。采用3种不同细胞接种量分别接种3种不同浓度的微载体,结果表明,细胞接种量在3×105 cells/mL、微载体浓度在3 g/L时,细胞增殖状态良好,细胞最终密度达到1.18×106 cell/mL。本次结果与贾涵婧等的结果[10]一致,即当1个微载体周围的细胞数控制在一定范围之内,能够使细胞生长获得一个较为稳定的平台期。葡萄糖、谷氨酰胺等营养物不会消耗过多以致耗竭,而乳酸、铵等代谢副产物的累积对培养环境造成的压力较小,有利于细胞生长,最终获得一个比较高的细胞密度。
病毒接种量过高,会产生大量的不完全病毒;病毒接种量过低,又会影响病毒的产量[8]。本研究结果亦提示,MOI为0.2时,接毒后96~120 h IBDV的TCID50最高。IBD病毒感染Vero细胞后72~96 h,病毒效价开始上升,120 h后病毒效价达到峰值,144 h后病毒效价有所下降,故确定IBD病毒适宜的收获时间为120 h。
综上所述,本试验优化了无血清微载体培养Vero细胞和增殖IBD病毒的实验室小规模培养的适宜条件,采用Applikon的3 L生物反应器对无血清Vero细胞进行培养,控制细胞培养的温度、溶氧、pH值,进行不同细胞量、微载体浓度、病毒接种量和收毒时间的优化,为应用大型生物反应器大规模制备IBDV疫苗奠定了基础。
参考文献:
[1]Wang Z,Wang Y S,Tang Y D,et al. Development of the detection system for infectious bursal disease virus[J]. Chinese Journal of Veterinary Science,2008,28(9):1015-1019.
[2]高玉龙,秦立廷,王笑梅. 家禽病毒性免疫抑制病流行特点与防控对策[J]. 中国家禽,2012,34(15):5-11.
[3]Tree J A,Richardson C,Fooks A R,et al. Comparison of large-scale mammalian cell culture systems with egg culture for the production of influenza virus A vaccine strains[J]. Vaccine,2001,19(25/26):3444-3450.
[4]Newman C. Serum-free cell culture-the ethical,scientific and economic choice[J]. Biomed Scient,2003(9):941-942.
[5]Paillet C,Forno G,Kratje R,et al. Suspension-Vero cell cultures as a platform for viral vaccine production[J]. Vaccine,2009,27(46):6464-6467.
[6]Soons Z I,van den Ijssel J,van der Pol L A,et al. Scaling-up vaccine production:implementation aspects of a biomass growth observer and controller[J]. Bioprocess and Biosystems Engineering,2009,32(3):289-299.
[7]冯磊,吴培培,褚轩,等. Marc-145细胞无血清培养液组分的优化筛选[J]. 生物技术通讯,2012(6):790-799.
[8]Mochizuki M. Growth characteristics of canine pathogenic viruses in MDCK cells cultured in RPMI 1640 medium without animal protein[J]. Vaccine,2006,24(11):1744-1748.
[9]Costa W A,Cunha R S,Bolzan V L,et al. Immunogenicity and safety of a new Vero cell rabies vaccine produced using serum-free medium[J]. Vaccine,2007,25(48):8140-8145.
[10]贾涵婧,王逸群,黄锭,等. 微载体浓度与细胞接种密度对MDCK细胞生长的影响[J]. 中国生物制品学杂志,2014(9):1138-1144.冯磊,王伟峰,吴培培,等. 生物反应器中PRRSV工业规模增殖工艺的建立[J]. 江苏农业科学,2016,44(2):247-251.
