人参锈腐病及疫病生防放线菌筛选
2016-04-11张鸿雁刘勇任勇洋
张鸿雁++刘勇++任勇洋


摘要:为获得对人参锈腐病、疫病具有拮抗活性的土壤放线菌,利用平板稀释培养法从黑龙江省人参基地和西北地区分离获得578株放线菌,用琼脂块法初筛,用生长速率法、悬滴法对抑菌效果较好的菌株进行抑菌活性复筛。结果获得5株对病原菌具有显著拮抗性的生防放线菌,其中Act11、Act12菌株的拮抗效果尤为显著,Act12最大抑菌圈直径达20.15 mm,其发酵液对病原菌菌丝的抑制率最大为83.4%,对人参锈腐病孢子萌发抑制率最高为 99.8%。
关键词:人参;生防放线菌;筛选;诱腐病;疫病
中图分类号: S435.675文献标志码: A文章编号:1002-1302(2016)02-0173-04
收稿日期:2015-03-20
基金项目:黑龙江八一农垦大学博士启动基金(编号:XDB2015-17)。
作者简介:张鸿雁(1970—),女,黑龙江宝清人,博士,教授,研究方向为微生物资源与利用。E-mail:zhy2219@163.com。人参根系病害包括根腐病、锈腐病、立枯病、疫病、菌核病等,其中锈腐病、疫病危害严重。人参根系病害虽可以采用农艺措施预防[1-2],但目前主要通过化学农药防治[3],该方法会造成人参药用部分农药大量残留,严重影响人体健康及疗效。因此,利用生物技术防治人参根系病害较之于其他作物更为重要,是保证人参药材安全性的必要措施。生物制剂具有施用安全、不污染环境、不产生抗性等优点,具有良好的应用前景。目前国内外关于人参根系病害的生物防治研究主要集中在生防细菌[4]、生防真菌方面[5],对生防放线菌研究的报道较少。放线菌作为抗生素的主要产生菌,在自然界中分布广泛,产生活性物质的能力强,活性物质种类多,是值得关注的生防菌资源。本研究筛选对人参锈腐病、疫病病原菌有拮抗作用的生防放线菌,旨在为人参根系病害生物防治提供有较强拮抗作用的放线菌菌株。
1材料与方法
1.1材料
1.1.1供试菌株供试病原菌共 5 株,分别为人参锈腐病菌3.3591(Cylindrocarpon destructans 3.359 1,以下简称3.3591),人参锈腐病菌R2(以下简称R2),西洋参锈腐病菌81782(C. destructans 81782,以下简称81782),西洋参锈腐病菌81783(C. destructans 81783,以下简称81783),西洋参恶疫霉81805(Phytophthora cactorum 81805,以下简称81805)。其中81782、81783 为相同病原菌的不同菌株,选用不同菌株的目的是研究不同生防放线菌对同一菌种不同菌株抑制作用的差别。供试放线菌共578株,其中408株分离自黑龙江省铁力市桃山镇人参土壤,170株筛选自青海、西藏、新疆等地区土壤的拮抗放线菌,由西北农林科技大学微生物资源研究室提供。
1.1.2培养基用马铃薯蔗糖琼脂培养基(PDA)分离、纯化、活化、保存病原菌。用高氏1号琼脂培养基(GA)活化、拮抗性琼脂块制备培养放线菌。用GA液体培养基制备放线菌发酵液。
1.2方法
1.2.1皿内拮抗性筛选平皿初筛采用琼脂块法[6]。将制备好的病原菌菌悬液均匀涂布于PDA平板上,用打孔器从培养7 d的待筛放线菌平皿中打取直径5 mm的放线菌琼脂块,正置于PDA平板上,28℃培养5~7 d,测定抑菌圈直径及抑菌圈透明度。皿内复筛:将初筛得到的具有良好拮抗效果的放线菌菌株进行2次皿内拮抗复筛,方法同皿内初筛。计算不同抑菌程度的拮抗菌占供试放线菌的比例(S)和占拮抗放线菌的比例(A)。根据拮抗环宽度、透明度、放线菌产孢量,挑选出有应用价值的拮抗菌。
S=不同抑菌程度拮抗菌株数供试放线菌株数×100%;
A=不同抑菌程度拮抗菌株数供试拮抗放线菌株数×100%。
1.2.2无菌发酵滤液抑菌率测定无菌发酵滤液制备:将供试放线菌以一定比例接种到液体培养基中,28℃、150 r/min摇床振荡培养9 d。将发酵液4 000 r/min离心5 min后,用0.45 μm灭菌微孔滤膜过滤除菌,得无菌滤液。
采用生长速率法[7]测定相对抑菌率。将滤液与冷却至40℃左右的PDA培养基按体积比1 ∶4混匀倒平板,以同比例加入无菌水的PDA培养基为对照。用5 mm打孔器分别打取5株病原菌菌饼,置于PDA平板中央,每个处理3次重复,25℃培养7 d,定时测量菌落直径,计算相对抑菌率(X)。
抑菌率(X)=(对照菌落直径-5)-(处理菌落直径-5)对照菌落直径-5。
1.2.3无菌发酵滤液对病原菌孢子萌发的影响病原菌孢子悬液制备:将活化好的病原菌接种到PDA培养基上,28℃培养6~9 d,加入无菌水冲洗孢子至50 mL三角瓶中,用血球计数板测数,制得浓孢子悬液。按发酵液、无菌水体积比分别为1 ∶2、1 ∶3、1 ∶4、1 ∶5配制不同浓度的发酵滤液;加入病原菌孢子,使孢子浓度约为10亿个/mL,每个处理3 次重复。25℃培养,用悬滴法[8]测定孢子萌发率。计算孢子萌发率(R)、抑制率(I)。
萌发率(R)=萌发孢子数总孢子数×100%;
抑制率(I)=(对照萌发率-处理萌发率)对照萌发率×100%。
1.2.4生防放线菌对病原菌菌丝的作用采用对峙培养法[9]测定菌丝相互作用。用特制金属“U”形铲在PDA平板两侧挖约0.5 cm宽的小槽,在小槽一侧先接种放线菌,28℃培养4 d后在小槽另一侧接种病原菌,然后在小槽上放置无菌盖玻片,28℃继续培养4 d,取出盖玻片,于40倍显微镜下观察菌丝间的相互作用。
2结果与分析
2.1放线菌对病原菌的皿内拮抗作用
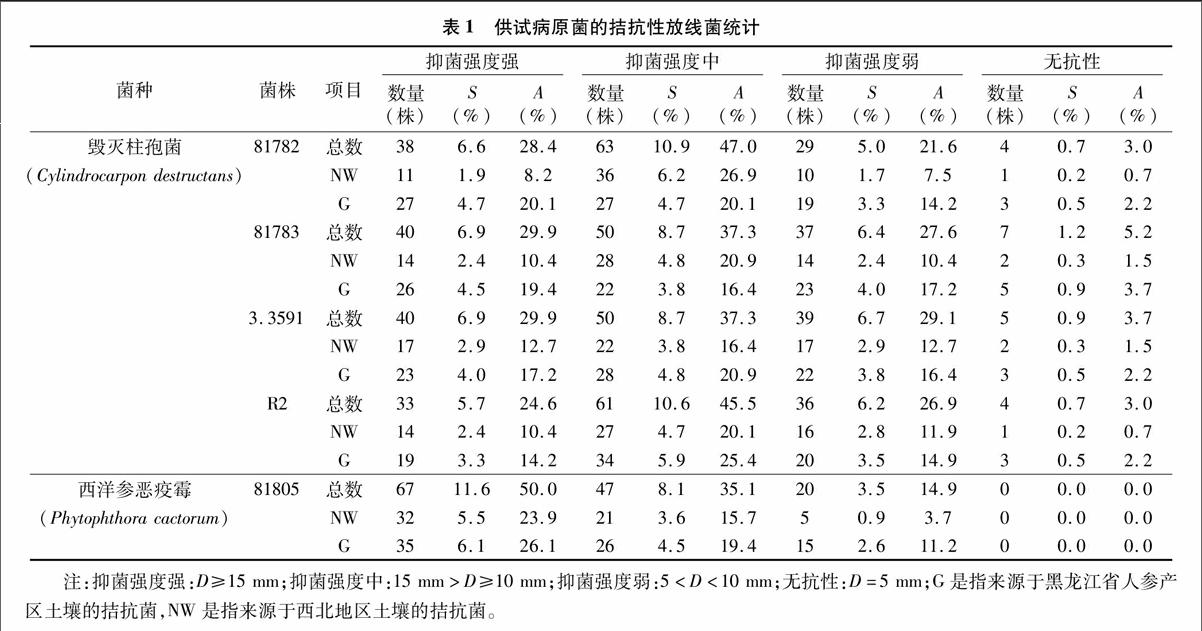
从578 株生防放线菌中筛选到134株具有广谱拮抗性的放线菌,其中来自西北地区土壤的菌株58株,占供试放线菌的10.0%,占广谱拮抗菌的43.3%;来自人参基地的菌株76株,占供试放线菌的13.1%,占全部拮抗菌的56.7%。
试验表明,在134株拮抗菌中,对5株病原菌81782、81783、3.3591、R2、81805的皿内抑菌圈≥20 mm,且抑制圈透明的放线菌分别有11、14、6、9、21株,分别占全部拮抗菌总数的8.2%、10.4%、4.5%、6.7%、15.7%。由表1可见,对5株病原菌拮抗性强的菌株(抑菌圈≥15 mm)分别为38、40、40、33、67株,占全部广谱拮抗菌的28.4%、29.9%、29.9%、24.6%、50.0%。从表1还可见,筛选出的拮抗菌对81805的拮抗性最强,对R2的拮抗作用最弱。
从表1可见,在筛选到的 134 株具有广谱拮抗性的放线菌中,对西洋参锈腐病菌同一菌种不同菌株81782、81783而言,拮抗性强和无抗性放线菌在拮抗放线菌总数中所占比例相当,分别为28.4%、29.9%和3.0%、5.2%。说明同一拮抗菌对同一病原菌的不同菌株拮抗性略有差异。
表1中,从来源于黑龙江省人参产区的76株广谱拮抗菌对5株病原菌的拮抗性看,对81805拮抗性强的菌株最多(26.1%),其次是81782(20.1%)、81783(19.4%),对分离自黑龙江省人参产区的毁灭柱孢菌R2 抗性强的拮抗菌最少(14.2%),但对该菌具有中等拮抗性的放线菌最多(25.4%)。
经初筛,有9株拮抗菌拮抗作用较强,分别为来源于黑龙江省人参产区土壤的6株拮抗菌114、184-3、224、15-2、23-2、110-2和来源于西北地区土壤的3株拮抗菌Act11、Act12、Act1。9株拮抗菌对5株病原菌的抑制作用均很强,且拮抗环完全透明、产孢量较高。
2.29株放线菌无菌发酵滤液对供试病原菌的抑制作用
从表2可见,9株生防菌无菌发酵滤液对5株病原菌均有抑制作用,即均能产生抗菌物质,抑制病原菌生长,其中来源于黑龙江省人参产区土壤的114、184-3、224和来源于西北地区土壤的Act11、Act12抑菌效果表现突出。
从表2可见,7 d时9株拮抗放线菌对81782、81783的抑制效果相当,抑菌率分别为14.9%~57.0%和16.6%~54.2%,其中114、184-3、224、Act11、Act12菌的抑菌效果较好。7 d 时9株拮抗放线菌对人参锈腐病菌3.3591的抑制率为16.6%~64.2%,其中Act11、114、Act12菌的抑菌效果较好,Act12放线菌在6 d时的抑菌率达69.4%。7 d 时9株拮抗放线菌对毁灭柱孢菌R2的抑制率为7.8%~66.9%,Act12、Act11、114、184-3、224菌的抑制效果较好;在5 d时,184-3菌的抑菌率为80.9%。7 d 时9株拮抗菌对81805的抑制效果优于其他4株病原菌,抑菌率为31.4%~73.4%,Act12菌在6 d时的抑菌率为83.4%。
2.3无菌发酵滤液对病原菌孢子萌发率的影响
率达到65%以上,其中Act11、Act12菌对81782孢子和224、Act11菌对81783孢子萌发的抑制作用较强。在发酵液、无菌水体积比为1 ∶2时,Act11、Act12菌对81782孢子萌发的抑制率分别为80.9%、89.3%,224、Act11菌对81783孢子萌发的抑制率分别为90.9%、90.7%。110-2、15-2菌的抑制能力最差,在发酵液、无菌水体积比为1 ∶5时,这2株菌还有促进81782孢子萌发的作用。
从表3可见,114、184-3、224、Act11、Act12菌对人参锈腐病菌3.3591、毁灭柱孢菌R2孢子萌发的抑制率达到65%以上。这5株拮抗菌发酵液对3.3591、R2的拮抗能力超过81782、81783。其中Act11、Act12菌的抑制作用最强,在发酵液、无菌水体积比为1 ∶2时,Act12放线菌对3.3591、R2孢子萌发的抑制率分别达98.0%、99.8%。对于病原菌81805,孢子萌发的抑制率强的菌株同其他4株病原菌,在发酵液、无菌水体积比为1 ∶2时,Act11菌的抑制率为97.1%,Act12、184-3、114抑制率分别为87.7%、87.4%、87.4%。
3结论与讨论
针对人参根部病害的生物防治研究集中于细菌、真菌,有关放线菌的研究较少,且现有放线菌研究主要在韩国及吉林省人参产区进行,尚未见黑龙江省人参产区锈腐病及疫病生防放线菌的研究。Shim 等从韩国人参土壤中分离出3株链霉菌(S. variabilis、S. virgincae、S.grisedus),发现其对人参锈腐病菌有拮抗作用[10]。周淑香等从吉林省人参根际土壤中筛选到2 株对人参锈腐菌均有较强抑制作用的放线菌,施用该放线菌后人参锈腐病病情指数显著降低,防治效果达40%以上,人参产量比对照有所增加,对参根成活率、株高和茎粗影响不显著[11]。马廷会从吉林省人参地筛选到对锈腐病有拮抗性的放线菌菌株MS32,抑菌率为76.45%,并对其进行了发酵条件研究和菌株鉴定,认为其可能是S. naraensi[12]。
本研究筛选出5株生防放线菌,对人参根系病害病原菌表现出良好的拮抗性,其中Act12、Act12放线菌的拮抗效果尤为明显,其他3株生防放线菌对病原菌也表现出一定拮抗性。
参考文献:
[1]白容霖,张惠丽,曲力涛. 参地施用有机粪肥对人参锈腐病和参根质量的作用[J]. 特产研究,2000,22(2):34-36.
[2]Reeleder R D. The ginseng root pathogens Cylindrocarpon destructans and Phytophthora are not pathogenic to the medical herbs Hydrastis canadenisis and Actaea racemosa[J]. Canadian Journal of Plant Pathology,2003,25(2):218-224.
[3]夏淑春,鄢洪海,李如生,等. 人参根部病害发生类型及防治建议[J]. 特产研究,2000,22(2):60-62.
[4]Jang Y,Kim S G,Kim Y H. Biocontrol efficacies of Bacillus species against Cylindrocarpon destructans causing ginseng root rot[J]. The Plant Pathology Journal,2011,27(4):333-341.
[5]王慧,傅俊范,周如军,等. 木霉菌ECT-01-2对人参锈腐病菌的拮抗作用[J]. 河南农业科学,2008(2):66-69.
[6]牛晓磊,薛泉宏,涂璇,等. 6株生防放线菌对辣椒疫霉的皿内拮抗研究[J]. 西北农林科技大学学报:自然科学版,2005,33(1):55-58.
[7]刘大群,杨文香,祁碧菽,等. 拮抗链霉菌Men-myco-93-63及其发酵液对棉花黄萎病菌生长的影响[J]. 河北农业大学学报,1999,22(4):79-82.
[8]方中达. 植病研究法[M]. 3版.北京:中国农业出版社,1998.
[9]梁军锋. 辣椒疫病生防菌的防病促生效应、作用机制及应用研究[D]. 杨凌:西北农林科技大学,2006.
[10]Shim J O,Lee M W. Identification of Streptomyces species antagonistic to Fusarium solani or Cylindrocarpon destructans causing ginseng root rots[J]. Korean Journal of Mycology,1991,19(1):66-73.
[11]周淑香,张连学,鲁新,等. 2株放线菌对人参锈腐病的生物防治效果[J]. 安徽农业科学,2012,40(2):803-804,806.
[12]马廷会. 人参锈腐病拮抗放线菌的筛选及鉴定[D]. 长春:吉林农业大学,2008.任凤山,张安盛,邢光耀. 中华草蛉2龄幼虫对棕榈蓟马的捕食功能反应与搜寻效应[J]. 江苏农业科学,2016,44(2):177-179.
