甜高粱的糖分积累与蔗糖合成酶基因表达规律的相关性
2016-04-11夏卜贤安云蓉高建明罗峰
夏卜贤+++安云蓉+++高建明+++罗峰+++陈晓木++李欧静++王飞扬+++石东峰+++关小楠+++吴宏玉+++裴忠有
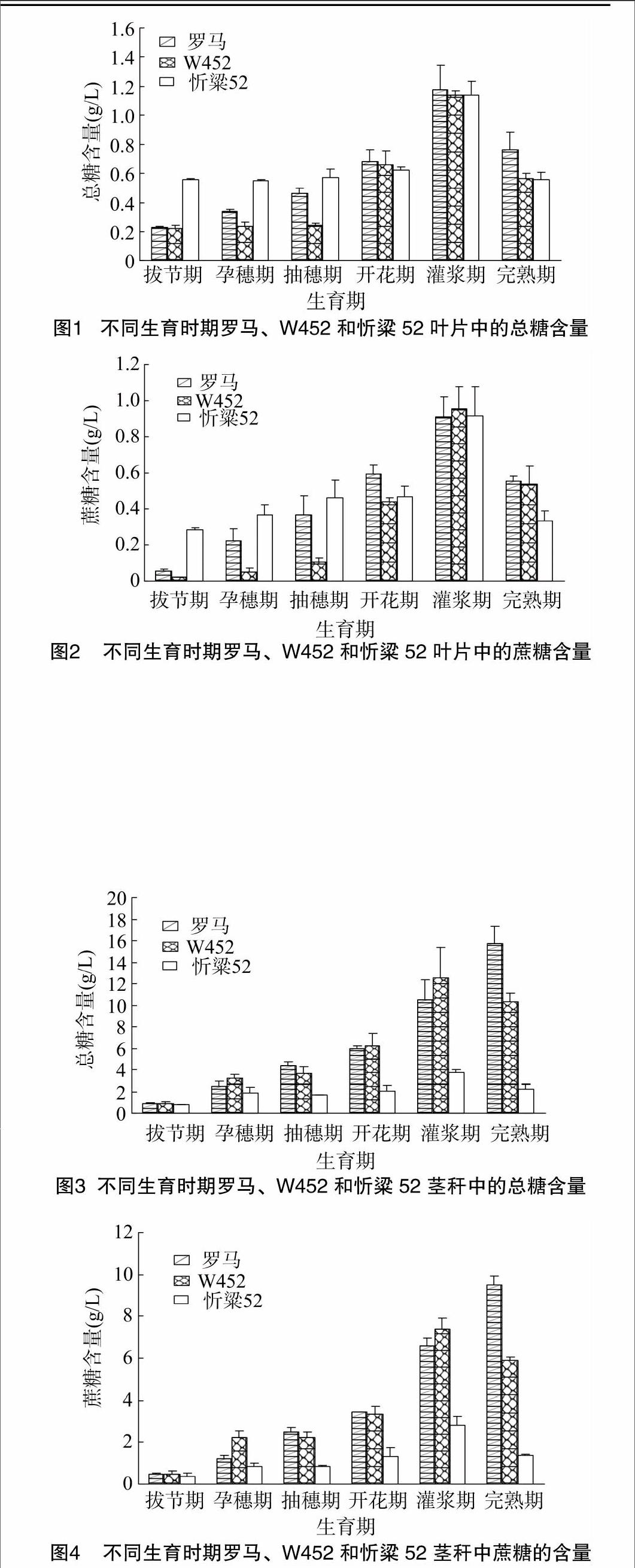
摘要:以甜高粱品种罗马和W452与普通高粱品种忻粱52不同生育时期的叶片和茎秆为材料,对总糖、蔗糖含量以及蔗糖合成酶(sucrose synthase,SS)基因表达规律进行研究。结果表明:在叶片和茎秆的整个生育期,蔗糖为总糖的主要组成成分,其含量与总糖含量的变化趋势一致;在叶片中,总糖和蔗糖含量从拔节期开始逐渐升高,在灌浆期达到最高,随后又下降,同时通过对SS基因表达规律研究发现,SS基因表达量先于蔗糖含量在开花期达到最高;在茎秆中,蔗糖含量占总糖含量的60%,甜高粱的糖分含量明显高于普通高粱,完熟期时糖分含量达到最高,而SS基因表达规律与在叶片中表达相似,开花期达到最高,随后有所下降。因此,通过研究糖分含量变化趋势与SS基因表达规律为甜高粱分子育种创造了条件。
关键词:甜高粱;qRT-PCR;糖分积累;蔗糖合成酶;基因表达;生育期
中图分类号: S514.01文献标志码: A文章编号:1002-1302(2016)02-0133-03
收稿日期:2015-01-05
基金项目:天津市中青年骨干创新人才培养计划;天津市科技支撑计划(编号:12ZCZDNC00100);天津市高校优秀青年教师资助。
作者简介:夏卜贤(1989—),男,安徽马鞍山人,硕士研究生,主要从事作物遗传育种研究。E-mail:beifanglang12689@126.com。
通信作者:裴忠有(1967—),男,辽宁大连人,博士,研究员,主要从事甜高粱育种研究。E-mail:zhongyoupei@tjau.edu.cn。随着化石能源的日趋枯竭和环境的日益恶化,发展生物能源成为未来解决能源危机的主要途径。甜高粱作为普通高粱的一个变种,因其茎秆糖分、汁液含量高,是目前被公认最有发展前景的能源作物之一,而其总糖、蔗糖含量以及蔗糖合成酶(sucrose synthase,SS)基因调节蔗糖合成代谢已成为研究热点。谢凤周对甜高粱品种丽欧的总糖含量变化趋势进行了研究,发现在整个生育时期呈逐渐增加的趋势,在完熟期达到最高[1];杨相坤等对蔗糖含量在整个生育时期的变化进行了研究,发现从孕穗期到蜡熟期呈逐渐升高、在蜡熟期达到最高值后又略有下降趋势[2-3]。通过对甜高粱茎秆汁液化学成分的分析发现,蔗糖是其主要成分,占55%左右[4]。而蔗糖受作为调节植物蔗糖代谢的关键酶之一SS的调节,该酶在小麦胚芽中被首次发现[5-7],它参与淀粉、纤维素和ATP 等的合成,调动蔗糖进入各种代谢途径,且可逆合成和分解蔗糖,进而调节植物的生长过程等[8];该酶在番茄中控制蔗糖的合成及运转,保持相对较强的活性[9];该酶在甘蔗中有利于运输过程中将库器官的蔗糖卸出[10],在多数植物中存在2种同工酶SS1和SS2,其中SS1主要分解蔗糖,SS2主要合成蔗糖[11],并且利用酶联免疫法(ELISA)验证了蔗糖合成酶表达量与蔗糖含量具有显著的相关性[12]。本研究测定了普通高粱及甜高粱的叶片和茎秆中糖分含量,分析了SS基因的表达量,这对进一步了解叶片、茎秆中的糖分积累与SS基因表达之间的关系具有非常重要的意义。
1材料与方法
1.1材料种植及取样
本试验所用甜高粱品种为罗马和W452,普通高粱品种为忻粱52,均由天津农学院高粱育种课题组提供。试验分别于2011年和2012年在天津农学院作物标本园进行,试验地前茬为玉米,土壤肥力偏低。5月1日播种,设3次重复,每个小区面积30 m2,行长4 m,行距0.5 m,株距0.2 m;播种时每个小区施底肥硫酸钾和复合肥各0.075 kg;中耕除草3次。分别在拔节期、孕穗期、抽穗期、开花期、灌浆期和完熟期等6个生育时期随机重复3次取样,取材部位为植株中部茎秆和完全展开的叶片,一部分用于测定样品的各种糖分含量,另一部分用液氮速冻后置于-80 ℃冰箱内保存,用于研究叶片及茎秆中蔗糖合成酶基因的表达规律。
1.2试剂
测量总糖含量所用试剂包括酒石酸钾钠(C4H4O6KNa·4H2O)、硫酸铜(CuSO4·5H2O)、无水葡萄糖(C6H12O6)、氢氧化钠(NaOH)、亚铁氰化钾[K4F4(CN)6·3H2O]、次甲基蓝(C16H18CIN3S·3H2O)、盐酸(HCl),均购自天津北方天医化学试剂厂。测量蔗糖含量所用试剂包括色谱纯乙腈、果糖标准品、葡萄糖标准品、蔗糖标准品,均购于中国药品生物制品检定所。RNA提取试剂盒购自北京百泰克(Bioteke)公司。反转录试剂盒购于北京康为世纪公司,定量反应中的内参基因β-actin及SS基因引物由生工生物工程(上海)股份有限公司合成。
1.3蔗糖和总糖含量的测定
高粱茎秆和叶片通过榨汁处理后分成2份,分别用于总糖和蔗糖含量的测定,简单步骤为:向10 mL样品中加入1 mL 浓硫酸,混匀,68 ℃水解10 min,随后使用SGD-Ⅳ型全自动还原糖测定仪测定汁液中的总糖含量,采用高效液相色谱仪(安捷伦CP-3800)测定样品中的蔗糖含量,每个样品重复测定3次。
1.4总RNA的提取与分析
根据百泰克公司RNA提取试剂盒的说明提取高粱叶片和茎秆的总RNA。将提取的RNA溶于溶解液(TE Buffer)后,使用微量核酸测定仪检测其纯度和浓度,并取1 μL的RNA样品进行琼脂糖凝胶电泳,以确定所提取RNA的完整性。
1.5利用qRT-PCR分析蔗糖合成酶基因的表达
本试验应用Primer 5、Oligo 6 等软件在甜高粱SS基因Susy2(FJ513325)跨内含子区设计正向引物5′-GTCCCTCAAGACACTCCCT-3′和反向引物5′-ATTGGATTGGGCAAAGTAG-3′;高粱β-actin基因引物,其正向序列为5′-ACGGCCTGGATGGCGACGTACATG-3′,反向序列为5′-GCAGAAGGACGCCTACGTTGTGTAC-3′。按北京康为世纪公司反转录试剂盒的说明将RNA样品反转成cDNAs。cDNAs合成后,将cDNA以10倍梯度稀释成5个浓度,使用ABI公司的7 500 fast荧光定量PCR仪分别扩增靶基因SS和内参基因β-actin,根据2个基因的循环数与初始模板浓度制备2个基因的标准曲线,并进行扩增效率的检测。扩增体系如下:cDNAs 2 μL,依次加入12.5 μL的2×Ultra SYBR Mixture,10 μmol/L上下游引物各1 μL,最后加入RNase-Free的水补至25 μL。实时荧光定量PCR的扩增程序如下:预变性95 ℃10 min;95 ℃ 15 s,60 ℃ 1 min,40个循环。溶解曲线程序为:95 ℃15 s;60 ℃1 min;95 ℃15 s;60 ℃15 s。每个样本进行3次重复,同时设置无模板阴性作对照。在反应结束后仪器会自动生成熔解曲线图及样品的循环数(CT)。
2结果与分析
2.1不同生育时期叶片中总糖和蔗糖含量的变化
为了解作为糖分合成部位——叶片中糖分的变化情况,本试验对甜高粱品种罗马和W452与普通高粱品种忻粱52不同生育时期总糖和蔗糖含量进行测定。由图1、图2可以看出,3个品种糖分含量都呈现出从拔节期至灌浆期一直上升而到完熟期又有所下降的趋势,3个品种叶片中的糖分含量在开花期和灌浆期比较接近;从整个生育时期来看,3个品种的糖分含量在灌浆期都有1个突然升高的过程,可能这一时期是糖分合成的活跃期,等到完熟期时,大量糖分被运输至茎秆或穗子中,所以此时又呈下降趋势。
2.2不同生育时期茎秆中总糖和蔗糖含量的变化
甜高粱为普通高粱的一个变种,它的茎秆已经成为糖分储存的库,而普通高粱的茎秆只是作为糖分转移的流。从图3、图4可以看出,W452和忻粱52总糖和蔗糖含量从拔节期开始逐渐升高,灌浆期时达到最高值,随后在完熟期又有所下降;而罗马的总糖和蔗糖含量则在完熟期达到最高值,这种变化趋势与叶片中的糖分积累规律基本一致,同样甜高粱茎秆中的糖分在灌浆期也有1个突然升高的过程,但忻粱52茎秆中的总糖和蔗糖含量与甜高粱相比在各个时期都比较低,这可能是因为灌浆期时叶片中大量合成的蔗糖流向库器官——
穗,很少在茎秆中储存,导致茎秆中的糖分含量比较低,而甜高粱的库器官除了穗以外还有茎秆,因此甜高粱茎秆中总糖和蔗糖含量明显高于普通高粱茎秆;同时本试验还在3个品种中进行蔗糖和总糖含量的相关性分析,结果表明,不同高粱品种茎秆内的蔗糖和总糖含量都呈现出极显著相关(r>0.98,P<0.01),蔗糖含量约占总糖含量的60%。
2.3不同生育时期叶片中SS基因表达分析
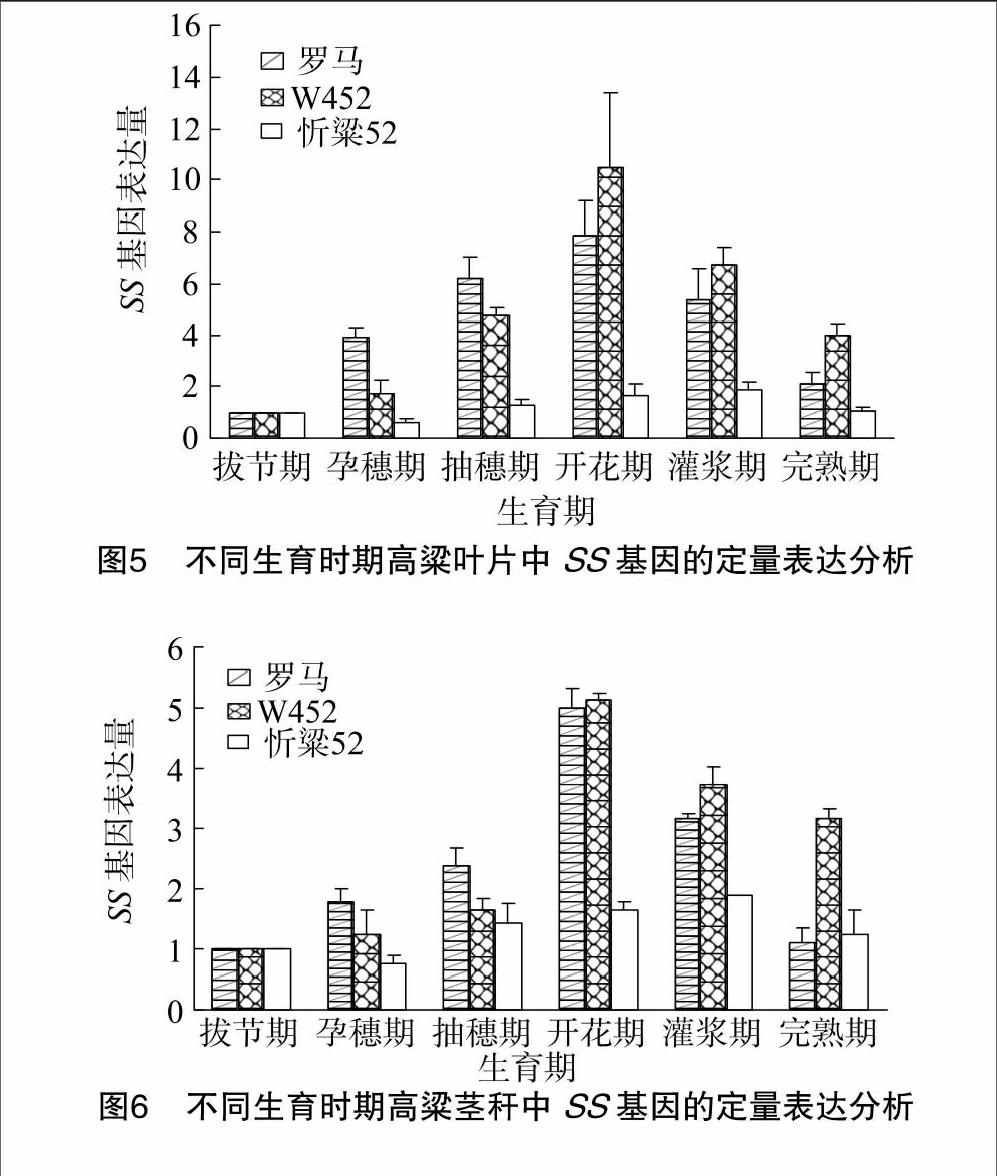
SS基因是植物蔗糖合成重要的调节基因,本试验利用qRT-PCR方法对3个高粱品种罗马、W452与忻粱52的不同生育时期叶片中的SS基因表达进行分析。从图5可以看出,以拔节期的表达量作为参照,SS基因在不同高粱品种中的表达量均呈现先升后降的趋势,开花期达到最高,此时罗马、W452和忻粱52的表达量分别是拔节期的7.8、10.5、1.8倍,可见2个甜高粱品种变化幅度较忻粱52明显,忻粱52叶片中SS基因在不同生育时期的表达量变化差异不大。
2.4不同生育时期茎秆中SS基因表达分析
茎秆为甜高粱糖分的主要储藏器官,了解茎秆中SS基因的表达与甜高粱中蔗糖积累的关系具有非常重要的意义。本试验对罗马、W452和忻粱52的各个时期茎秆中SS基因的表达量进行分析(图6)。在整个生育时期,SS基因在3个品种内的表达量均呈现先升后降的趋势,至开花期表达量最高,此时罗马、W452和忻粱52的表达量分别为拔节期的5.0、5.1、1.7倍,说明SS基因在甜高粱品种中的表达量明显比普通高粱高,而且SS基因在忻粱52各个生育期中的表达量变化差异不大,该结果与叶片中SS基因的表达量变化趋势一致,但是表达量明显比叶片中的少。
2.5高粱SS基因表达与蔗糖含量的相关性分析
通过以上蔗糖和SS基因在叶片和茎秆整个生育时期的变化趋势可以看出,SS基因的变化趋势与蔗糖含量的变化趋势基本表现一致,但SS基因表达量的最高峰是在开花期,蔗糖含量最高峰出现在灌浆期,主要因为开花期蔗糖合成活跃,但开花这一生理过程会消耗植物大量的能量[13],以致流向库器官中的蔗糖少,所以在灌浆期之前蔗糖积累缓慢;到了灌浆期,虽然SS基因的表达量有所下降,但高粱生长发育的几大耗能过程已结束,此时合成的蔗糖开始积累,导致叶片和茎秆中的蔗糖含量在灌浆期有1个短暂快速的积累过程。因此,总的来说SS基因的表达与蔗糖积累具有一定的相关关系。
3结论与讨论
高粱为重要的能源和饲料作物,已为世界各国所认同[14]。甜高粱茎秆无论是用来生产燃料乙醇还是用作青贮饲料,了解其糖分组成及决定因素对提高糖分含量具有重要意义。结果表明,蔗糖是甜高粱糖分的主要成分,而先前对蔗糖含量的相关性研究大都基于酶活性的测定,酶活性分析容易受提取过程和外界因素的影响,不一定能完全反映两者之间的关系[15]。本试验通过对不同高粱品种叶片和茎秆中糖分含量的测定与SS基因表达量的比较,获得更直接的与糖分积累相关的数据。
从生理上来说,叶片是高粱的源器官,蔗糖在叶片中合成后经长距离运输到库器官。本研究结果表明,叶片中总糖和蔗糖含量的变化呈“山峰”的变化趋势,灌浆期时糖分含量达到最高值,但是通过对SS基因表达规律的研究发现,SS基因表达量先于蔗糖含量在开花期达到最高,即糖分含量的积累具有一定的延后性。
普通高粱的穗是其唯一的“库”,而甜高粱作为普通高粱的变种具有2个库器官——穗和茎秆。相较于普通高粱而言,甜高粱茎秆中总糖和蔗糖的积累明显提高,完熟期时糖分含量达到最高值,而SS基因的表达规律与在叶片中相似,开花期表达量达到最高值,随后有所下降。甜高粱茎秆在开花期之前蔗糖含量普遍较低,并且不同品种的差异并不大,从灌浆期开始,蔗糖大量积累,到完熟期时甜高粱茎秆中蔗糖含量高于普通高粱忻粱52将近6倍,这与陈维维等的研究结论[16-17]相似。但从2个甜高粱品种整个生育时期茎秆中糖分含量的变化来看,W452从拔节期到开花期呈上升趋势,灌浆期达到最大值后略有下降,这一结果与张华文等的研究结论[18]一致,而罗马直到完熟期时才达到最大值,其结果与丽欧品种的特性[1]相似,这可能是因为罗马(生育期为190 d)的生育期比W452(132 d)长的原因,测定罗马完熟期糖分时已是深秋,低温条件降低了细胞的呼吸强度,使得糖分一直处于不断积累的过程。
从拔节期开始,SS基因的表达量一直呈缓慢上升的趋势,到开花期突然增高,此时合成的大量蔗糖主要供给开花过程[13],随着这一耗能过程的结束,光合产物开始往储藏器官中运输。虽然随后SS基因的表达量有所下降,但此时甜高粱茎秆中的蔗糖含量积累速度仍然大于消耗速度,这也正是在生长后期糖分不断积累的原因。本试验结果表明,SS基因很可能是影响糖分差异的主要基因,说明在以后育种上可以根据SS基因的表达量为指标筛选获得优质的甜高粱品种。
参考文献:
[1]谢凤周. 糖高粱茎秆糖分积累规律初步研究[J]. 辽宁农业科学,1989(5):50-51.
[2]杨相昆,田海燕,陈树宾,等. 不同种植密度对甜高粱糖分积累的影响[J]. 西南农业学报,2009,22(1):60-63.
[3]Lingle S E. Sucrose metabolism in the primary culm of sweet sorghum during development[J]. Crop Science,1987,27(6):1214-1219.
[4]Billa E,Koullas D P,Monties B,et al. Structure and composition of sweet sorghum stalk components[J]. Industrial Crops and Products,1997,6(3/4):297-302.
[5]黄东亮,李双喜,廖青,等. 植物蔗糖磷酸合成酶研究进展[J]. 中国生物工程杂志,2012,32(6):109-119.
[6]Sturm A,ebková V,Lorenz K,et al. Development-and organ-specific expression of the genes for sucrose synthase and three isoenzymes of acid β-fructofuranosidase in carrot[J]. Planta,1995,195(4):601-610.
[7]Cardini C E,Leloir L F,Chiriboga J. The biosynthesis of sucrose[J]. J Biol Chem,1955,214:149-155.
[8]卢合全,沈法富,刘凌霄,等. 植物蔗糖合成酶功能与分子生物学研究进展[J]. 中国农学通报,2005,21(7):34-37,57.
[9]齐红岩,李天来,刘海涛,等. 番茄不同部位中糖含量和相关酶活性的研究[J]. 园艺学报,2005,32(2):239-243.
[10]Martin T,Frommer W B,Salanoubat M,et al. Expression of an arabidopsis sucrose synthase gene indicates a role in metabolization of sucrose both during phloem loading and in sink organs[J]. The Plant Journal for Cell and Molecular Biology,1993,4(2):367-377.
[11]Komatsu A,Moriguchi T,Koyama K,et al. Analysis of sucrose synthase genes in citrus suggests different roles and phylogenetic relationships[J]. Journal of Experimental Botany,2002,53(366):61-71.
[12]杨明,刘丽娟,李莉云,等. 甜高粱蔗糖合酶表达与蔗糖积累的相关分析[J]. 作物学报,2009,35(1):185-189.
[13]Kawano S,Nagai Y. The productive and reproductive biology of flowering plants[J]. Journal of Plant Research,1975,88(4):281-318.
[14]詹秋文. 高粱与苏丹草的遗传及其杂种优势利用的研究[D]. 南京:南京农业大学,2007:1-2.
[15]刘鹏,胡昌浩,董树亭,等. 甜质型与普通型玉米籽粒发育过程中糖代谢相关酶活性的比较[J]. 中国农业科学,2005,38(1):52-58.
[16]陈维维,再吐尼古丽·库尔班,涂振东,等. 不同种植密度对甜高粱糖分积累及SS、SPS活性的影响[J]. 作物学报,2013,39(8):1507-1513.
[17]聂元冬,钟海丽,顿宝庆,等. 甜高粱SAI基因的表达与茎秆糖分积累的相关性分析[J]. 中国农业科学,2013,46(21):4506-4514.
[18]张华文,秦岭,王海莲,等. 甜高粱茎秆糖分含量的变化分析[J]. 华北农学报,2009,24(增刊2):69-71.王晓静,李成奇,张金宝,等. 黄萎病菌胁迫下棉花根系茉莉酸、水杨酸含量的动态变化[J]. 江苏农业科学,2016,44(2):141-143.
