广藿香不同部位总DNA提取方法比较与PTS基因克隆
2016-04-11陈英吴友根杨东梅张军锋林
陈英++吴友根++杨东梅++张军锋++林尤奋

摘要:分别采用PEX法、CTAB法和SDS法3种方法提取广藿香叶、茎、根的基因组总DNA,用琼脂糖凝胶电泳和紫外分光光度计检测总DNA提取效果。结果表明,SDS法能高效一致地提取广藿香根、茎、叶的总DNA。以叶总DNA为模板,通过PCR技术扩增广藿香醇合成酶(PTS)基因,测序得到PTS基因(中国广藿香)的全长序列,长度为3 058 bp,包括7个外显子和6个内含子,共编码552个氨基酸。该PTS基因所推导的氨基酸序列与GenBank中已登录的印度广藿香PTS氨基酸序列存在4.7%的差异。
关键词:广藿香;总DNA;广藿香醇合成酶;克隆
中图分类号: S567.21+9.01文献标志码: A文章编号:1002-1302(2016)02-0081-04
收稿日期:2015-01-30
基金项目:国家自然科学基金(编号:81360618);海南省中药现代化专项(编号:2012ZY015)。
作者简介:陈英(1990—),女,贵州遵义人,硕士研究生,从事南药种质资源与活性成分研究。E-mail:814006138@qq.com。
通信作者:吴友根,博士,副教授,硕士生导师,从事南药种质资源与活性成分研究。E-mail:ccyyccii@163.com。纯度高、质量好的DNA是开展分子生物学研究的基础,是分子遗传学试验成功与否的关键因素之一[1],植物总DNA的纯度还是影响PCR反应的限制因素之一[2]。由于不同植物、甚至同一植物的不同部位,其代谢产物的种类和含量不同,尤其是多糖、多酚和蛋白质等,很难找到一种高质量DNA提取的通用方法[3-4]。因此对植物总DNA提取方法进行比较分析、改进,以获得高质量的植物总DNA提取方法极为重要。广藿香[Pogostemon cablin (Blanco) Benth.]为唇形科刺蕊草属一年生草本植物,以干燥的地上部分入药,是我国常用的芳香化湿类中药之一,常用于治疗湿浊中阻、脘痞呕吐、寒湿闭暑、暑湿倦怠、腹痛吐泻、鼻渊头痛、胸闷不舒等疾[5]。百秋李醇(又名广藿香醇),是一种存在于天然植物中的三环倍半萜化合物,广泛应用于药品、食品及日用化妆品行业,是广藿香挥发油的主要成分之一,被历版《中华人民共和国药典》规定用作评价广藿香药材及广藿香油质量的指标成分。百秋李醇的生物合成途径类型与青蒿素的合成途径相同,属于类异戊二烯代谢途径中的倍半萜类分支途径。广藿香醇合成酶(patchoulol synthase,PTS)被认为是百秋李醇合成调控的关键酶[6]。2006年,Deguerry等从印度广藿香中克隆得到了PTS基因的cDNA及DNA序列[6];2014年,Hartwig等从印度另一栽培居群的广藿香中克隆得到了PTS基因的cDNA序列,其编码的氨基酸序列与之前报道的cDNA序列所编码的氨基酸序列存在3.4%的差异[7]。中国广藿香作为一种独立栽培居群的广藿香,其PTS基因序列与之前报道的印度广藿香是否存在差异,目前尚未见报道。因此,本试验选用3种常用的DNA提取方法,比较其对广藿香根、茎、叶3个部位的提取效果,并以DNA为模板进行PTS基因的PCR扩展并克隆,比较克隆得到的基因序列及其编码的氨基酸序列与之前报道的印度广藿香的异同,为广藿香PTS基因的进一步利用奠定基础。
1材料与方法
1.1材料与试剂
供试的广藿香植物材料采于海南大学园艺园林学院广藿香资源圃,采集生长期为5个月的广藿香叶、茎、根,采后用液氮冷冻处理,-80 ℃保存,备用。
试验所用的主要试剂有SDS(十二烷基磺酸钠)、CTAB(十六烷基三乙基溴化铵)及PEX(乙基磺原酸钾)(北京鼎国公司),Taq DNA聚合酶、pMD19-T载体、感受态细胞(上海生物工程有限公司),其余试剂均为进口或国产分析纯,引物合成及测序由北京诺赛基因组研究有限公司完成。
1.2方法
1.2.1DNA提取采用PEX法、CTAB法及SDS法[8-10]分别提取广藿香根、茎、叶的基因组总DNA。
1.2.2DNA质量与浓度检测取5 μL提取的广藿香各部位总DNA溶液于0.8%琼脂糖凝胶在1×TAE缓冲液中电泳,检测DNA的完整性。并取1 μL DNA样品,用无菌水稀释50倍,用紫外分光光度计检测D260 nm、D280 nm,并计算D260 nm/D280 nm,以确定其纯度及得率。
1.2.3PTS基因PCR扩增根据Genbank中登录的PTS基因的DNA序列,设计全长引物用于广藿香PTS基因的扩增,引物序列如下:正向引物5′-ATGGAGTTGTATGCCCAAAG-3′;反向引物5′-TTAATATGGAACAGGGTGAA-3′。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸3 min,35个循环;72 ℃终延伸10 min,4 ℃保存。
1.2.4基因克隆和测序1%琼脂糖凝胶电泳检测PCR产物,利用DNA凝胶回收试剂盒纯化目的条带,将纯化后的PCR产物与pMD19-T载体连接,并转化至感受态细胞DH5α,经蓝白斑筛选和PCR扩增鉴定获得阳性克隆。测序由北京诺赛基因组研究有限公司完成。
2结果与分析
2.1总DNA的光吸收比值和DNA得率
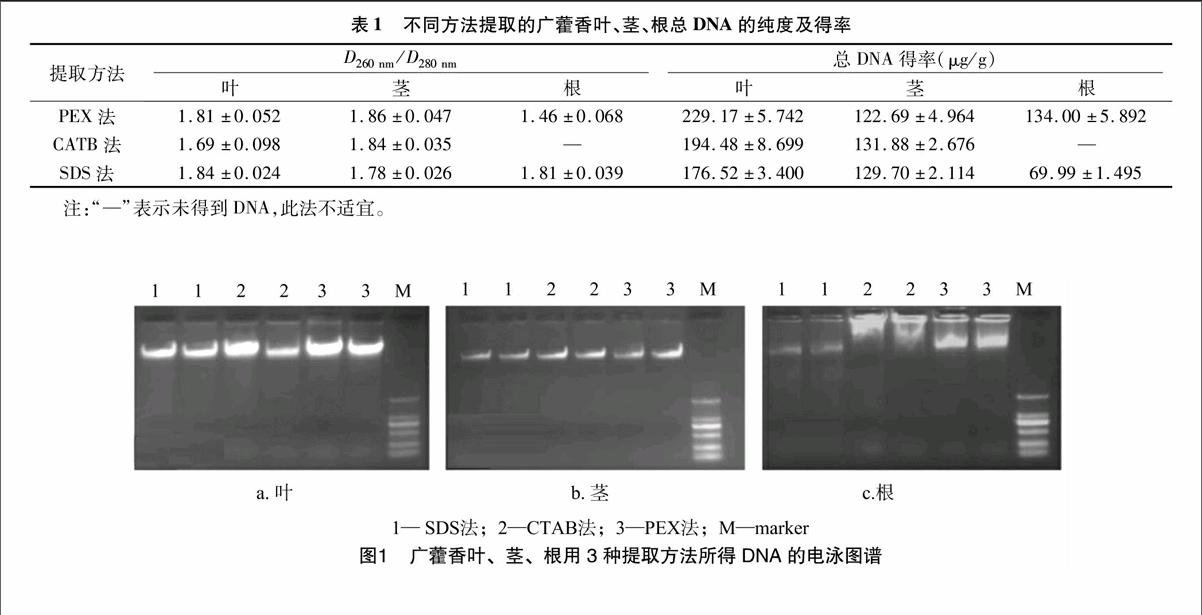
通常将光吸收比值作为衡量总DNA纯度的一个重要指标,D260 nm/D280 nm在1.7~1.9之间说明DNA纯度较高,低于1.7说明存在蛋白质、多糖等杂质污染,高于2.0说明有RNA污染[10]。由表1可知,CTAB法所提取的叶总DNA及PEX法提取的根总DNA,其D260 nm/D280 nm分别为1.69和1.46,说明含有杂质,而CTAB法未能从根中提取到DNA。PEX法和SDS法提取的叶总DNA,3种方法提取的茎总DNA及SDS法提取的根总DNA,其D260 nm/D280 nm界于1.78~1.86,说明纯度较高。PEX法提取的叶总DNA得率最高,为229.17 μg/g,其次是CTAB法,SDS法得率最低。3种方法提取的茎总DNA得率相差不大,从122.69 μg/g到131.88 μg/g,而PEX法提取的根总DNA得率较SDS法高,约为其2倍。
2.2广藿香3个不同部位基因组总DNA完整性的检测
由图1可知,不同部位的样品其总DNA得率存在一定差异,广藿香叶在3种不同的提取方法中均能得到较多的总DNA,其次是茎,而根提取的总DNA量则较少。CTAB法在广藿香根中未提取出DNA,在叶中虽提取出了DNA,但出现轻微降解现象,说明此方法不能有效提取广藿香基因组DNA,特别是提取其根中的DNA。PEX法和SDS法均能从广藿香根、茎、叶中提取到总DNA,但PEX法提取的根总DNA杂质较多,且条带弥散,说明存在降解。虽然SDS法提取的叶总DNA浓度不如PEX法高,用其提取的茎总DNA效果与另外2种方法差异不明显,但3种方法中只有SDS法可以从根中提取出条带清晰、完整性好的总DNA。因此,SDS法能高效一致地提取广藿香各部位的基因组总DNA,以此方法提取的DNA条带亮、清晰完整、纯度高。电泳检测的结果和紫外分光光度计检测的结果一致。
2.3藿香醇合成酶(PTS)基因的PCR扩增及测序
以广藿香叶总DNA为模板,进行PTS基因DNA序列的全长扩增,获得3 000 bp左右的特异条带(图2),片段大小与预期相符。测序得到3 058 bp的序列,将序列在GenBank上经Blast分析,发现与已登记的PTS基因序列DQ355151有较高的相似性,证明获得的序列为PTS基因序列。
2.4生物信息学分析
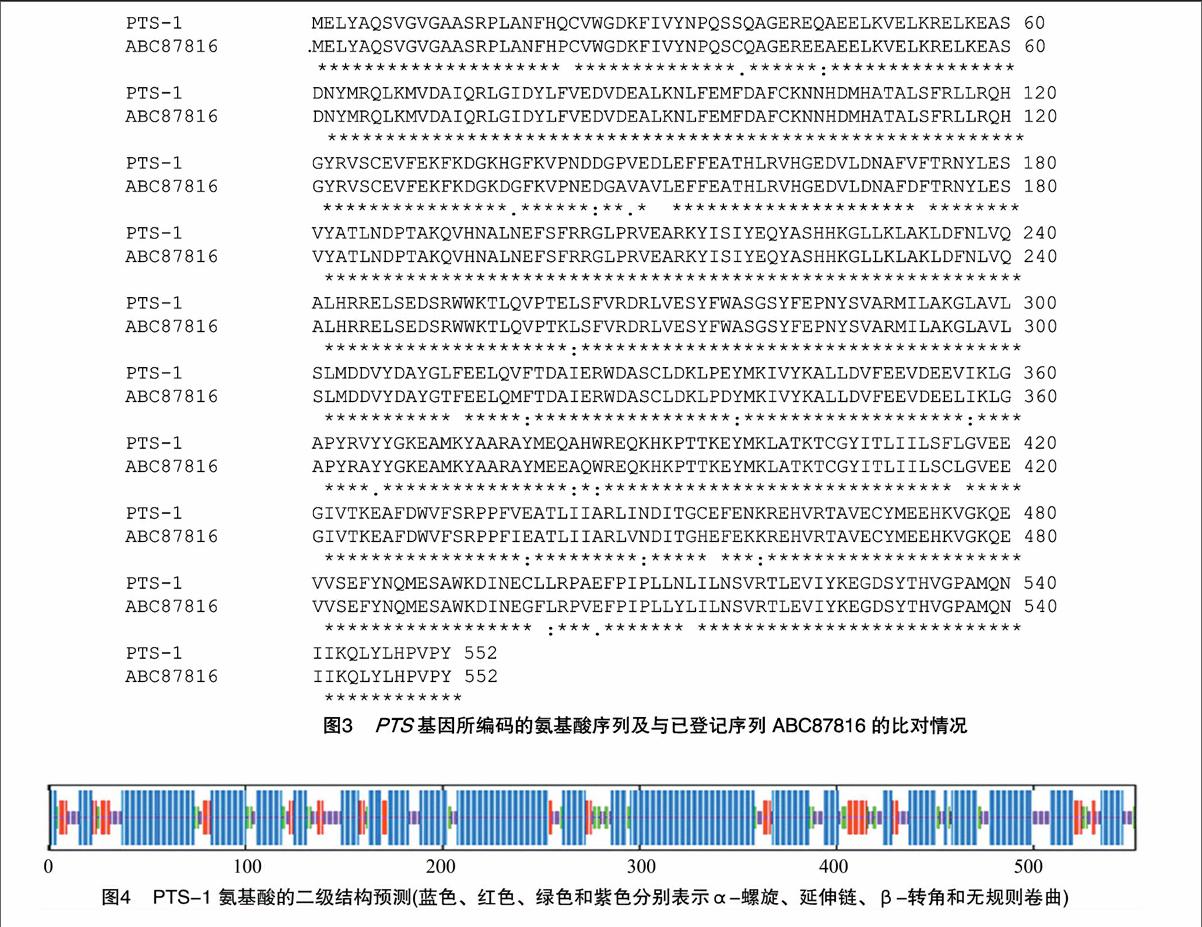
将所得的PTS基因序列与已登记的PTS基因cDNA序列进行比对,发现PTS基因序列包含了完整的7个外显子和6个内含子,7个外显子的大小分别为115、264、376、221、137、252、294 bp,6个内含子大小分别为144、455、79、119、79、523 bp。共编码552个氨基酸,等电点为5.46,将其命名为PTS-1。在氨基酸组成中,酸性氨基酸(D、E)占15.40%,碱性氨基酸(K、R)占12.14%,极性氨基酸(N、C、Q、S、T、Y)占22.28%,疏水氨基酸(A、I、L、F、W、V)占36.97%。由图3可知, 蛋白质疏
水性预测结果表明,PTS-1疏水性平均值(GRAVY)为 -0.323,表明该蛋白为亲水性蛋白。利用在线分析软件TMHMM 对PTS-1氨基酸序列进行跨膜结果预测,发现该蛋白为非跨膜蛋白。由图4可知,蛋白质二级结构预测结果表明该氨基酸序列含有4种二级结构,有363个氨基酸参与 α-螺旋,占65.76%;54个参与延伸链,占9.78%;42个参与 β-转角,占7.61%;93个参与无规则卷曲,占16.85%。本试验所得PTS基因序列与GenBank中已登记的该基因序列DQ355151相比,有53个核酸差异,所编码的氨基酸序列与已登记的广藿香PTS氨基酸序列ABC87816相比,有26个氨基酸差异,差异率为4.7%(图3)。
3讨论与结论
DNA是最重要的生物信息分子,是遗传信息的载体,能快速、经济地从植物样品中提取高产量、高纯度的基因组DNA在当前分子生物学研究中极为重要。1961年,十二烷基磺酸钠(SDS)和氯仿从细胞中分离提取DNA样品的方法被首次报道,自此,国内外学者对不同样品的DNA提取方法进行了深入的研究,至今国内外已报道了多种从植物细胞中提取DNA的方法。不同植物、甚至同种植物的不同器官,其化学成分及含量各不相同,导致DNA提取难易程度及所提出DNA的质量存在明显差异[11-15]。广藿香化学成分主要有挥发性成分和非挥发性成分2类,其中挥发性成分主要有酮类、萘类、单萜类、倍半萜烯类、醇类、烷酸类及醛类化合物等[16-17]。非挥发性成分主要为黄酮类、植物甾醇类、生物碱、三萜类、苯丙素苷类及烷酸类化合物等次生代谢产物及植物多糖[18-19],在提取DNA的过程中,这些物质会与DNA共沉淀,形成黏稠的胶状物,这些胶状物难以溶解或产生褐变,致使提取出来的DNA质量降低甚至提取不出DNA,进而抑制了PCR扩增反应。我们在提取过程中发现,从广藿香根中提取的总DNA颜色为褐色,较难溶解,而从叶和茎中提取的总DNA为白色,溶解较易。
DNA的D260 nm/D280 nm在1.7~1.9之间通常被认为纯度较高、质量较好,纯的双链DNA的D260 nm/D280 nm为1.8。如果总DNA的D260 nm/D280 nm低于1.7或高于2.0则被认为是含有一定的杂质,影响了DNA分子的光吸收值而导致的[10],这些杂质包括蛋白质、多糖、多酚和单宁类物质、RNA等。本研究所用的3种DNA提取方法中,SDS法所得总DNA的D260 nm/D280 nm为1.78~1.84,说明纯度较高,不会影响到下游PCR反应。此外,DNA得率也是衡量提取方法优劣的重要参数之一。植物总DNA得率与植物种类和来源存在一定的关系,不同物种的DNA得率不同,同一物种的不同部位,其DNA得率也存在差异,如侯艳霞等以一串红的叶片、茎段、花为材料,比较5种方法对其DNA提取效果的影响,结果表明叶片较容易得到高质量的DNA,茎段次之,花最差[9]。本研究选用的3个部位的植物材料中,叶的总DNA得率最高,为176.52~229.17 μg/g,茎次之,根最低。此外,植物材料的保存时间是影响总DNA得率的主要因素之一,保存的时间越长,DNA降解越严重,得率越低。郭红媛等在棉花的总DNA提取过程中发现,老化或储存时间较长的材料中,棉酚、多糖、单宁等次生代谢物质含量较高,在提取过程中易与DNA结合,并且难以去除,严重影响了DNA的得率和质量[20]。
本研究得到的广藿香醇合成酶基因与已登录的该基因存在一定的差异,不仅体现在有26个氨基酸序列不同,还体现在蛋白质的结构上。PTS-1的二级结构中,有363个氨基酸参与α-螺旋,占65.76%,54个参与延伸链,占9.78%,42个参与β-转角,占7.61%,93个参与无规则卷曲,占16.85%。而已登录的广藿香醇合成酶蛋白序列ABC87816的4种二级结构中,有359个氨基酸参与α-螺旋,占65.04%,50个参与延伸链,占9.06%,46个参与β-转角,占8.33%,97个参与无规则卷曲,占16.85%。造成同一物种的同一基因序列和结构差异的因素有很多。首先,同一物种不同部位的同一类型基因可能存在差异,如Vasiliki等在对番茄(Lycopersicon esculentum)不同器官的同一功能酶进行研究时发现,在番茄中可以催化GPP形成芳樟醇的酶TPS37和TPS39,在序列上存在较大差异,前者在叶片、茎、花中都表达,而后者只在嫩叶和花中表达[21]。其次,同一物种不同品种的同一酶基因序列也可能存在差异,如Naoko等通过比较3种不同紫苏(Perilla frutescens)品种合成的香叶醇合酶基因,发现不同紫苏品种合成的香叶醇合酶蛋白序列存在 2%~3.2%的差异[22]。再者,同一物种不同生长环境,同一类型基因也可能存在差异,如王海波等通过对芦苇(Phragmites Australis)Rubisco蛋白分子的研究发现,不同生态型的2种芦苇(沙芦和水芦)的Rubisco蛋白的一级结构发生了变化,反映了该酶有基因表达的环境适应[23]。本研究选用的材料为中国广藿香,而NCBI已登录的PTS基因序列是从印度广藿香中克隆得到的,生长环境的不同可能是广藿香PTS基因存在差异的主要原因。然而,PTS基因序列和结构是否还存在其他影响因素,如不同取材部位等,还有待进一步研究。
综上所述,通过本研究可以得出如下3个结论:其一,在所选用的3种方法中,SDS法可以高效一致地提取广藿香根、茎、叶的基因组总DNA,而CTAB法不能从根中提取到DNA,且该法提取的叶总DNA存在降解,PEX法提取的根总DNA杂质较多,降解严重。其二,广藿香叶总DNA得率最高,其次是茎,根得率最低。其三,中国广藿香PTS基因的DNA序列与印度广藿香相比,有53个核酸存在差异,二者编码的氨基酸序列有4.7%的差异,引起基因差异的具体原因,还需进一步研究确定。
参考文献:
[1]Murray M G,Thompson W F. Rapid isolation of high molecular weight DNA[J]. Nucleic Acids Research,1980,8(19):4321-4325.
[2]Xin Z,Velten J P,Oliver M J,et al. High-throughput DNA extraction method suitable for PCR[J]. BioTechniques,2003,34(4):820-824,826.
[3]刘遵春,廖明安. 金花梨基因组DNA提取方法及部位的比较研究[J]. 安徽农业科学,2005,33(11):2062-2063.
[4]黄晓丹,张云贵,应铁进. 高质量植物基因组DNA的提取[J]. 植物生理学通讯,2006,42(2):311-314.
[5]中国药典委员会.中华人民共和国药典(一部)[S]. 北京:化学工业出版社,2010:42-43.
[6]Deguerry F,Pastore L,Wu S,et al. The diverse sesquiterpene profile of patchouli,Pogostemon cablin,is correlated with a limited number of sesquiterpene synthases[J]. Archives of Biochemistry and Biophysics,2006,454(2):123-136.
[7]Hartwig S,Frister T,Alemdar S,et al. Expression,purification and activity assay of a patchoulol synthase cDNA variant fused to thioredoxin in Escherichia coli[J]. Protein Expression and Purification,2014,97:61-71.
[8]雷海英,孙毅,仪治本,等. PEX法提取植物组织DNA[J]. 广东农业科学,2010(5):178-180.
[9]侯艳霞,汤浩茹,张勇,等. DNA提取方法对一串红不同部位DNA提取的比较[J]. 基因组学与应用生物学,2009,28(1):94-100.
[10]刘杰,高连明. 红豆杉属植物三种不同总DNA提取方法的分析比较[J]. 广西植物,2011,31(2):244-249,159.
[11]陆敏佳,莫秀芳,王勤,等. 藜麦基因组DNA提取方法的比较[J]. 江苏农业科学,2014,42(4):42-45.
[12]Couch J A,Fritz P J. Isolation of DNA from plantshigh in polyphenolics[J]. Plant Molecular Biology Reporter,1990,8(1):8-12.
[13]白雪嵩,赵昶灵,陈中坚,等. 5种提取三七基因组DNA方法的比较[J]. 江苏农业科学,2014,42(5):54-56.
[14]刘塔斯,林丽美,龚力民,等. 分子标记中植物DNA提取方法的研究进展[J]. 中南药学,2005,3(6):370-373.
[15]张晓波,许沛东,赵艳. 野牛草基因组DNA提取方法的筛选[J]. 江苏农业科学,2014,42(8):26-28.
[16]Zhang L G,Zhang C,Ni L J,et al. Rectification extraction of Chinese herbsvolatile oils and comparison with conventional steam distillation[J]. Separation and Purification Technology,2011,77(2):261-268.
[17]Li F,Li C J,Ma J,et al. Four new sesquiterpenes from the stems of Pogostemon cablin[J]. Fitoterapia,2013,86:183-187.
[18]黄烈军. 中药广藿香化学及生物活性成分研究[D]. 贵阳:贵州大学,2008:15-23.
[19]张岗. 广藿香非挥发性成分研究[D]. 广州:广东药学院,2007:21-23.
[20]郭红媛,佘茂云. 一种改良的棉花总DNA提取方法[J]. 山西农业科学,2009,37(2):3-5.
[21]Falara V,Akhtar T A,Nguyen T T,et al. The tomato terpene synthase gene family[J]. Plant Physiology,2011,157(2):770-789.
[22]Masumoto N,Korin M,Ito M. Geraniol and linalool synthases from wild species of Perilla[J]. Phytochemistry,2010,71(10):1068-1075.
[23]王海波. 不同生境两种生态型芦苇Rubisco蛋白分子的差异分析[D]. 兰州:兰州大学,2006:33-45.李波,史文璐. 氮磷钾配比对玉米干物质积累、产量、品质的影响[J]. 江苏农业科学,2016,44(2):85-89.
